蓝靛果中可降解有机酸的酵母菌株筛选及鉴定
卢思言,曾祥玉,王鑫源,苗曦文,文连奎,贺 阳
(吉林农业大学食品科学与工程学院,吉林长春 130118)
蓝靛果(Lonicera edulis)为忍冬科、忍冬属植物,又名蓝靛果忍冬,俗称羊奶子或山茄子,在长白山区有分布。蓝靛果富含丰富的花青素、有机酸和矿物质、维生素等营养成分,为药食两用植物,除提取花青素外,目前多加工果汁、果酒、果酱等产品。因蓝靛果含有较高的有机酸,影响果酒等产品口感[1−3],筛选具有降酸作用的微生物十分必要。
果酒降酸方法主要有物理降酸法、化学降酸法及生物降酸法[4−7],其中生物降酸是通过微生物发酵来分解有机酸以达到降酸目的,对果酒质量和果酒稳定性影响最小,同时还能增加风味,是果酒降酸研究的热点[8]。目前生物降酸主要是苹果酸-乳酸发酵降酸,粟酒裂殖酵母发酵降酸以及通过基因重组技术构建新型酵母菌株进行降酸[9−11]。酵母菌降酸的原理是把有机酸转化为酒精和CO2而达到降酸的目的[12]。郝爱玲等[13]选取筛选自酒庄的菌株东方伊萨酵母M130,降解猕猴桃中的柠檬酸,降酸率达18.12%,且发酵结束后酒体澄清、透明,香气浓郁。胡小露[14]筛选获得的锁掷酵母属酵母菌可将柠檬酸含量由10.23降至4.66 g/L,同时可使蓝莓酒中柠檬酸含量由1.14降至0.59 g/L,且总糖、酒精度、花青素几乎不变。黄鹭强[15]通过对粟酒裂殖酵母苹果酸基因克隆,构建整合型质粒并在产朊假丝酵母中进行表达,使获得的重组酵母菌株CU-6具有降解苹果酸的能力,降酸率达59.56%。杨华等[16]筛选出一株对红豆越橘果酒具有明显降酸效果的二孢接合酵母BY-9,该降酸菌株可以使红豆越橘果酒的总酸含量下降12.26%,试验结果表明二孢接合酵母具有良好的降酸能力,同时对酒精的耐受体积分数为20%,对SO2耐受质量浓度为300 mg/L。
目前,能够降解多种有机酸的菌株研究较少,本文首次从长白山蓝靛果中筛选到能够同时降解苹果酸、柠檬酸、酒石酸的菌株,利用26S rDNA序列分析及生理生化试验对降酸菌株进行鉴定,研究其对葡萄糖、SO2及酒精的耐受性,降低蓝靛果等长白山野生浆果中有机酸含量,从而为开发果酒产品及菌株后续的实际应用提供参考。
1 材料与方法
1.1 材料与仪器
蓝靛果 2019年6月采于吉林省抚松县,采摘后用冰袋保存运回吉林农业大学农产品加工及贮藏工程实验室备用;酵母浸出粉胨葡萄糖琼脂培养基(Yeast Peptone Dextrose Agar Medium)、YPD液体培养基(YPD Broth) 青岛海博生物科技有限公司;酒石酸、苹果酸、柠檬酸 分析纯,北京化工厂;L-酒石酸、苹果酸、柠檬酸标准品(色谱纯) 上海源叶生物科技有限公司;甲醇(色谱纯) 赛默飞世尔有限公司;DNA胶回收试剂盒、真菌基因组DNA抽提试剂盒 上海生工生物工程股份有限公司;常规药品试剂均为国产分析纯或优级纯。
HZQ-F160生化振荡培养箱 上海博远实业有限公司医疗设备厂;立式压力蒸汽灭菌锅BXM-30R
上海博讯实业有限公司医疗设备厂;低速离心机LD5-2B 北京雷勃尔离心机有限公司;生物显微镜LEICA DM1000、Verity 96well 型PCR仪 美国ABI公司;FR-980A型凝胶成像仪 上海复日科技有限公司;DYY-6C型电泳仪 北京六一仪器厂;1200 Series(G1314B VWD)高效液相色谱仪 美国安捷伦科技有限公司;Lambda365紫外分光光度计PerkinElmer公司。
1.2 实验方法
1.2.1 菌株分离纯化 将蓝靛果破碎研磨成果浆,用接种环挑取果浆在平板划线,在30 ℃生化培养箱中培养72 h,继续挑取酵母菌单菌落进行纯化培养,相同条件下继续培养72 h,重复平板画线纯化培养[17−18];配制5 g YPD液体培养基溶于100 mL蒸馏水中,灭菌后选取长势优良的酵母菌单菌落放入液体培养基中培养,在振荡培养箱中以30 ℃,150 r/min条件下培养72 h,最后进行甘油保存并命名[19]。
1.2.2 优势降酸菌株筛选及降酸进程变化 分别配制质量浓度为12 g/L的苹果酸、柠檬酸、酒石酸酸液。由于YPD培养基中有含酸物质,故最终有机酸质量浓度分别为13.33、12.53和13.04 g/L。将纯化优良的菌株分别接种到有机酸溶液当中,在振荡培养箱中以30 ℃,150 r/min条件下培养5 d[20],按照GB 5009.157-2016采用酸碱滴定法,每天测定有机酸总酸含量,重复3次取平均值,以最终降酸率为指标筛选出降酸效果较好的优势菌株。根据优势降酸菌株发酵5 d内有机酸含量变化,对降酸效果最优的菌株进行降酸效果分析。
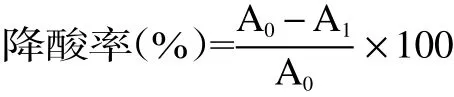
式中,A0为未加菌液的有机酸质量浓度;A1为加入菌液以后的有机酸质量浓度。
1.2.3 优势菌株降解蓝靛果汁中有机酸试验 采用高效液相色谱法测定蓝靛果样品中苹果酸、柠檬酸、酒石酸含量,与经过菌株B5按1.2.2方法降酸5 d后的蓝靛果样品对比观察降酸效果,与标准品对照有机酸种类,按峰面积和回归方程计算降酸率[21]。
高效液相色谱测定条件:色谱柱Agilent ZORBAX Extend-C18(250 mm×4.6 mm),流动相:0.1%磷酸溶液-甲醇,体积比为97.5:2.5,等度洗脱10 min,然后用较短的时间梯度让甲醇相达到100%并平衡5 min,再将流动相调整为0.1%磷酸溶液-甲醇体积比为97.5:2.5,平衡5 min。流速为0.5 mL/min,进样量为20 μL,柱温为40 ℃,检测波长为210 nm。
标准曲线:分别用超纯水溶解配制不同浓度的L-酒石酸、苹果酸、柠檬酸混合标准溶液,经0.22 μm滤膜过滤后进行HPLC测定,得到有机酸质量浓度(x)和峰面积(y)的标准曲线,回归方程及相关系数[21]。
样品处理:降酸前后的蓝靛果样品分别离心(4000 r/min,15 min),吸取上清液于容量瓶中,用超纯水定容,稀释为适合浓度。用 0.22 μm 滤膜过滤后注入高效液相色谱仪中测定[22]。
1.2.4 优势降酸菌株鉴定 菌株形态学鉴定:进行平板培养,挑取菌落进行染色镜检,观察菌落的生长状况及形态特征。将酵母菌菌液稀释涂布于酵母浸出粉胨葡萄糖琼脂培养基上,30 ℃ 培养72 h,观察其菌落形态;挑取单菌落于载玻片,经美蓝染液染色后,用生物显微镜观察其菌株生长状况及细胞形态特征[23−24]。
菌株生理生化鉴定:参照《酵母菌的特征与鉴定手册》进行降酸菌株的糖发酵、同化碳源、同化氮源试验等生理生化试验,30 ℃有氧条件下培养24 h[25]。
分子生物学鉴定:取筛选获得降酸效果良好的菌体溶于50 μL TaKaRa Lysis Buffer for Microorganism to Direct PCR(Code No.D304)中变性后离心取上清作为模板(Template DNA),反应条件为80 ℃,15 min。
使用2×TransTaq®High Fidelity(HiFi)PCR Super Mix I(TransGen Biotech,Code No:AS131),进行PCR扩增目的片段。阴性对照使用3 μL的 26S-free H2O替代模板DNA;阳性对照使用3 μL的某已知菌株26S rDNA替代模板DNA。
PCR反应体系为:Template DNA 3 μL,Forward primer(10 pmol/μL)1 μL,Reverse primer(10 pmol/μL)1 μL,2×TransTaq® HiFi PCR SuperMix I 25 μL,16Sfree H2O 20 μL,Total 50 μL。
PCR扩增条件为:94 ℃ 预变性5 min;95 ℃10 s,55 ℃ 20 s,72 ℃ 1.5 min,循环35次;72 ℃延伸10 min。
26S rDNA测序:以NL1和NL4为引物,上游引物NL1:5' -GCATATCAATAAGCGGAGGAAAA G-3';下游引物NL4:5' -GGTCCGTGTTTCAAGA CGG-3'。
将上述测序结果输入Genebank中,利用BLAST功能组件将测得的基因序列与Genebank数据库中26S rDNA 序列进行同源性比较。选取BLAST结果中得分较高的菌的26S rDNA序列,使用MEGA 5.2.1软件根据Neighbor-Joining进行系统进化树分析[26]。
1.3 降酸菌株耐受性测定
在果酒发酵过程中会加入二氧化硫杀菌,发酵底物还原糖及其他成分还会产生渗透压,发酵产物为酒精,故需测定菌株的耐受性。
1.3.1 葡萄糖耐受性的测定 将降酸酵母菌株以体积分数2%的接种量接种到50、100、150、200、250 g/L的液体培养基中,控制温度30 ℃,转速150 r/min条件下培养24 h,以液体培养基作为空白对照,分别在600 nm处测定酵母菌悬浊液OD值,平行重复3次。根据600 nm处OD 值确定降酸酵母菌株的葡萄糖耐受性[27],参照国标GB4789-17测定菌落总数。
1.3.2 酒精耐受性的测定 将降酸酵母菌株以体积分数2%的接种量接种到酒精度为6%vol、9%vol、12%vol、15%vol、18%vol 的YPD液体培养基中,控制温度30 ℃,转速150 r/min条件下培养24 h,以YPD液体培养基作为空白对照,分别在600 nm处测定酵母菌悬浊液OD值,平行重复3次。依据600 nm处OD值确定降酸酵母菌株的酒精耐受性[28],参照国标GB/T 4789.17-2003测定菌落总数。
1.3.3 SO2耐受性的测定 将降酸酵母菌株以体积分数2%接种到100、200、300、400、500 mg/L的SO2液体培养基中,控制温度30 ℃,转速150 r/min条件下培养24 h,以SO2液体培养基作为空白对照,分别在600 nm处测定酵母菌悬浊液OD值,平行重复3次。根据600 nm处OD值确定降酸酵母菌株的SO2耐受性[29],参照国标GB/T 4789.17-2003测定菌落总数。
1.4 数据处理
试验分别均进行三次重复,结果以平均值±SD表示。数据采用Excel、Origin 8.5、GraphPad Prism6、SPSS24进行处理分析及制图。
2 结果与分析
2.1 优势降酸菌株筛选及降酸效果分析
2.1.1 优势降酸菌株筛选 将分离出的酵母菌株对苹果酸、柠檬酸、酒石酸三种有机酸进行降酸率测定,结果如图1。由图1可见,共筛选出5株酵母菌株,分别命名B1、B2、B3、B4、B5,其中对三种主要有机酸降解能力分析可知,菌株B1降酸率为16.95%±0.36%、1.13%±0.23%、1.87%±0.40%;菌株B2降酸率为2.93%±0.58%、−0.29%±0.71%、12.09%±0.69%;菌株B3降酸率为−1.74%±0.42%、3.12%±0.38%、−0.65%±0.61%;菌株B4降酸率为12.18%±0.72%、7.51%±0.27%、0.66%±0.25%;菌株B5的降酸率为42.60%±0.85%、18.28%±0.80%、13.09%±0.61%;其中菌株B5对于苹果酸降酸率最高为42.60%±0.85%,降解苹果酸效果最好,同时对酒石酸和柠檬酸也具有降酸效果,故选取菌株B5为最佳降酸菌株。
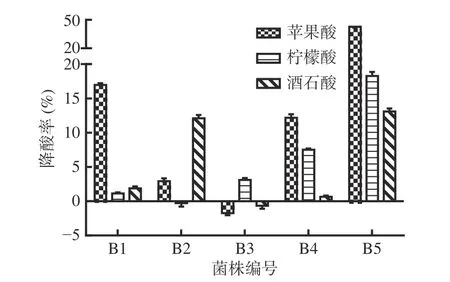
图1 不同菌株对苹果酸、柠檬酸、酒石酸的降酸率Fig.1 Acid reducing rates of malic acid, citric acid and tartaric acid by different strains
2.1.2 优势菌株B5降酸效果分析 经筛选获得的优势降酸菌株B5在液体培养基中培养5 d的含酸量变化,结果如图2。由图2可得,三种主要有机酸中苹果酸含量由13.33±0.13 g/L下降到7.65±0.09 g/L;柠檬酸含量由12.53±0.17 g/L下降到10.24±0.10 g/L;酒石酸含量由13.04±0.06 g/L下降到11.33±0.09 g/L;在发酵5 d过程中苹果酸、柠檬酸、酒石酸质量浓度均呈持续下降趋势,其中发酵第1 d三种有机酸质量浓度均无明显变化,在3~4 d过程中苹果酸质量浓度下降最多,降酸效果最明显。T检验得到降酸前后含酸量差异极显著(P<0.01)。赵玉平等[30]采用毕赤酵母对山楂汁中的有机酸进行降解,结果发现该酵母菌株可以降解柠檬酸和苹果酸,对其他有机酸无明显降酸能力,其中柠檬酸降解速度在0~72 h阶段与时间呈线性关系,苹果酸降解则发生在48~72 h。
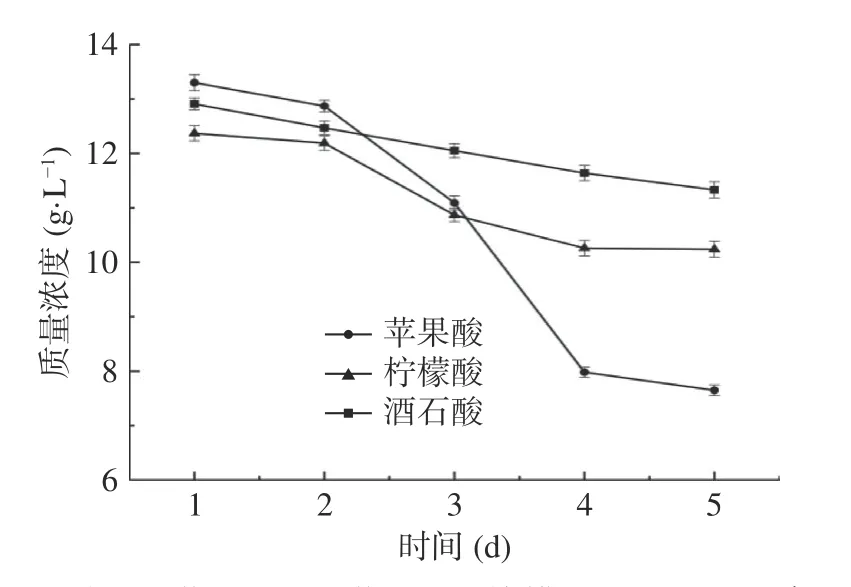
图2 不同时间菌株B5对苹果酸、柠檬酸、酒石酸的降酸率Fig.2 Acid reducing rate of strain B5 on malic acid, citric acid and tartaric acid at different time
2.2 优势菌株降解蓝靛果汁中有机酸结果
苹果酸、柠檬酸、酒石酸三种有机酸混合标准溶液,蓝靛果样品以及加入菌株B5降酸后的蓝靛果汁样品有机酸HPLC色谱图如图3(a)~图3(c) 所示。
由图3(a)可知有机酸混合标准溶液分离良好,且与图3(b)~图3(c)的三种主要有机酸出峰时间几乎对应。图3(b)为蓝靛果样品图,其中苹果酸含量最高,柠檬酸和酒石酸其次。与加入降酸菌株B5后的蓝靛果样品图3(c)相比,三种有机酸峰面积均有不同程度减小,其中苹果酸最为明显,可知酵母菌株B5对蓝靛果中苹果酸的降解效果最好,根据回归方程得降酸率为36.24%,同酸碱滴定法测定的降酸趋势一致。

图3 菌株B5对蓝靛果果汁中有机酸的降解结果Fig.3 Degradation of organic acids in Lonicera edulis juice by strain B5
2.3 优势降酸菌株鉴定
2.3.1 菌株形态学鉴定结果 将菌株B5置酵母菌固体培养基中,在30 ℃ 条件下培养5 d后进行形态观察。用肉眼观察可发现菌株B5菌落为乳白色,球形,表面光滑,质地均匀粘稠,中间略有凸起,边缘整齐。如图4(a)用生物显微镜观察细胞呈椭圆形,子囊内含有1~4枚光滑的椭圆形子囊孢子。根据初步观察可得菌株B5为酵母菌株(图4(b))。
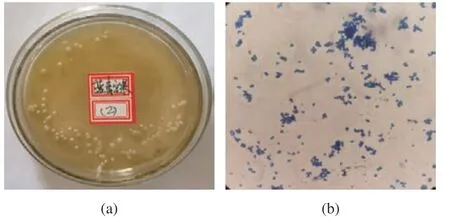
图4 菌株B5形态学鉴定图Fig.4 Morphological identification diagram of strain B5
2.3.2 生理生化鉴定结果与分析 对菌株B5进行酵母菌生理生化试验,结果见表1。由表1可知,菌株B5能利用葡萄糖发酵,而不能利用麦芽糖、蔗糖等其他糖源;菌株B5能同化的碳源有丙三醇,不能同化纤维二糖、菊糖等其他碳源;菌株B5能同化的氮源有硫酸铵,不能同化的氮源有硝酸盐。

表1 生理生化试验结果Table 1 Results of physiological and biochemical tests
2.3.3 分子生物学鉴定
2.3.3.1 菌株B5 PCR扩增反应 对纯化后的酵母菌株B5的基因组DNA进行PCR扩增,然后进行琼脂糖凝胶电泳分析(图5),在紫外灯照射下的结果可知菌株B5的电泳条带为592 bp。
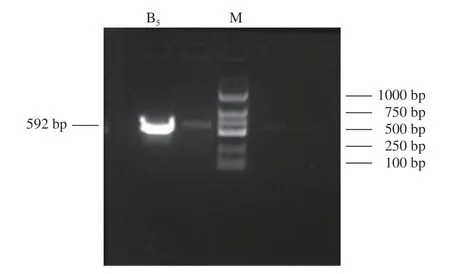
图5 PCR产物电泳图Fig.5 Electrophoresis of PCR products
2.3.3.2 菌株B5系统进化树的建立 将测序结果输入Genebank中,利用BLAST功能组件将测得的基因序列与Genebank数据库中26S rDNA 序列进行同源性比较。选取BLAST结果中得分较高的菌的26S rDNA序列,使用MEGA5.2.1软件根据Neighbor-Joining进行系统进化树构建分析,结果如图6。从系统发育树可以看出菌株B5与接合酵母属(Zygosaccharomyces)遗传距离最近,同源性最好,结合菌株B5的形态学特征及生理生化试验可以判断出菌株B5为二孢接合酵母(Zygosaccharomyces bisporus)。
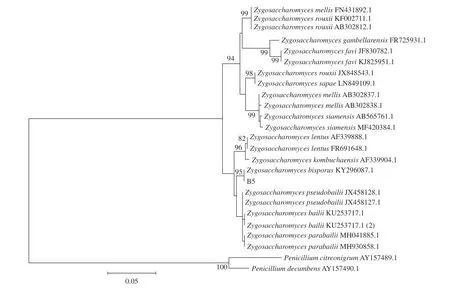
图6 菌株B5系统发育进化树Fig.6 Phylogenetic tree of strain B5
2.4 优势降酸菌株耐受性测定
2.4.1 葡萄糖耐受性的测定 菌株B5的葡萄糖耐受性能结果如图7所示。如图7所示,随着葡萄糖浓度的增长,菌体OD值呈先下降后稳定的趋势,菌株在培养基中长势越来越弱,但在250 g/L浓度的高糖浓度下依然能够存活,吸光度值为0.27±0.04,菌落数为5.10×104CFU/mL。
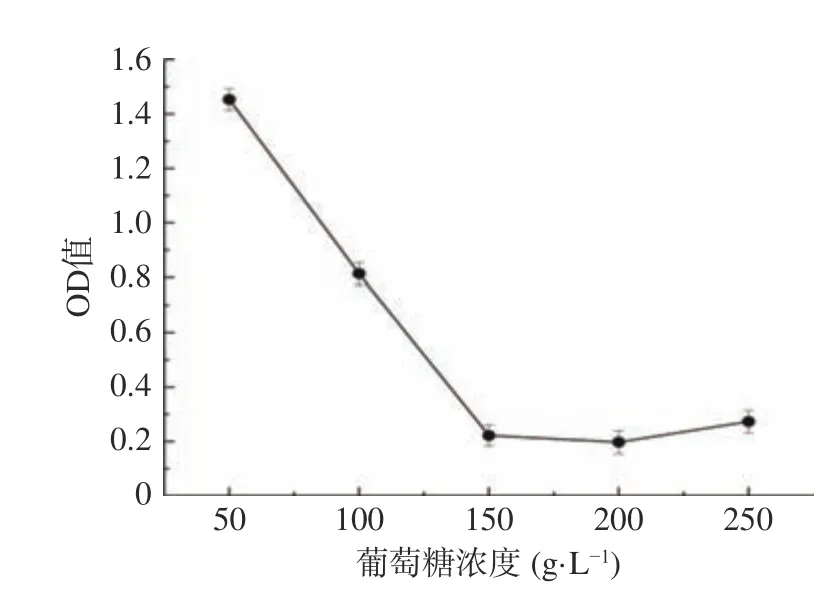
图7 菌株B5葡萄糖耐受性能Fig.7 Glucose tolerance of strain B5
2.4.2 SO2耐受性的测定 菌株B5的SO2耐受性能结果如图8所示。如图8所示,随着SO2浓度的增加,OD值呈逐渐下降趋势,菌株在培养基中长势越来越弱,菌株B5在400 mg/L二氧化硫浓度下的吸光度值为0.14±0.06,虽然长势微弱但依然能够存活,菌落数为3.30×104CFU/mL;但在500 mg/L SO2浓度下的吸光度值为0.01±0.05,降酸酵母菌株几乎不能存活。
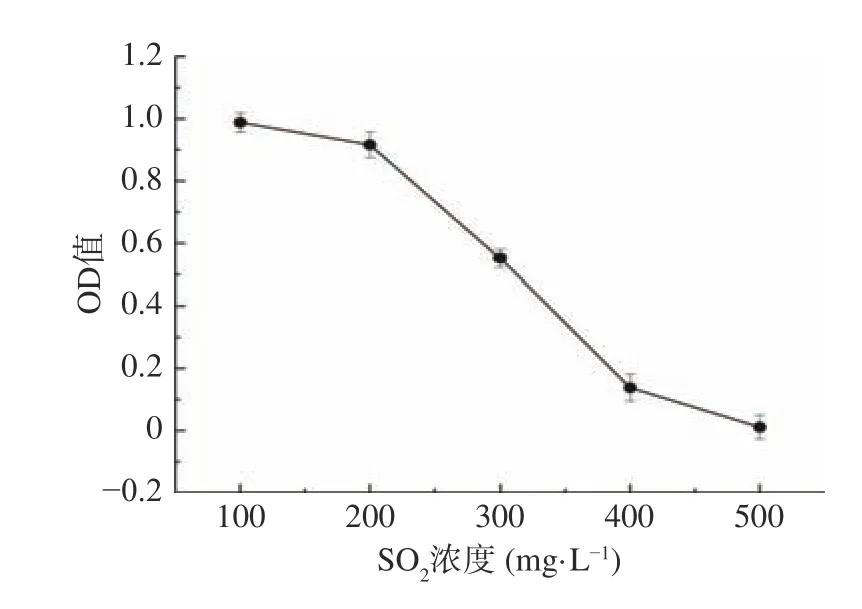
图8 菌株B5 SO2 耐受性能Fig.8 SO2 tolerance of strain B5
2.4.3 酒精耐受性的测定 菌株B5的酒精耐受性能结果如图9所示。如图9所示,随着酒精浓度的增加,OD值呈逐渐下降趋势,菌株在培养基中长势越来越弱,菌株B5在18%vol酒精度下的吸光度值为1.21±0.03,降酸酵母菌株依然能够存活,菌落数为1.53×105CFU/mL。
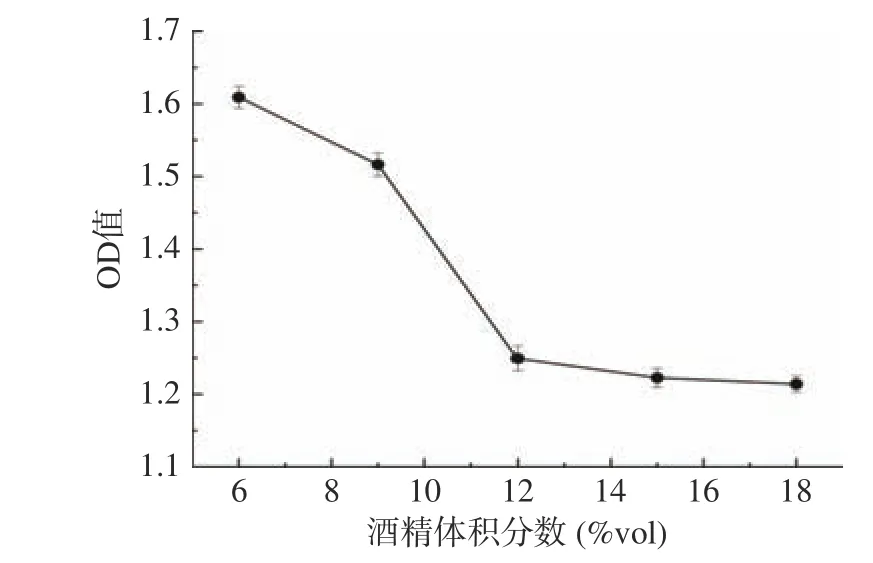
图9 菌株B5酒精耐受性能Fig.9 Ethanol tolerance of strain B5
3 讨论
从蓝靛果中筛选出的降酸酵母菌株B5在苹果酸液体培养基中的降酸率为42.60%±0.85%(13.33±0.13 g/L降为7.65±0.09 g/L),由高效液相色谱显示蓝靛果中苹果酸含量最高,为蓝靛果中的主要有机酸,可通过降解苹果酸进而降低蓝靛果产品总酸。试验中发现,在菌株B5作用下,蓝靛果中苹果酸降酸率为36.24%,与苹果酸液体培养基中的降酸效果相比有所降低,柠檬酸和酒石酸也显示相同趋势。陈思睿等[31]从红树莓土壤中筛选获得降酸酵母菌株T2可将柠檬酸含量从20 g/L降为7.25 g/L,降酸率可达63.75%;将菌株T2作用于总酸含量为25.16 g/L的红树莓果汁中可使果汁总酸含量下降到11.24 g/L,脱酸率为55.32%。由此可见,降酸菌株在实际应用中略低于在培养基中的降酸效果,原因可能是降酸酵母菌株应用的产品中除了含有有机酸外,还含有糖类、蛋白质、单宁、果胶等其他成分,对菌株活性产生影响[32],此外有机酸的初始含酸量也可能影响菌株的降酸效果。
目前,对有机酸具有降解能力的酵母菌株有多个属种,常见的有陆生伊萨酵母、毕赤酵母以及酿酒酵母等,其中绝大部分只具有降解单一有机酸的能力。刘延岭等[33]从猕猴桃果园的土壤中筛选出具有苹果酸降解能力的酿酒酵母菌株ZJ22、PJ34,毕赤酵母ZG13,对苹果酸的降解比例分别为28.36%、25.92%和25.68%。本试验经筛选获得的酸酵母菌株B5为接合酵母属中的二孢接合酵母,首次从长白山野生浆果中筛选出对苹果酸、柠檬酸、酒石酸均具有一定降解能力的酵母菌株,使得后续在野生浆果产品降酸领域应用范围更加广泛。
对降酸菌株B5进行耐受性试验可以看出,降酸菌株对葡萄糖、SO2和酒精均具有一定的耐受性,但是随着葡萄糖、SO2和酒精浓度的增加,降酸酵母菌株B5的生长也逐渐受到抑制,这将不利于产品开发。为了使降酸酵母菌株能够更广泛地应用到野生浆果产品当中,可通过酵母菌工程技术对初筛获得的原始菌株进行改良,使其获得较原始菌株更强的耐受性能。Cecilia等[34]使用耐低温酵母菌株S.eubayanusNPCC 1292作为亲本菌株,与酿酒酵母菌株杂交获得的杂交种H20的葡萄糖耐受范围从120~250 g/L提高到240~300 g/L。虽然降酸酵母菌株B5对蓝靛果展现出优良的降酸能力,但这一特性对其他长白山野生浆果产品是否均具有普遍意义还有待进一步探究。
4 结论
对长白山野生蓝靛果果实中的酵母菌进行筛选,得到具有良好降解有机酸效果的酵母菌株B5,经形态学检验,生理生化试验及分子生物学鉴定可知菌株B5为二孢接合酵母(Zygosaccharomyces bisporus),其对苹果酸、柠檬酸、酒石酸的降酸率分别为42.60%±0.85%、18.28%±0.80%、13.09%±0.61%;其在250 g/L葡萄糖质量浓度、400 mg/L SO2质量浓度和18%vol酒精度下仍能存活,具有在蓝靛果果汁、果酒等产品开发中应用的潜力。

