MRI、CT影像学表现差异在肝脏孤立性坏死结节中的诊断价值
姚 尉,李成杰,刘 伟
三六三医院放射科,四川 成都610041
肝脏孤立性坏死结节(SNN)是一种十分少见的良性肝脏病变,发病年龄高峰在60~70岁,临床上一般无明显症状[1-2]。目前,该病的病因和发病机制尚不清楚,相关假设包括血管疾病、感染、创伤等[3]。随着成像技术的不断发展,该病虽可被检测出,但鉴别诊断较难。肝脏SNN没有特定的影像学和临床特征,影像学表现与某些肝内恶性肿瘤高度相似,因此鉴别诊断难度更大[4]。为了防止患者病情恶化,尽快做出明确的诊断十分必要。CT是常用的诊断手段,为了更好地帮助患者早日诊断明确疾病类型,针对疾病采取相应治疗手段从而及早处理;MRI属于临床应用率较高的一种无创检查方式,能够多序列、多角度成像,软组织分辨率高,在肝脏病变诊断中得到了广泛应用[5-6]。但肝脏SNN的MRI表现并不明确[7],在肝脏SNN边缘是否存在增强现象仍存在很多争议。炎性细胞浸润、中央坏死和周围的纤维包膜形成是该疾病的主要病理特征,并且纤维组织与延迟增强之间存在密切的相关性[8-9]。因此,本研究旨在探讨SNN的MRI、CT影像学表现及诊断价值。现报道如下。
1 资料与方法
1.1 一般资料
本研究采用回顾性研究方法,选取2014年1月~2020年6月在我院就诊的肝脏SNN患者40例。纳入标准:均经病理学确诊;在我院接受MRI或CT检查;临床资料保存完整。排除标准:伴有肝脏血管瘤、肝癌等其他肝脏疾病;影像图像质量欠佳。40例患者中,男性29例,女性11 例,年龄41~72 岁(51.10±4.45 岁)。接受MRI检查22例(MRI组),CT检查18例(CT组);单纯凝固性坏死型14例,伴液化性坏死型15例,多结节融合型11 例;BMI:19.10~24.40 kg/m2(22.10±7.80 kg/m2);ALT:14~40 U/L(24.50±4.78 U/L);AST:12~38 U/L(22.40±5.10 U/L);ALB:37~60 g/L(47.80±9.11 g/L);STB:1.80~16.50 mmol/L(8.40±2.11 mmol/L)。MRI组和CT 组患者一般资料比较,差异无统计学意义(P>0.05,表1)。

表1 MRI组和CT组一般资料比较Tab.1 Comparison of general data between MRI group and CT group(Mean±SD)
1.2 MRI检查
MRI 检查选择Philips-Ingenia 1.5T 仪器进行扫描。T1WI使用快速扰相梯度回波序列进行屏气扫描,扫描时间16~20 s。T2WI使用脂肪抑制,扫描时间为120~180 s。在高压下注入造影剂后,在约68 s时进行门脉相位扫描,在120~180 s时进行延迟相位扫描。某肝脏SNN患者MRI图像(图1)。

图1 某肝脏SNN患者MRI图像Fig.1 MRI image of a patient with liver SNN.
1.3 CT检查
患者禁食8 h 之后行CT扫描,所用仪器为GE Optima CT660 64排128层螺旋CT,检查前患者至少需喝水500 mL,仰卧在检查台上,使探头的从左膈顶的顶部到肾脏的下极平面进行扫描。层厚度为1.25 mm,重建层厚为5 mm,间距为0.875∶1,设置电压为120 kV,电流为230 mA。再向肘静脉注射100 mL 浓度为300 mgI/mL的非离子型造影剂以增强扫描,注射之后获得肝动脉相、门静脉相和平衡相图像,将所得图像传至ADW4.2工作站上,由2名经验丰富的影像科医师进行分析诊断。某肝脏SNN患者CT影像学表现(图2)。

图2 某肝脏SNN患者CT图Fig.2 CT image of a patient with liver SNN.
1.4 统计学分析
采用SPSS22.0软件对数据进行统计学分析,年龄、BMI等计量资料以均数±标准差表示,组间比较行t检验;性别等计数资料以n(%)表示,组间差异的比较行χ2检验或Fisher精确检验。以P<0.05为差异有统计学意义。
2 结果
2.1 MRI、CT诊断情况比较
采用精确Fisher检验法比较,MRI诊断肝脏SNN准确率高于CT 组,差异有统计学意义(95.45%vs61.11%,P<0.05)。
2.2 CT组平扫及增强扫描结果
CT组单纯凝固性坏死型、伴液化性坏死型和多结节融合型病灶CT平扫及增强扫描表现的差异无统计学意义(P>0.05);单纯凝固性坏死型、伴液化性坏死型和多结节融合型病灶CT平扫主要呈低密度影,分别占83.33%、42.86%和40.00%,3种病灶均无强化,其中分别有83.33%、57.14%和80.00%病灶包膜延迟强化(表2)。

表2 CT组平扫及增强扫描结果Tab.2 Results of plain scan and enhanced scan in CT group[n(%)]
2.3 MRI组平扫结果
MRI组伴液化性坏死型T2WI序列低信号比例明显高于单纯凝固性坏死型和多结节融合型(P<0.05);多结节融合型T2WI序列稍高信号比例明显高于伴液化性坏死型(P<0.05);单纯凝固性坏死型、伴液化性坏死型和多结节融合型病灶T1WI 序列低信号比例均为100.00%(表3)。
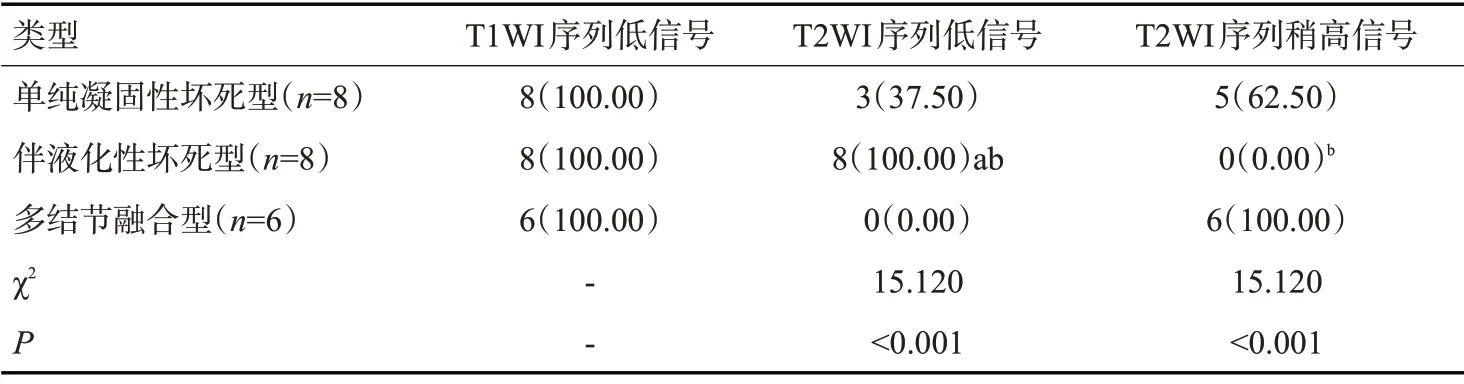
表3 MRI组平扫结果Tab.3 Plain scan results of MRI group
2.4 MRI平扫征象鉴别不同类型SNN的价值
T2WI序列低信号鉴别伴液化性坏死型SNN的敏感度为100.00%(8/8),特异性为78.57%(11/14),准确率为86.36%(19/22),阳性预测值为72.73%(8/11),阴性预测值为100.00%(11/11);T2WI序列序列稍高信号鉴别多结节融合型SNN的敏感度为100.00%(6/6),特异性为68.75%(11/16),准确率为77.27%(17/22),阳性预测值为54.55%(6/11),阴性预测值为100.00%(11/11)。
2.5 MRI组增强扫描结果
MRI组单纯凝固性坏死型、伴液化性坏死型和多结节融合型动脉期、门脉期和延迟期病灶无强化比例均为100.00%,但延迟期所有病灶边缘有强化(表4)。

表4 MRI组增强扫描结果Tab.4 Enhanced scan results of MRI group[n(%)]
3 讨论
肝脏SNN是一种肿瘤样疾病,相对较少见,在临床实践中尚不清楚该病的具体病因。由于肝脏SNN没有特征性的临床和影像学发现,因此鉴别诊断的难度更大[10]。通常,肝脏的SNN是单个结节,少数情况下也会出现多个结节相互融合的情况。有时在结节中还能发现液化性坏死,在结节边缘出现了纤维包膜,纤维包膜周围有时可见微小的钙化病灶[11-12]。
通过分析肝脏SNN的病理特征,可以推断出病变中心坏死,因此不会增强,并且病变边缘由于纤维组织的增殖而延迟增强[13]。肝脏SNN边缘的不断增强是由于丰富的纤维组织和炎性细胞浸润的存在,这将增加血管外空间并减慢造影剂进入和离开该空间的速度[14]。比较3种类型的病灶,它们也显示出延迟的增强,但是与肝脏SNN的血液供应不足相比,由于反应性血窦扩张和丰富的引流静脉,3种类似病灶的增强程度较小,并延迟强化。此外,在早期增强阶段,通常很难观察到肝脏SNN包膜的增强;但是3种类型的相似病灶边缘增强通常出现在早期,它们也可以用作重要的诊断辅助信息[15]。本研究结果显示:CT组中,3种类型的病灶CT平扫及增强扫描表现无显著差异,CT平扫主要呈低密度影,均物强化征象。MRI组中,伴液化性坏死型T2WI序列低信号显著较另外两种类型病灶增高,多结节融合型T2WI序列稍高信号比例明显高于伴液化性坏死型,3种类型病灶T1WI序列全部呈低信号,在动脉期、门脉期和延迟期病灶均无强化,但在延迟期有边缘强化的现象。
伴液化性坏死型:有研究报道,这种类型在较大的SNN 病变中并不少见,病变在T1WI 上信号低[16]。T2WI病变可见小的斑块,增强后无病灶强化,纤维包膜在门脉期和延迟期显示轻度至中度增强。在病理学上,它主要是凝结性坏死,中心可见裂隙状液化坏死,外围有一层薄薄的纤维包膜。文献表明,CT病变小片状液化性坏死的检出率低于MRI[17-18]。当病灶相对较大(>2.5 cm)时,可以在MRI的T1WI上看到病灶内点状或小片状更低信号。在T2WI上很特殊,病灶状如“红枣”的切面观,中央或偏心的“核”代表液化性坏死呈高信号,周围的“肉”代表凝结坏死的低-等信号。因此,只要仔细识别,就能发现反映T2WI液化坏死的点片状较高或明显的高信号,显示速度明显高于T1WI和CT。因此,MRI对液化坏死的诊断价值高于CT。
在CT平扫时,单纯凝固性坏死型病变显示不均匀的低信号,在MRI T1WI、T2WI呈现低信号,T2WI序列中可在内部出现分隔状等或略高信号。CT和MRI增强扫描中,实质病灶信号并没有增强,但在内腔和边缘包膜却显示出了一定程度的增强,且在门脉期或平衡期最佳。病理上,病变多表现为凝血坏死,结节之间可见纤维分离和纤维边缘处出现包膜等情况。本研究结果显示:MRI中,T2WI序列稍高信号、T2WI序列低信号鉴别伴液化性坏死型SNN的灵敏性、特异性、准确率均较好,阴性预测值均为100.00%。增强扫描动脉期似有周缘环形强化的特点,延迟期病灶逐渐强化而呈较明显的环状强化,上述表现有助于与SNN进行鉴别。
在CT平扫上,多结节融合病灶呈现出高密度的结节,CT和MRI相比,MRI T1WI上的双回波可以辅助诊断,且能显示出病灶内部的纤维化情况[19]。MRI 的T2WI对病灶的脱水情况及是否合并有病灶液化具有很好的鉴别价值。动态增强能反映病灶内部及边缘显为包膜的发生情况。研究认为,多结节融合SNN是肝炎性假瘤的特征之一,多结节融合SNN因为结界不明确,易被误诊为感染性病变,尤其是在T2WI上,再加上感染相关疾病的病史,诊断较容易[20-21]。
高质量的MRI对SNN病变有很好的诊断价值,在平扫中,增强与未增强的肝实质病灶差别显著,这是诊断的最佳状态。T2WI能明确显示内部病灶间隙的液化样坏死,有效区分病灶类型,相较于CT,MRI能更好地对病灶内部隔膜和边缘包膜进行呈现及鉴别,因此诊断肝脏SNN的效能更好。SNN病灶相对特征性的影像表现为实质无强化、周缘薄环状强化。本研究在常规研究的基础上,进行MRI扫描时着重分析了不同类型SNN病灶的T1WI、T2WI的信号特征,联合三期增强扫描以期有效对SNN进行鉴别。
综上所述,MRI和CT在肝脏SNN诊断中有一定应用价值,其中MRI诊断价值较好。