极化液对内毒素休克兔脑氧化损伤的影响
李洪琼,王艺铮,万勇,2
(川北医学院,1.附属医院麻醉科;2.麻醉系,四川 南充 637000)
内毒素休克是严重循环、细胞和代谢失调的脓毒症,死亡率高达35%~40%,而脑是早期受累的器官之一。目前,内毒素休克尚缺乏有效的治疗手段,且因脑损伤,幸存者大多存在认知和行为功能异常,减轻脑损伤可改善预后,降低死亡率[1]。研究[2-3]证实,内毒素休克时内毒素、缺血缺氧等因素导致脑组织中过氧化氢(H2O2)、一氧化氮(NO)、氧自由基(O-)等氧化物大量产生,而脑氧耗高,抗氧化能力弱,早期即可出现脑氧化损伤,进一步破坏血脑屏障,加重炎症反应、细胞凋亡及免疫失衡等,氧化与抗氧化失衡是脑损伤的主要机制,早期干预可改善预后。研究[4-6]证实,葡萄糖-胰岛素-钾(极化液,GIK)对缺血心肌有保护作用,可减轻内毒素血症大鼠肝脏、肠道、脾脏损伤,改善内毒素休克患者血流动力学,减轻内毒素血症大鼠脑损伤,其机制包括清除氧化物、增加抗氧化剂的产生,减轻氧化损伤、减少细胞凋亡、减轻炎症反应等,可用于治疗脑缺血再灌注、内毒素血症、危重症等。本研究通过静脉注射脂多糖建立内毒素休克兔模型,观察GIK对内毒素休克兔脑损伤的影响,初步探索其可能的机制。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 普通级健康雄性新西兰大白兔由川北医学院动物实验中心提供[许可证编码:SYXK(川)2013-076],体重2~3 kg,兔龄12~15周;实验前适应性饲养1周。本实验经川北医学院伦理委员会审查批准,且实验人员具备动物实验从业资格证书。
1.1.2 主要仪器与试剂 监护仪MEC-2000(深圳迈瑞生物医疗电子股份有限公司),三诺安稳血糖仪,分光光度计(美国分子仪器公司),脂多糖LPS(Escherichia:coli055:B5,Sigma公司,美国),氧化指标包括H2O2测定试剂盒(比色法A064-1-1)、NO测定试剂盒比色法(A012-1-2)、一氧化氮合成酶(NOS)分型测试盒(比色法,A014-1-2)、丙二醛(MDA)测定试剂盒(TBA法,A003-1-2)和抗氧化指标包括总超氧化物歧化酶(SOD)测定试剂盒(WST-1法,A001-3-2)、总抗氧化能力(T-AOC)检测试剂盒微板法(A015-2-1)(南京建成生物工程研究所),兔NSE ELISA试剂盒(上海沪尚生物科技有限公司),透射电镜H-600IV(Quantum Design中国子公司),数码三目摄像显微镜BA400Digital(麦克奥迪实业集团有限公司)。
1.2 方法
1.2.1 内毒素休克模型建立与动物分组 称量并记录体重后经左耳缘静脉注射1%戊巴比妥钠(3 mL/kg)麻醉,随后行耳缘静脉、颈动脉穿刺置管,采用压力传感器连接监护仪监测血压,两组均1 min内经耳缘静脉注射LPS 0.5 mg/kg,共计2.5 mL/kg,待平均动脉压(MAP)下降至基础血压70%以下且稳定5 min以上判定为内毒素休克模型建立成功[7]。将建模成功大白兔随机分为内毒素休克组(ES)和极化液组(GIK),每组各10只。
1.2.2 给药及动物处理 ES组和GIK组分别静脉持续泵注复方氯化钠注射液和极化液GIK(葡萄糖G:200 G/L;胰岛素I:60 U/L;氯化钾K:60 mmol/L),5 mL·kg-1·h-1,时间6 h。静脉注射空气法处死白兔并立即采集脑组织标本。实验中排除动脉置管过程中失血过多(超过10 mL)及给予LPS后2 h内MAP没有下降至基础MAP 70%以下(3只)或者快速下降基础MAP 30%以下甚至实验过程中死亡的白兔(2只),共5只,并进行相应补充,保证每组10只存活至实验结束。实验过程中每隔2 h经静脉注射1%戊巴比妥3 mL维持麻醉深度。
1.2.3 平均动脉压和血糖监测 采用迈瑞监护仪和血糖仪监测记录动静脉操作完成后30 min(0T)、LPS注射后造模完成(T0)、复苏后第1小时(T1)、第2小时(T2)、第3小时(T3)、第4小时(T4)、第5小时(T5)、第6小时(T6)的MAP、血糖(G)。
1.2.4 血清NSE浓度检测 分别于0T、T0、T3、T6采集动脉血2 mL,加2 mL肝素生理盐水,室温静置30 min后,3 500 rpm离心5 min,取上清液分装,-80 ℃保存。采用双抗体一步夹心法酶联免疫吸附实验(ELISA)检测NSE浓度,操作按试剂盒说明书进行。
1.2.5 氧化和抗氧化指标水平检测 实验结束后立即取左脑皮质-80℃保存,室温解冻后取适量皮层脑组织除去血管及脑膜,放置在冰0.9%氯化钠注射液中漂洗,洗去血液等杂质后用滤纸吸干水分并准确测量0.5 g脑组织,置入预冷的0.45 mL冰0.9%氯化钠注射液中作为匀浆介质(体积比为1∶9),用无菌玻璃匀浆管冰水浴条件下手动匀浆数分钟,待充分研磨后放置离心管中,用低温高速离心机于4℃,3 000 rpm离心10 min,取上清液即为10%脑组织匀浆,将制备好的10%组织匀浆用生理盐水按1∶4稀释成2%组织匀浆,严格按照考马斯亮蓝蛋白测定试剂盒说明书测定并计算脑组织匀浆中蛋白含量(mgprot/mL),随后严格按照试剂盒方法测定匀浆中H2O2、NO、iNOS、MDA、SOD、T-AOC含量。
1.2.6 病理形态观察 取1 cm×1 cm×0.2 cm大小右脑皮层组织两块放置在4%多聚甲醛溶液中固定,经脱水机脱水,透明剂透明,浸蜡后石蜡包埋,蜡块常规切片(3~5 μm)后HE染色,具体如下:苏木精染色10~20 min→自来水冲洗1~3 min→盐酸酒精分化5~10 s→自来水冲洗1~3 min→放入50 ℃的温水中或弱碱性水溶液返蓝,直到出现蓝色为止→再次自来水冲洗1~3 min→85%的酒精3~5 min→伊红染色3~5 min→水洗5 s→依次梯度酒精(80%、95%、100%、100%)脱水各1.5 min→二甲苯透明→二甲苯1-二甲苯2,20~30 min→中性树胶封片。染色完成后在光学显微镜下进行图像采集:采用数码三目摄像显微摄像系统对皮层脑组织染色切片进行图像采集,每张切片先于40×镜下观察皮层脑组织大体形态,再随机采集100×和400×图片,重点观察记录400×镜下皮层脑组织形态学改变,包括神经元数目及排列情况、神经元完整性、皮层透光度等。另取右脑顶叶皮质层,1 cm3大小,放置3%戊二醛中4℃冰箱保存,每组随机选取3块保存在3%戊二醛中的皮层脑组织,1%四氧化锇再固定,丙酮逐级脱水,脱水剂浓度梯度为30%、50%、70%、80%、90%、95%、100%(100%浓度脱水3次),脱水后的脑皮质先后经过脱水剂和环氧树脂渗透液渗透,两试剂比例分别为3∶91;1∶91;1∶93,每步30~60 min。将渗透好的组织块放到灌有包埋液的模具中包埋,经加温聚合形成包埋块。超博切片机切出50 nm左右的切片,依次醋酸铀→柠檬酸铅染色(染色时间:室温下染色15~20 min)。10 000×和20 000×电镜下随机选取视野观察并记录皮层脑组织线粒体分布与结构改变情况。
1.3 统计学分析
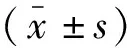
2 结果
2.1 两组大白兔MAP、G水平比较
注射LPS后,两组大白兔MAP均降低(P<0.05),但均高于T0(P<0.05)。复苏治疗后,两组大白兔MAP逐渐回升,且GIK组MAP回升更明显,在T1~T6各时间点均高于ES组(P<0.05);两组大白兔血糖均先升高后降低,且ES组T1时高于GIK组(P<0.05),T4、T5、T6时低于GIK组(P<0.05)。见表1。
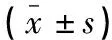
表1 两组大白兔MAP、G水平比较
2.2 两组大白兔血清NSE浓度比较
与基础值0T相比,注射LPS后ES组和GIK组血清中NSE水平均随时间持续升高,且均高于0T(P<0.05);T3、T6时,GIK组低于ES组(P<0.05)。见表2。
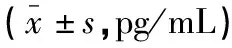
表2 两组大白兔血清NSE浓度比较
2.3 两组大白兔氧化及抗氧化指标比较
ES组氧化物NO、H2O2、MDA含量及iNOS活力高于GIK组(P<0.05),抗氧化指标SOD活力和T-AOC值低于GIK组(P<0.05)。见表3。
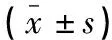
表3 两组大白兔氧化及抗氧化指标比较
2.4 两组大白兔病理结果比较
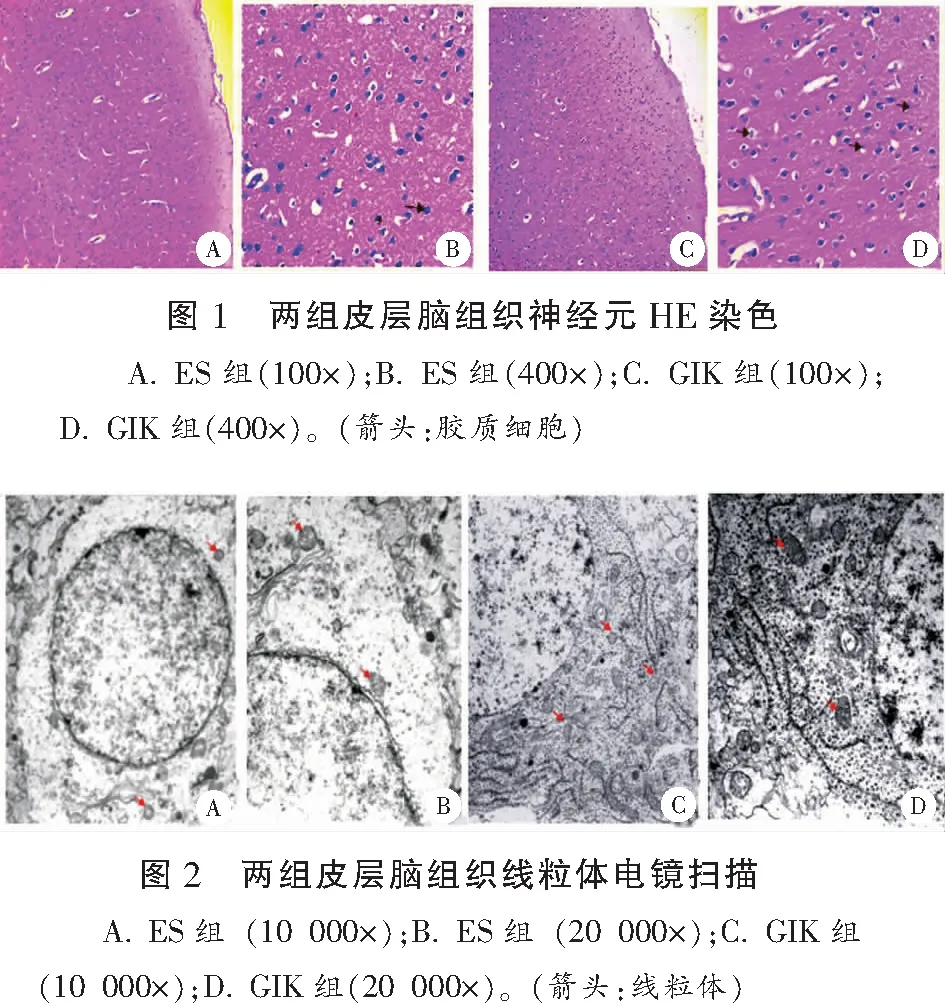
光镜下观察显示,ES组皮层脑组织细胞层排列紊乱,皮质透光度增强,血管间隙增大,神经元细胞明显肿胀,偶见神经细胞坏死、胶质细胞吞噬坏死神经元细胞的卫星现象。GIK组皮层脑组织细胞层排列紊乱,皮质透光度增强,血管扩张,血管间隙增宽,细胞形态未见明异常,偶有神经细胞轻度水肿、坏死。以上结果表明两组均存在明显脑损伤,GIK组干预后脑损伤减轻。电镜可见ES组部分线粒体明显肿胀,基质颗粒丢失严重,线粒体脊消失,电子密度不均匀。GIK组线粒体分布正常,线粒体脊可见,电子密度基本均匀,部分线粒体轻度肿胀、基质粒丢失。以上结果显示内毒素休克兔脑组织线粒体损伤明显,GIK组损伤轻于ES组。见图1及图2。
3 讨论
内毒素休克主要表现为严重低血压、微循环障碍和多器官功能障碍,早期即可发生脑损伤,使死亡率增高,目前仍缺乏有效的治疗手段,纠正低血压、减轻氧化与抗氧化失衡可明显减轻脑损伤。GIK由葡萄糖、胰岛素和钾组成,其中胰岛素具有抗炎、抗氧化、抗凋亡等作用,葡萄糖抵抗低血糖,胰岛素和葡萄糖共同协助钾从细胞外液向细胞内液的转运,三种成分共同发挥生物活性且无低血糖、低钾副作用,可改善脓毒症患者心肌损伤及血流动力学,减轻内毒素血症大鼠肠道、肝脏、脾脏损伤。本研究发现,GIK干预治疗6 h内MAP水平高于ES组,且从治疗第2小时开始,GIK组MAP值稳定在70 mmHg以上,表明GIK干预可明显改善内毒素休克兔血流动力学。本小组前期研究也观察到大鼠腹腔注射LPS后2 h血糖升高,随后血糖降低甚至发生低血糖。循证医学证据显示,血糖过高或过低均可导致内毒素休克患者死亡率增加,维持血糖稳定接近正常水平或许使得患者利益最大化[8]。而合适配比的GIK可避免胰岛素治疗后低血糖副作用的同时不影响胰岛素生物学效应。本实验中GIK组血糖水平更稳定且接近正常水平(3.9~6.1 mmol/L),证实配比的GIK成分合理。
大量研究[1-3]证实,内毒素休克早期脑组织(尤其是皮层区和海马区)H2O2、O2-、NO、NOS合酶及ONOO-等被激活,氧化物大量堆积,SOD、过氧化氢酶、谷胱甘肽酶等抗氧化酶无法及时清除,氧化与抗氧化失衡发生脑损伤。MDA是氧化损伤后脂质过氧化损伤的重要标记物,与氧化损伤程度正相关;NSE作为脑损伤的特异性标志物,与脑损伤程度呈正比,T-AOC可客观评价整体抗氧化水平。本实验观察到静脉注射LPS后脑组织中氧化物NO、NOS、H2O2而SOD活性、T-AOC值降低,NSE、MDA水平增高,组织学上脑神经元破坏明显,证实内毒素休克兔早期发生脑损伤,且存在氧化与抗氧化失衡。基于胰岛素有抗氧化作用,解剖上脑实质及血脑屏障上广泛分布GLUT和胰岛素受体,葡萄糖作为脑的主要能源,可通过血脑屏障上GLUT转运入脑实质,改善脑能量代谢,减轻脑损伤,葡萄糖和钾盐可协同增强胰岛素的效能[9]。因此,采用GIK治疗内毒素休克兔,发现治疗6 h后脑神经元破坏减少,血清NSE和脑氧化物水平显著降低,SOD和T-AOC明显升高,表明GIK明显减轻脑损伤,降低氧化物水平,增强抗氧化能力,与Muller等[10]的实验结果相符。另外,考虑到线粒体作为氧化物产生重要场所也是脑氧化损伤关键靶点[11],线粒体损伤可进一步佐证氧化损伤程度,设计电镜下观察脑线粒体超微结构变化,证实ES组线粒体结构破坏明显,而GIK组明显减轻,进一步证实GIK可减轻内毒素休克兔脑损伤。但由于实验条件限制,本实验未能在GIK减轻线粒体氧化损伤的具体机制方面作进一步研究。
综上,GIK(G:200 g/L,I:60 IU/L,KCL:60 mmol/L)可减轻LPS诱导内毒素休克兔脑损伤,其可能机制为:(1)GIK可改善内毒素休克兔血流动力学;(2)GIK降低脑氧化物水平,减轻内毒素休克兔脑氧化损伤。

