HMOX1在晶状体上皮细胞中的抗氧化功能
廖生洁,陈江龙,张靖淇,王梦蝶,黄炳辉,汪凌云
(湖北理工学院 肾脏疾病发生与干预湖北省重点实验室,湖北 黄石 435003)
0 引言
氧化压力一直被认为是年龄相关性白内障的重要诱因。光诱导、氧气和辐射等均能引起氧化压力的升高,导致晶状体中蛋白质和脂质的过度氧化,最终使晶状体变得浑浊。这一结论已在动物模型以及体外培养的晶状体体系中得到验证[1-2]。临床病例研究结果显示,老年人晶状体中的晶状体蛋白质和脂质的过度氧化十分明显,提示年龄相关性白内障与活性氧(ROS)的形成紧密关联[2-4]。寻找晶状体中ROS调控因子,不仅能拓展白内障发生的病理机制,同时还可为年龄相关性白内障患者的预防工作提供指导。
血红素加氧酶(HMOX)可以将血红素降解为胆绿素、一氧化碳和铁,是血红素降解的限速酶,在各组织中泛表达,特别是高活性组织,如脾脏、大脑和睾丸等。Benari等[5-6]在眼组织角膜上皮、视网膜、视网膜色素上皮和睫状体中检测到明显的血红素加氧酶活性。作者的前期研究结果发现,在晶状体上皮细胞中,HMOX1表达水平随氧化应激强度逐渐升高,提示其可能在晶状体细胞中发挥抗氧化重要作用,本研究将进一步确定HOMX1在晶状体上皮细胞中的抗氧化功能。
1 试剂与方法
1.1 细胞培养
HLECs和p293T细胞均使用DMEM(Gibco)基础培养基,并加入10 %胎牛血清(四季青)。培养箱温度设置为37 ℃,二氧化碳浓度设置为5 %。
1.2 HMOX1过表达细胞系的构建
将构建好的HMOX1-pBABE质粒与辅助质粒VSVG和GAGPOL转染p293T细胞,包装慢病毒载体,收取48 h的细胞培养基上清液,将上清液与加入胎牛血清的高糖培养基1∶1混合,加入1 μg/mL的polybrane侵染HLECs细胞,24 h后,更换加入胎牛血清的高糖培养基2 mL,同时加入1 μg/mL嘌呤霉素筛选,收取细胞样品进行Western blot检测。
1.3 CRISPR-CAS法构建HMOX1敲除细胞系
使用CCTop - CRISPR/Cas9 target online predictor对HMOX1基因进行gRNA设计,共设计4对不同靶点的引物,将正反向引物退火后,插入使用BBS1酶切成功的PX459质粒。
将构建成功的CRISPR-CAS9质粒使用lipo2000脂质体转染HLECs细胞,1 μg/mL嘌呤霉素筛选2 d后,胰酶消化细胞,96孔板分选单克隆。待细胞扩大培养后,提取细胞基因组,利用PCR技术扩增目的片段。将成功扩增的片段于凝胶电泳检测后送公司进行一代测序。
1.4 Western blot检测蛋白质表达
收取细胞,PBS清洗2次后使用细胞裂解液进行裂解,将裂解液置于沸水浴中煮样10 min, SDS-PAGE电泳分离蛋白样品。将蛋白样品转膜至NC膜,5 %脱脂奶粉进行封闭1 h,加入一抗。使用PBST洗涤3次,每次5 min,常温孵育二抗1 h,清洗残余二抗后低价HRP标记的底物,于化学发光仪上检测目的蛋白灰度值。
1.5 胞内ROS检测
选用碧云天活性氧检测试剂盒(货号S0033),按照说明书进行操作,1∶1 000用无血清培养液稀释DCFH-DA,使终浓度为10 μmol/mL。去除细胞培养液,加入适当体积DCFH-DA,装载探针进行流式细胞仪检测。
2 结果
2.1 氧化还原环境对HLECs的细胞活性影响
为了研究氧化压力是否影响晶状体上皮细胞生长活性,使用CCK8试剂盒检测不同浓度双氧水(H2O2)处理后的HLECs细胞活性(如图1所示)。
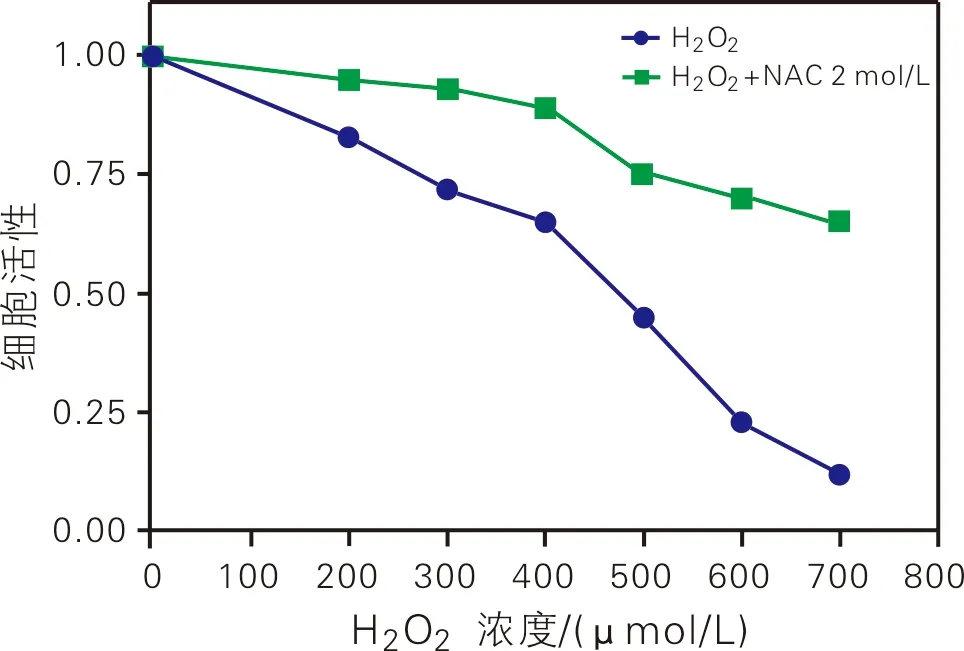
图1 不同条件处理下的HLECs细胞活性
从图1可以看出,随着H2O2浓度升高,晶状体上皮细胞生长活性显著下调。500 μmol/L的H2O2浓度下,其活性已低于50 %。700 μmol/L浓度下,光学显微镜观察细胞形态变圆,并出现凋亡样小体,细胞活性低于20 %。NAC是常用的还原试剂,能够维持环境的氧化还原稳态。使用NAC和不同浓度H2O2处理HLECs,发现NAC能够显著提高细胞的生长活性。这说明,氧化还原环境能显著调控HLECs的细胞生长活性。
2.2 使用慢病毒载体构建HMOX1过表达细胞系
HMOX1是胞内重要的抗氧化基因。前期研究结果表明,双氧水刺激条件下,HMOX1表达水平显著上调。为了研究HMOX1在晶状体上皮细胞中的生物学功能,将HMOX1构建至pBABE载体,并使用慢病毒包装的方法,将该载体转染至293T细胞中,收集上清培养基后加入polybrane辅助病毒侵染HLECs细胞,并加入嘌呤霉素进行细胞抗性筛选,成功获得HMOX1过表达HLECs细胞系。
使用蛋白质免疫印迹实验对细胞中的Flag-HMOX1进行表达鉴定,其中,使用Flag抗体检测Flag-HMOX1融合蛋白,使用Actb抗体检测内参表达。Flag-HMOX1稳定表达细胞系的鉴定如图2所示。

图2 Flag-HMOX1稳定表达细胞系的鉴定
2.3 使用CRISPR-CAS9构建HMOX1敲除细胞系
为了观察HLECs缺失HMOX1表达后的生物学效应,拟通过CRISPR-CAS9方法在HLECs中构建HMOX1敲除细胞系。针对HMOX1基因的CDS设计4对sgRNA序列,并成功将该gRNA的双链产物插入PX459质粒中,使用BBS1酶切进行验证。BBS1酶切不开质粒,即代表原有酶切位点被设计的碱基插入成功(如图3(a)所示)。其中,奇数泳道为对照组,未加入BBS1内切酶,偶数泳道为实验组。将质粒转染至HLECs后,抽提细胞基因组,并对设计的片段设计引物利用PCR方法进行碱基扩增,并将扩增产物送至公司进行一代测序。测序结果显示,3号gRNA对基因组的切割效率最高,其编辑基因组的能力接近50%。单独将3号gRNA质粒转染HLECs,并筛选单克隆后,使用蛋白质免疫印迹法检测HMOX1在敲除细胞中的表达情况,成功鉴定到HMOX1敲除的细胞系(如图3(b)所示)。HMOX1的sgRNA引物序列见表1。

(a) HMOX1的CDS序列设计并构建至PX459质粒

表1 HMOX1的sgRNA引物序列
2.4 HMOX1过表达或敲除对细胞活性影响
为了观察HMOX1缺失或过表达后对HLECs抵抗氧化压力能力的影响,使用CCK8对不同细胞系细胞活性进行检测。CCK8检测不同细胞系的细胞活性结果如图4所示。从图4可以看出,HMOX1过表达细胞系的抗氧化能力显著提升,在敲除细胞系中,HLECs的抵抗氧化压力的能力则明显削弱。实验结果说明,HMOX1确实在HLECs中发挥着重要的抗氧化功能。

(a) HMOX1过表达及其对照细胞系的细胞活性结果
2.5 HMOX1对HLECs的ROS调控作用
HMOX1作为经典的抗氧化因子,ROS的生成是判断其抗氧化能力的常用指标。使用活性氧检测试剂盒中的荧光探针DCFH-DA对ROS进行检测,比较不同细胞系在H2O2处理后的胞内活性氧的水平,从而给出HMOX1在HLECs中抗氧化的直接证据。流式细胞术检测不同细胞系的ROS水平结果如图5所示。从图5可以看出,HMOX1过表达细胞系胞内ROS水平显著低于对照细胞系,而敲除HMOX1细胞组的ROS水平则明显升高。这一结果直接证明HMOX1在HLECs中具备抗氧化功能。

图5 流式细胞术检测不同细胞系的ROS水平结果
3 讨论
抗氧化功能对于晶状体维持透明的意义重大,HMOX1被报道能够在多种细胞中保护细胞免受氧化压力的侵袭。确定HMOX1在晶状体上皮细胞中的抗氧化功能,对于开发白内障预防药物,特别是年龄相关性白内障的预防工作有着较高的临床意义。Tian等[7]研究表明,在HLECs中干扰HMOX1的表达能够提高HLECs对氧化压力的敏感性。经典的分子生物学研究基因功能不仅包括敲低基因表达,还包含基因的过表达功能研究。siRNA方法敲低基因表达,可能面临剩余基因表达产物仍发挥生物学功能。研究通过CRISPR-CAS9方法获得了HMOX1敲除细胞系,保证了HLECs细胞中HMOX1表达完全敲除,准确地观察了HMOX1缺失后的生物学功能变化,证实了HMOX1为HLECs中的重要抗氧化因子。本文从多角度明确了HMOX1在HLECs中的抗氧化功效,为理解白内障的发生扩宽了思路,同时,也将为临床医生针对白内障的预防工作提供了一个新的药物靶点[8-9]。
——一道江苏高考题的奥秘解读和拓展

