金催化Diels-Alder反应研究进展
杨金明,姚梦莲,吴滨(中南民族大学 药学院,武汉 430074)
金处于元素周期表中第六周期IB族,由于单质金的反应惰性加之价格昂贵等原因,在相当长的时期内,金催化没有得到很大的关注. 2000年前后,金催化剂被发现能够非常高效地活化炔烃从而发生炔烃的氢-官能团化反应[1]. 相对于其他金属,金的价态变化较少,形成的配合物一般构型比较稳定. 离子态的金络合物是一种有效的催化剂,金催化不仅条件温和、底物范围广、催化效率高,而且有着极高的官能团兼容性和选择性. 金催化反应的核心在于亲核试剂进攻活化的不饱和碳碳键,主要包括炔烃、烯烃和联烯. 在成环有机合成反应中,五元环和六元环的合成反应是最常见的,即布朗克规则. 而合成六元环有多种方法,有[4+2]、[2+2+2]、[3+3]、[5+1]等环加成方法,其中最常见的是[4+2]环加成,Diels-Alder反应就是最具代表性的这类反应. 金催化的Diels-Alder反应能够合成多种类型的六元环化合物,包括氮杂环化合物、氧杂环化合物、取代苯胺类化合物以及多环化合物.
1928年,德国化学家O.D(狄尔斯)和K.A(阿尔德)在研究1,3-丁二烯和顺丁烯二酸酐的相互作用时,发现了一类共轭双烯与含有烯键或炔键的化合物相互作用生成六元环状化合物的反应,称为Diels-Alder反应,简称D-A反应,又称双烯合成(图1). 在D-A反应将近100年的发展过程中,化学家们开发出了多种催化体系,实现了在温和条件下高区域选择性、高立体选择性地合成六元环.
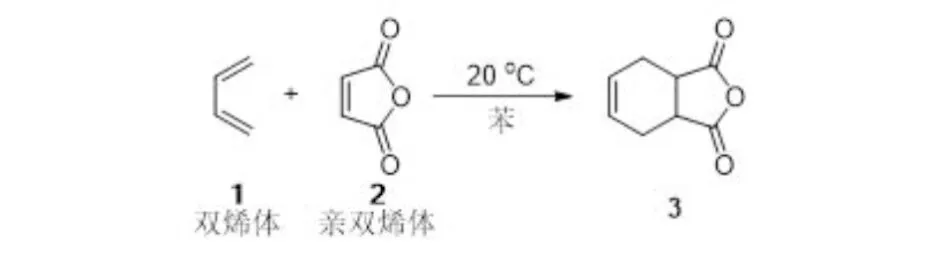
图1 Diels-Alder反应Fig.1 Diels-Alder reaction
1 金催化Diels-Alder反应合成六元碳环
联芳基骨架是许多天然产物、药物活性分子、手性配体、冠醚、液晶等的重要骨架. 2017年,刘永祥课题组[2]以炔丙基乙烯醚和缺电子炔烃为底物,发展了阳离子一价金催化的串联烯炔环异构化、Diels-Alder反应、逆Diels-Alder反应,合成了一系列联芳基化合物. 反应的机理首先是1,5-烯炔在金催化发生环异构化生成关键的氧杂双烯体,随后被亲双烯体捕获,发生Diels-Alder反应得到桥环中间体,最后经历逆Diels-Alder反应消除一分子甲醛得到目标产物. 通过DFT计算,推测由张力桥环释放甲醛而生成热力学稳定的芳香族环是反应的驱动力,导致了逆Diels-Alder反应的发生,最终生成双芳基产物(图2).
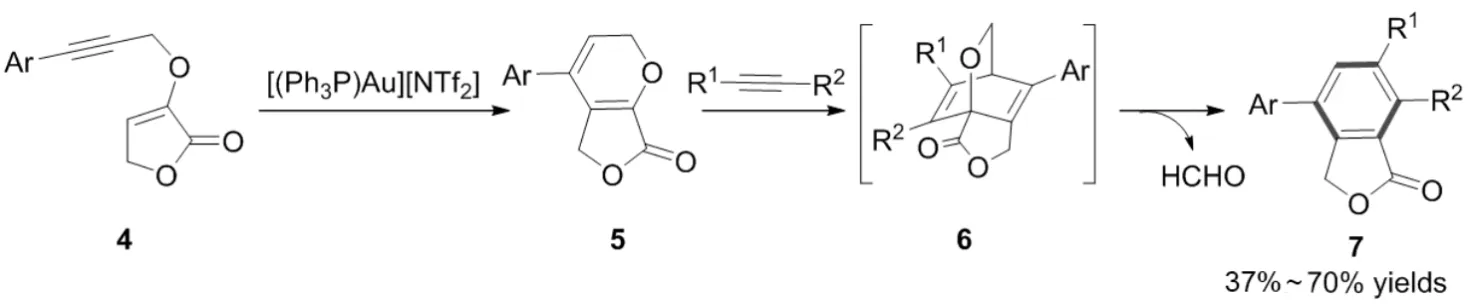
图2 金(Ⅰ)催化串联的环异构化/Diels-Alder/逆Diels-Alder反应Fig.2 Gold(Ⅰ)-catalyzed cycloisomerization/Diels-Alder/retro-Diels-Alder cascade reaction
2-胺基呋喃由于高活性和低稳定性,很难被制备,限制了其在有机合成中的应用. 2019年,张立明课题组[3]通过使用自己开发的远端叔胺官能化的大位阻联苯基膦为配体,以炔酰胺为底物,阳离子型一价金为催化剂,将其转化为2-氨基呋喃,并原位被亲双烯体捕获,随后经历开环、质子转移、芳构化,转化为更稳定的邻苯二甲酸亚胺衍生物(图3).

图3 金(Ⅰ)催化的炔酰胺环异构化反应Fig.3 Gold(Ⅰ)-catalyzed cycloisomerization reaction of alkynamides
多组分反应是在一个烧瓶中通过整合多个原料构建复杂目标产物的有力工具,由于其具有快速性、会聚性、多样性、易于实验操作等特点,多组分反应在有机合成领域引起了相当大的关注. 2020年,TOKUYAMA课题组[4]研究了金催化的缩醛和炔烃的三组分串联反应合成取代苯胺的反应. 机理研究表明,阳离子型一价金催化剂选择性地先后活化了两个不同的炔烃,分别参与了吡咯的合成和随后的D-A反应,具有一定环张力的桥环发生C-N键断裂、芳构化后得到目标产物. 控制实验结果表明金催化剂对第二步D-A反应有明显的促进作用,证实了金催化剂既参与了吡咯的生成,也参与了D-A反应(图4).
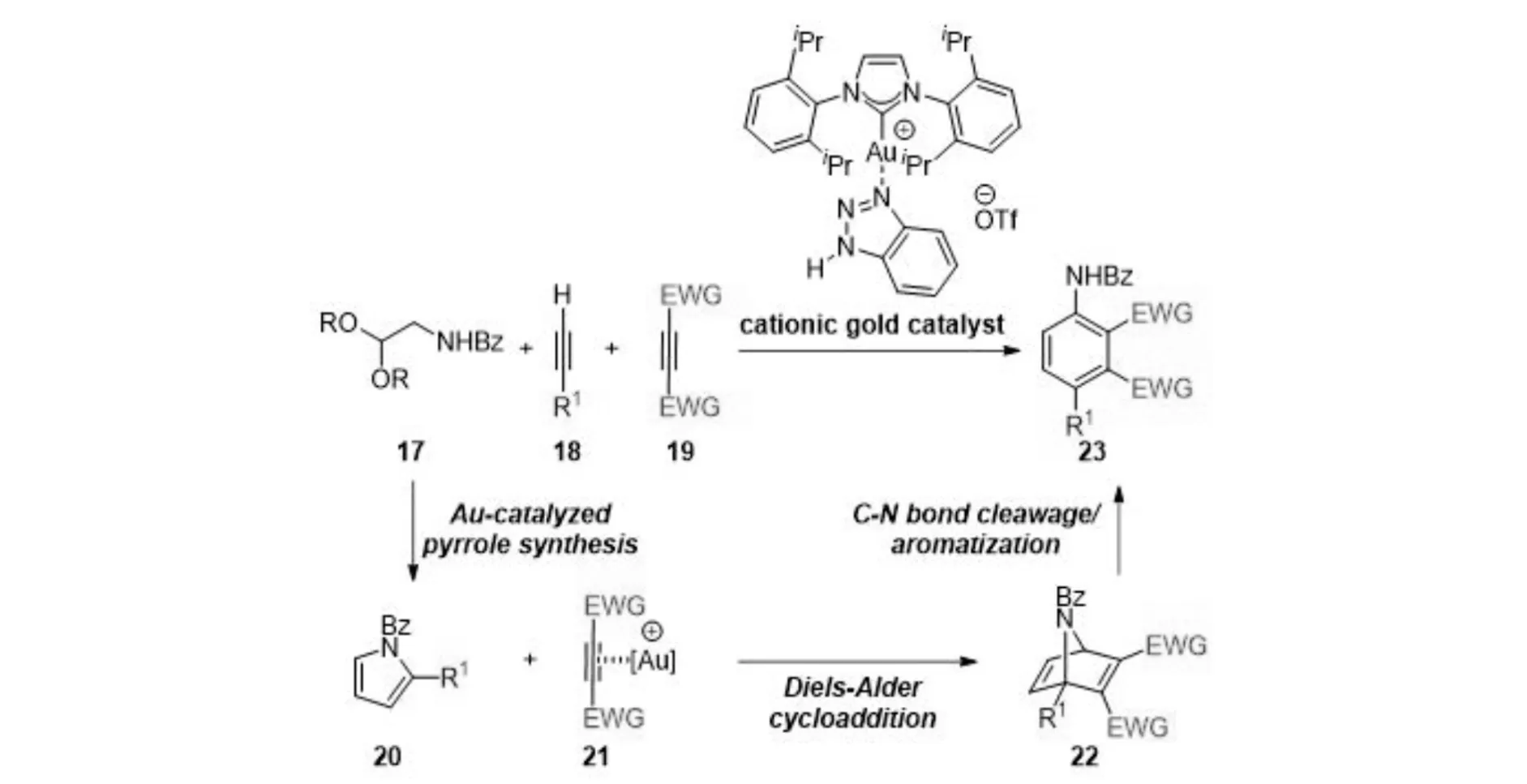
图4 金(Ⅰ)催化串联的合成取代苯胺反应Fig.4 Gold(Ⅰ)-catalyzed tandem reaction of substituted anilines
直接对未活化的C-H键官能团化是合成结构复杂分子最理想的方法之一,有研究表明π-Lewis酸的存在能够使未活化的炔烃作为氢受体参与到串联的[1,5]-氢迁移/环化反应中. 2014年,龚流柱课题组[5]报道了金催化C-H (sp3)发生[1,5]氢迁移,转移到非活化的C≡C上,使得N-丙炔异吲哚成为潜在的二烯化合物,与亲双烯体发生分子间D-A反应,直接合成多环化合物(图5).
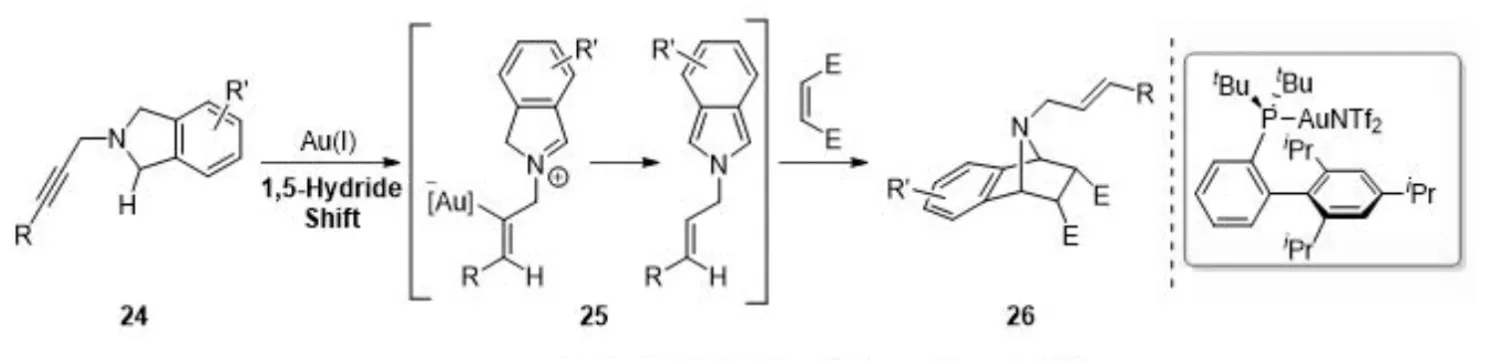
图5 金(Ⅰ)催化分子间Diels-Alder反应Fig.5 Gold(Ⅰ)-catalyzed intermolecular Diels-Alder reaction
可能的机理是,在一价金催化条件下,原料27通过[1,5]-氢迁移生成中间体28,随后在NTf2阴离子的作用下,与体系中的水(或D2O)经历可逆的质子化和去质子化过程得到一系列烯基金物种29~33,金质解后得到双烯中间体34,最后与苄基马来酰亚胺发生Diels-Alder反应,得到多个位置被氘代的最终产物35(图6).
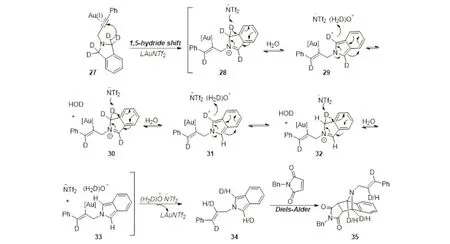
图6 可能的反应机理Fig.6 A plausible reaction mechanism
2 金催化脱氢Diels-Alder反应
2.1 脱四氢Diels-Alder反应在合成2,3-二氢苯并吲哚衍生物中的应用
Diels-Alder反应是原子效率高的合成方法,可以用于构建新的碳环或杂环,一般来说,传统的D-A反应是通过丁二烯和乙烯合成有10个氢的环己烯. 一个特殊的类别是TDDA反应,TDDA反应也叫脱四氢-Diels-Alder反应,其中四个氢被除去,生成6-H苯环类产物,这种转化是通过一个高度张力的环状联烯中间体进行(图7(a)). 2019年,PRABAGAR与合作者[6]通过金催化炔基连接的炔胺分子内TDDA反应来构造了结构复杂的2,3-二氢苯并[f]吲哚衍生物(图7(b)).

图7 金(Ⅰ)催化炔胺的脱四氢-Diels-Alder反应 Fig.7 Gold(Ⅰ)-catalyzed tetradehydro-Diels-Alder reaction of yne-ynamides
可能的机理是阳离子金活化炔酰胺43的C≡C,接受另一个炔基的亲核进攻,通过5-exo-dig环化生成烯基碳正离子中间体44,随后苯环进攻化合物44,再通过6-endo-dig环化生成中间体45,消除金催化剂得到联烯中间体46,最后发生[1,3]-H迁移得到产物47(图8).
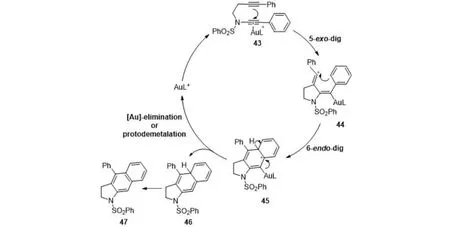
图8 可能的反应机理Fig.8 A plausible reaction mechanism
2.2 脱氢Diels-Alder反应在合成苯并咔唑中的应用
咔唑是一类重要的有机中间体,除用于染料、医药和农药合成的传统用途外,咔唑及其衍生物被广泛用于合成光电功能材料. 2018年,刘元红课题组[7]通过金催化炔胺-炔的分子内形式上的脱氢D-A反应,合成了一系列苯并[b]咔唑类产物. 反应可能经历了烯酮亚胺正离子中间体,然后再进行芳香环化反应(图9).

图9 金(Ⅰ)催化炔胺-炔的脱氢Diels-Alder反应Fig.9 Gold(Ⅰ)-catalyzed dehydro-Diels-Alder reaction of ynamide-ynes
2.3 脱四氢Diels-Alder反应在合成芳香杂环化合物中的应用
金催化的Diels-Alder反应还能直接合成各种类型的含氮芳香杂环化合物. 2018年,资伟伟课题组[8]报道了金催化的脱四氢Diels-Alder反应合成吲哚啉类、咔唑类及其他含氮芳香杂环化合物(图10). 该反应以σ/π双活化模式进行,经历了亚乙烯基金中间体,随后发生6π电环化、[1,2]-H迁移,得到目标产物.
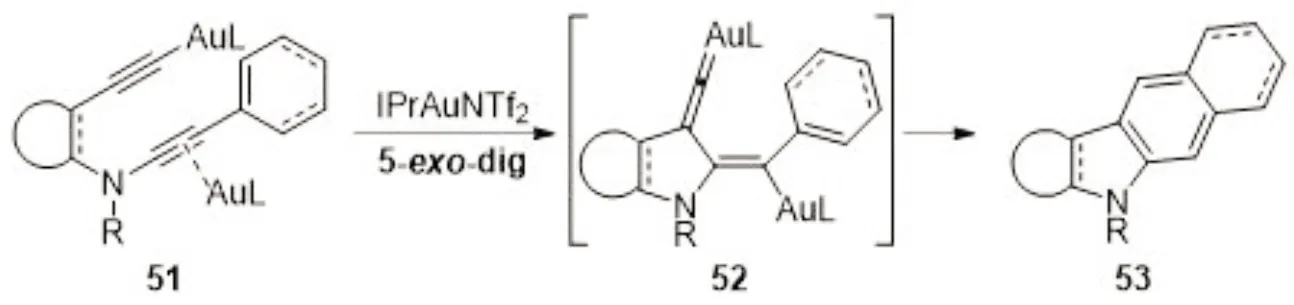
图10 金(Ⅰ)催化的脱四氢Diels-Alder反应Fig.10 Gold(Ⅰ)-catalyzed tetradehydro-Diels-Alder reaction
3 金催化杂Diels-Alder反应合成杂环化合物
含氮杂环常见于核苷、氨基酸、糖、维生素、生物碱等重要化合物中. 在药物分子里引入杂环结构,对于改善药物选择性与利用度、脂溶性与水溶性、分子极性都有很大作用. 金催化的杂Diels-Alder反应能够有效地构建各种含氮杂环化合物,比如吲哚、咔唑、吡啶、哌嗪等. 杂Diels-Alder反应由于具有较好的区域选择性、非对映选择性和对映选择性,是功能化杂环最有效的合成方法之一.
3.1 杂Diels-Alder反应在合成三螺环氧化吲哚中的应用
手性螺环吲哚是众多具有生物活性的天然产物的核心结构,然而三螺环氧化吲哚因其含有多个季碳中心的复杂骨架,其合成相当具有挑战性. 2018年,李灿团队[9]报道了高效的有机碱和金共催化串联的不对称1,2-加成/氢胺化/杂Diels-Alder/脱异丁烯反应(图11),以优秀的对映选择性(91%~99%ee)合成了多种复杂的三螺环氧化吲哚骨架衍生物. 其中,金催化的杂Diels-Alder反应是该反应能够顺利进行的关键步骤.
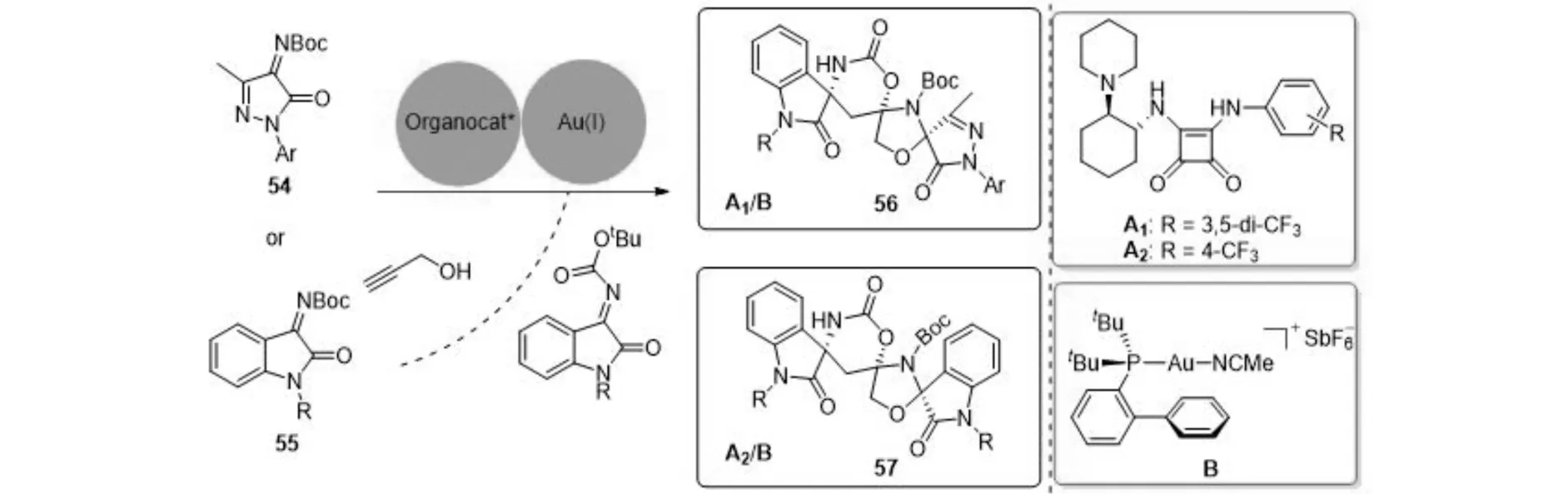
图11 金(Ⅰ)催化的1,2-加成/氢胺化/杂Diels-Alder/脱异丁烯反应Fig.11 Gold(Ⅰ)-catalyzed 1,2-addition/hydroamination/hetero-Diels-Alder/deisobutene reaction
可能的机理是炔丙醇和酮亚胺在手性有机碱的催化下发生不对称1,2-加成生成N,O-缩酮中间体59,一价金活化化合物59的碳碳三键,通过5-exo-dig形式的氢胺化反应形成活性很高的烯酰胺中间体62,原位质解金后化合物62作为亲双烯体与金活化的氧化吲哚衍生物60通过杂Diels-Alder环加成反应,同时消除一分子异丁烯,最终生成产物56或57(图12).
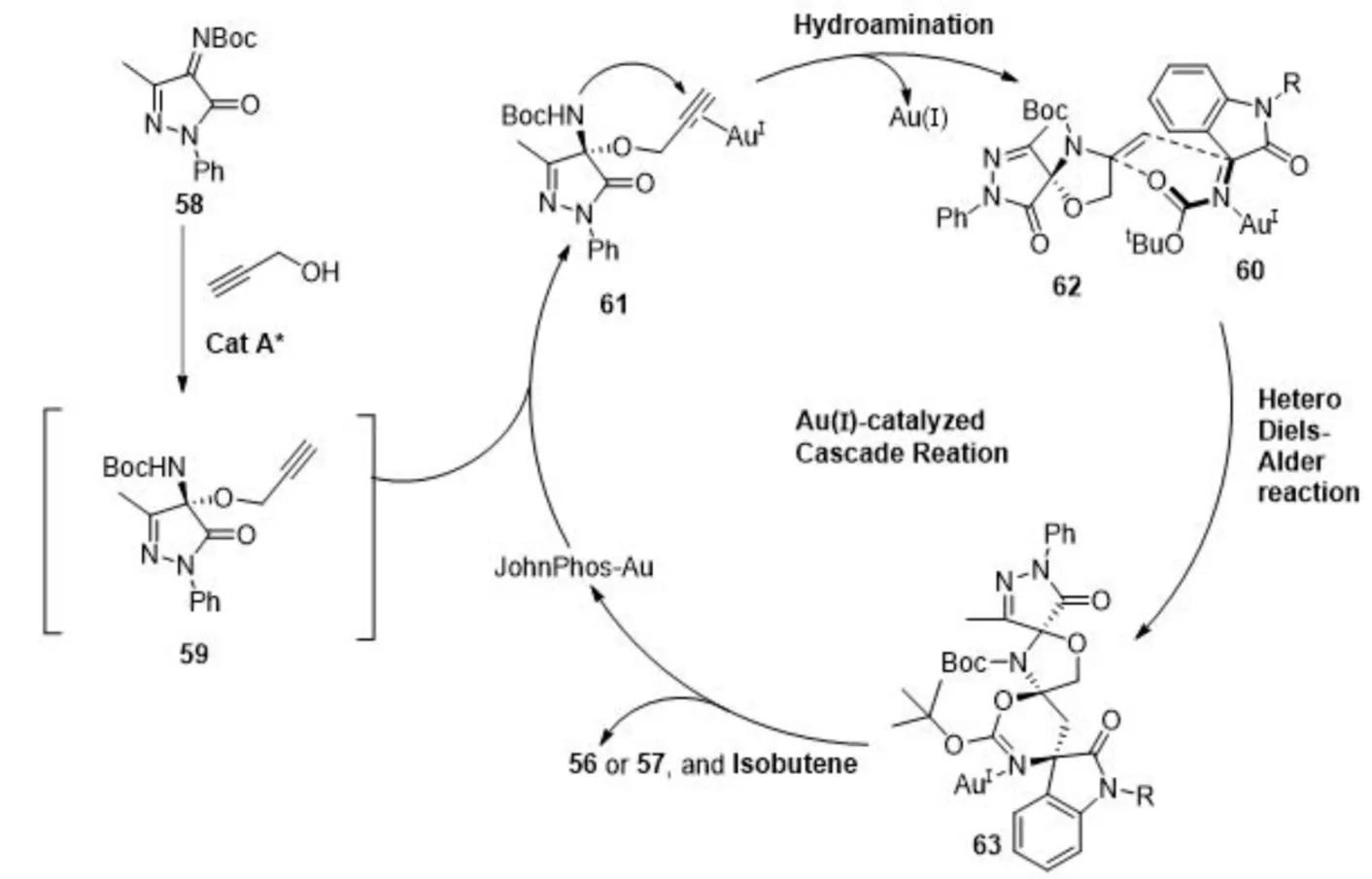
图12 可能的反应机理Fig.12 A plausible reaction mechanism
3.2 杂Diels-Alder反应在合成四氢哒嗪衍生物中的应用
杂Diels-Alder反应被认为是构建官能团化杂环的最有效的方法之一,也是构建六元杂环的有力方法之一. 在各种对映选择性的杂Diels-Alder反应中,以偶氮化合物作为亲双烯体的反应能够产生具有光学活性的四氢哒嗪衍生物,这是许多具有生物活性的天然产物中普遍存在的核心结构单元. 2013年,龚流柱课题组[10]研究了一类金催化的高区域选择性、高对映选择性的杂Diels-Alder反应,手性一价金络合物作为路易斯酸活化二氮烯亲双烯体(图13),2016年在前期工作基础上又报道了金催化炔-二醇衍生物的串联脱水环化/氮杂Diels-Alder反应[11],该反应使用手性亚磷酰胺作为配体,得到具有光学活性的手性双环四氢哒嗪衍生物(图14).
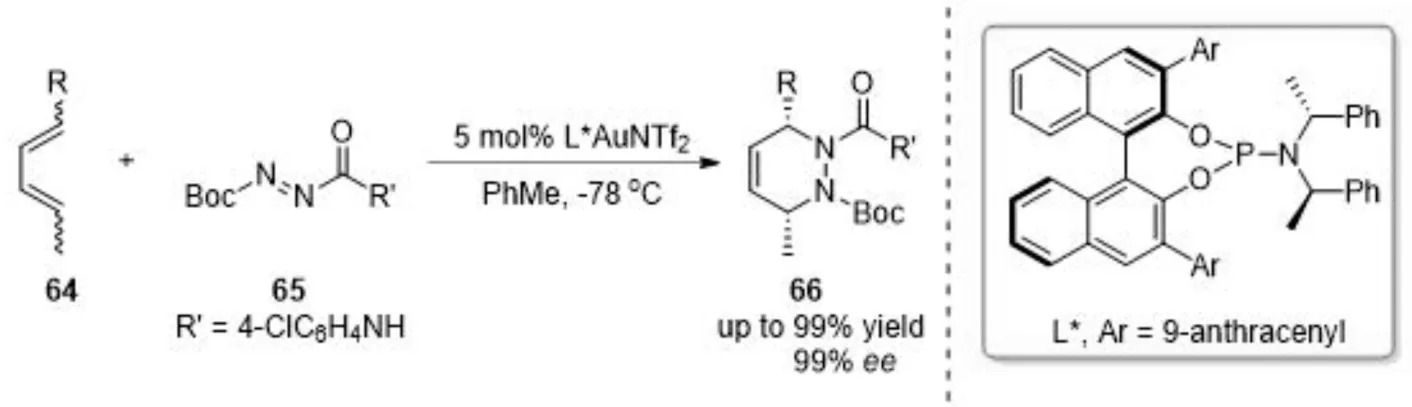
图13 金(Ⅰ)催化的杂Diels-Alder反应Fig.13 Gold(Ⅰ)-catalyzed hetero-Diels-Alder reaction
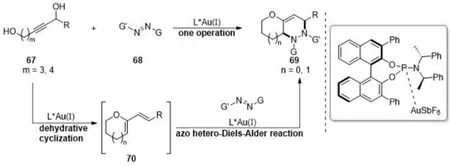
图14 金(Ⅰ)催化的串联脱水环化/杂Diels-Alder反应Fig.14 Gold(Ⅰ)-catalyzed tandem dehydrative cyclization/hetero-Diels-Alder reaction
3.3 杂Diels-Alder反应在合成四氢呋喃并吡喃化合物中的应用
2019年,BLOND及合作者[12]报道了一价金催化的杂Diels-Alder串联反应合成含四氢呋喃并吡喃骨架的复杂分子. 在此研究中,最具特色的是可以通过单一催化剂从单一原料中同时产生双烯体和亲双烯体. 而且,新生成的六根化学键、四个杂环和四个可控制的立体中心在一步操作中就能形成(图15).

图15 金(Ⅰ)催化的杂Diels-Alder 反应Fig.15 Gold(Ⅰ)-catalyzed hetero-Diels-Alder reaction
可能的机理是化合物高炔丙醇75与阳离子一价金配位生成π-络合物76,再通过5-exo-dig环化,形成烯基金中间体77,再原位质子解金后生成亲双烯体81. 化合物77除了可以质子解金成为一个非循环体之外,它的一部分由于含有炔基,还可以作为新的一价金受体,通过与三键配位,产生活化的中间体78经过8-endo-dig环化形成中间体79,然后消除金开环,形成氧杂双烯体80,再和亲双烯体81发生杂Diels-Alder反应生成中间体82,最后一价金催化化合物82发生炔烃的芳氢化反应,最终得到化合物83(图16).
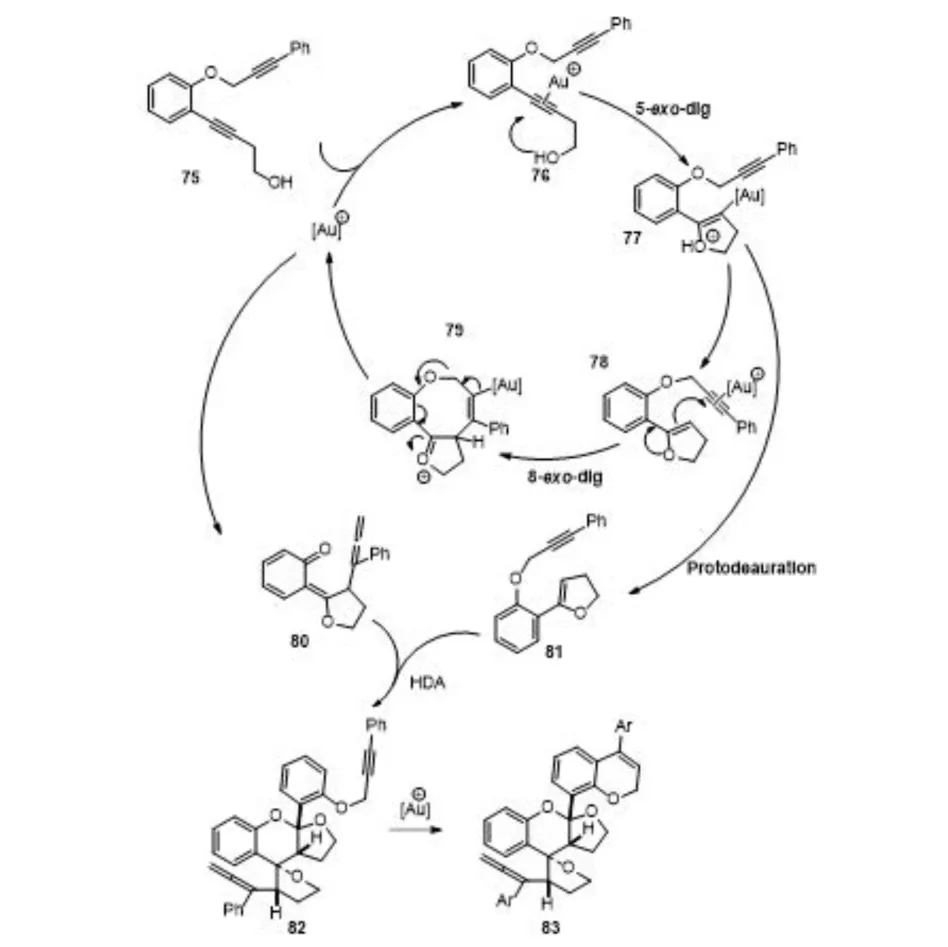
图16 可能的反应机理Fig.16 A plausible reaction mechanism
3.4 杂Diels-Alder反应在合成2,6-二氨基吡啶化合物中的应用
DUBOVSTEV组[13]报道了一种金催化的杂四氢Diels-Alder反应,以温和的条件和较高的收率用烯酰胺和氰胺合成不同取代的 2,6-二氨基吡啶(图17).
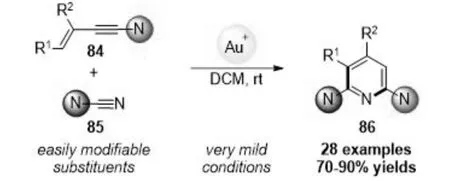
图17 金(Ⅰ)催化的杂四氢Diels-Alder 反应Fig.17 Gold(Ⅰ)-catalyzed hetero-tetradehydro-Diels-Alder Reaction
4 金催化的Diels-Alder串联反应合成桥环化合物
祝诗发等[14-15]报道了金催化炔醛或炔酮与降冰片烯发生Diels-Alder反应生成关键的环状o-quinodimethane (o-QDM)中间体,随后该中间体被另一分子降冰片烯[14]或缺电子烯烃[15]捕获,再次发生Diels-Alder反应,分别合成了一系列对称的或非对称的螺旋桨状分子(图18).
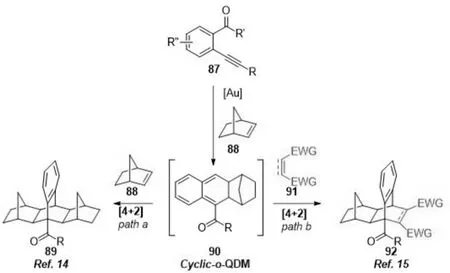
图18 金(Ⅰ)催化的环异构化/环加成反应Fig.18 Gold(Ⅰ)-catalyzed cycloisomerization/cycloaddition reaction
5 金催化的Diels-Alder合成天然产物
从天然产物分离出来的具有生物活性的化合物是药物研发中先导化合物的重要来源之一,Diels-Alder也被广泛应用于天然产物的合成. oxaphenalenone (OP) 是具有稠合三环骨架的复杂天然产物. 2019年,报道了一种合成oxaphenalenone系列天然产物neonectrolides B-E的方法[16]. 该合成依赖于金催化的烯炔醇底物6-endo-dig芳氢化反应以及串联的Rieche甲酰化/环化/脱保护策略,有效构建了三环oxaphenalenone骨架的前体邻亚甲基苯醌(o-QM). 随后采用串联的环异构化/[4+2]环加成策略快速构建了neonectrolides. 三环的oxaphenalenone97可以转化为corymbiferan内酯E和邻亚甲基苯醌(o-QM)前体. 这项研究工作最终将串联反应策略应用于neonectrolides B-E的合成以及之前还未实现的外式非对映异构体的合成(图19).
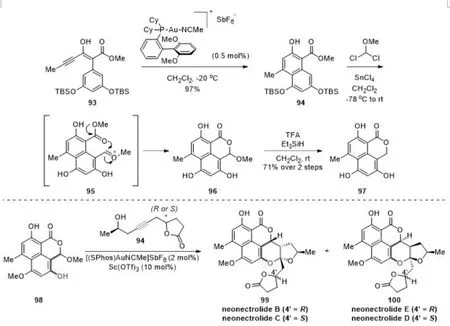
图19 金(Ⅰ)催化的芳氢化反应及环异构化/环加成反应Fig.19 Gold(Ⅰ)-catalyzed hydroarylation and cycloisomerization/cycloaddition reaction
关键步骤金催化环异构化/环加成反应可能的机理是:首先,金催化高炔丙醇102通过氢烷氧化生成中间体二氢呋喃金物种104,104也可以作为Brønsted酸与96作用,失去一分子甲醇,形成质子化的中间体邻亚甲基苯醌(o-QM)及烯基金中间体104B.104B原位质子解金生成二氢呋喃104C后和101发生[4+2]环加成反应生成103,并再生金催化剂(图20).
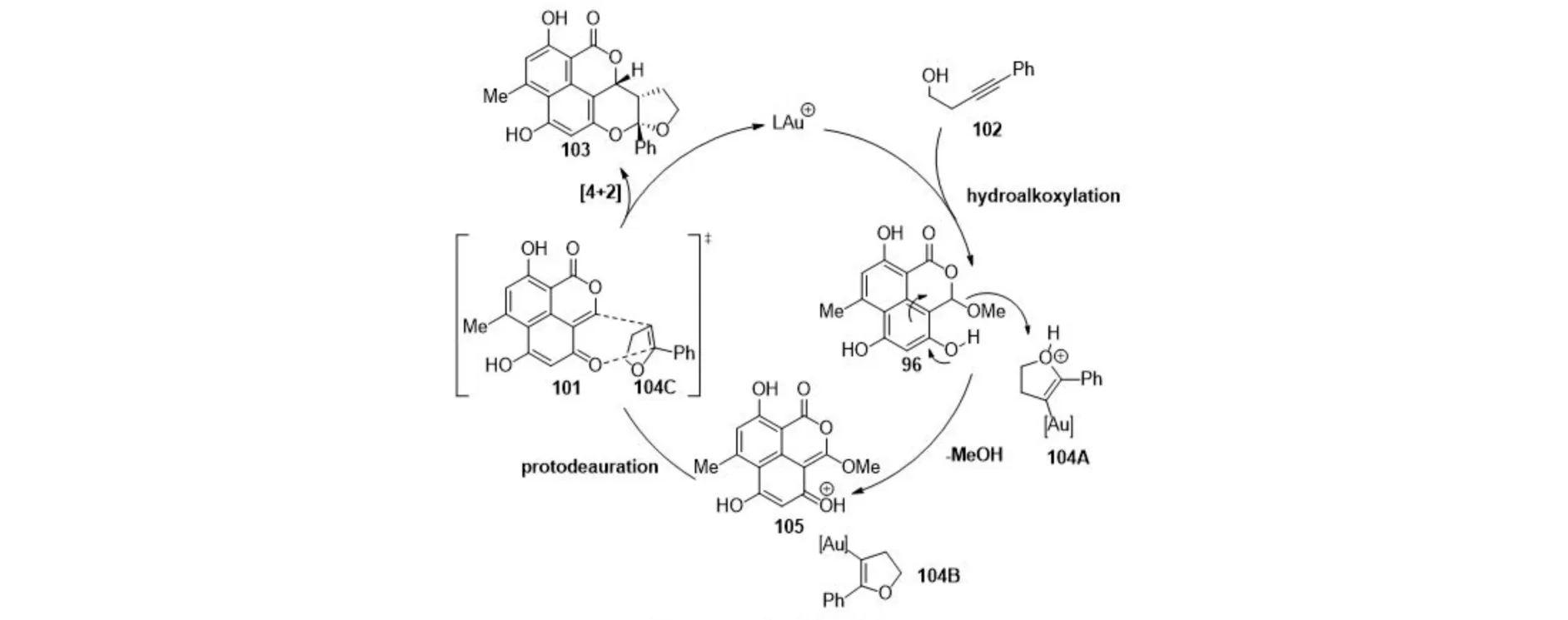
图20 可能的反应机理Fig.20 A plausible reaction mechanism
6 金催化的Diels-Alder不对称反应
在一般反应条件下,Diels-Alder反应得到的只是一对外消旋体,而不对称Diels-Alder反应可以有效地构建复杂结构的手性化合物,合成具有光学纯的化合物有着十分重要的意义. 目前,利用三价手性金络合物获得光学纯的对映异构体在不对称金催化中研究的非常少. 2020年,首次报道了手性氮杂环卡宾金(Ⅲ)络合物催化2,4-二烯醛和环戊二烯的γ,δ-Diels-Alder反应研究(图21)[17],开创了金催化在不对称反应中应用中的先河. 通过对一系列不同取代基修饰的手性氮杂环卡宾金(Ⅲ)催化剂筛选发现,2-氯-1-萘基取代的催化剂效果最好,能够高收率、高非对映选择性及高对映选择性合成高度官能团化的碳环化合物. 对底物和催化剂做详尽的过渡态能量计算后,发现底物近端的碳碳双键和催化剂中含有的芳香基团之间的π-π相互作用对产物的对映选择性控制至关重要.

图21 金(Ⅲ)催化的不对称Diels-Alder 反应Fig.21 Gold(Ⅲ)-catalyzed asymmetric Diels-Alder reaction
7 结语
金催化操作简单、安全,反应条件温和,大多数金催化剂对空气、潮气不敏感,催化剂用量少. 金可以作为一类温和的π酸,与不饱和化合物进行配位,降低不饱和键的电子云密度,增加不饱和键的亲电性,从而有效地活化不饱和键. 近年来通过金催化的Diels-Alder反应研究,合成了各种各样的六元碳环、杂环、桥环以及多环化合物. 通常,反应的模式为金活化炔烃、烯烃或者联烯的不饱和键,接着接受C、N、O、S等亲核试剂的进攻,发生加成反应后再进一步发生串联的Diels-Alder反应. 不难发现,近年来金活化炔烃的研究较为广泛,而活化烯烃和联烯的报道较少,相信在未来金活化烯烃和联烯的反应也会得到越来越多的关注. 此外,利用金催化Diels-Alder反应发展一锅法串联环化反应也有很大的发展空间,随着研究的不断深入,这种条件温和、底物普适性广的反应有望应用到更多具有药用价值的复杂天然产物全合成中. 最后,不对称金催化的Diels-Alder反应由于可以一步得到光学纯的对映异构体,避免了拆分浪费,符合原子经济性原则,在催化不对称合成领域也将得到进一步的发展.

