饲料脂肪源对大规格额尔齐斯河银鲫鱼种生长性能、体成分及血清生化指标的影响
高 攀,李晓东,焦 飞,张 钰,刘 晶,时春明,胡建勇
(新疆维吾尔自治区水产科学研究所 农业农村部西北地区渔业资源环境科学观测实验站,乌鲁木齐 830000)
额尔齐斯河是新疆三大河流之一,也是中国唯一一条北冰洋水系的国际河流,经新疆阿勒泰地区进入哈萨克斯坦后穿过西伯利亚平原汇入鄂毕河,最后注入北冰洋的喀拉海[1],其独特的水域生态环境孕育了土著鱼类23(亚)种(中国境内)[2]。额尔齐斯河银鲫(CarassiusauratusgibelioBlock)属鲤形目(Cypriniformes)、鲤科(Cyprinidae)、鲤亚科(Cyprininae)、鲫属(Carassius),是一种广温、杂食性鱼[3]。作为额尔齐斯河流域重要的土著鱼类,具有生长速度快[4]、营养价值高[5]等优点,且其对各种环境有广泛的适应性,对不良环境的耐受力比其他鲫鱼品种更强[6-7],是极具开发价值的优质土著经济鱼类,养殖市场前景广阔。目前,其产量仍主要依靠额尔齐斯河及其附属水体的天然渔业资源,但近年来,人类活动和水利工程严重影响了额尔齐斯河生态环境和鱼类物种多样性,额尔齐斯河银鲫种群资源量呈现逐渐衰退的趋势,依靠捕捞天然野生资源已无法较稳定满足日益增长的消费市场需求[3,8]。为保护天然水域额尔齐斯河银鲫的渔业资源,现需提高其人工养殖产量和规模,以满足 市场需求,从而缓解对野生渔业资源需求的 压力。
饲料是水产养殖业的重要物质基础。饲料中的脂肪是维持鱼类生命活动的重要能量来源,通过氧化和提供必要的成分维持细胞膜完整性,也是脂溶性维生素的载体[9]。鱼类人工配合饲料中的脂肪主要来源于鱼油、大豆油、菜籽油、猪油等脂肪源,不同脂肪源中脂肪酸的组成和比例各不相同,对鱼类生长发育、体组成以及脂质代谢的影响也有所差异。目前,脂肪源对鲫鱼生长性能和生理指标的影响研究报道主要集中在异育银鲫,研究发现,体质量3.53 g异育银鲫具有转化 18∶2n-6和18∶3n-3为高不饱和脂肪酸的能力,豆油、椰子油、菜籽油是其饲料中良好的脂肪源[10];体质量6.04 g±0.05 g异育银鲫的饲料中添加豆油和猪油替代70%鱼油,表现出较好的生长效果[11];体质量14.33 g±0.02 g异育银鲫饲料中添加5.4%的豆油、菜籽油、亚麻油能取得良好的生长效果[12]。由于养殖条件等限制,有关脂肪源对大规格鲫鱼鱼种的影响还未见报道。因此,本试验以大规格额尔齐斯河银鲫52.78 g± 0.10 g为研究对象,研究不同脂肪源对其生长性能、饲料利用、体成分和血清生化指标的影响,评价不同脂肪源的利用效果,为其精准配合饲料的开发提供参考。
1 材料与方法
1.1 试验饲料
以鱼粉、豆粕、菜粕为蛋白质源,面粉、次粉为糖源,鱼油、大豆油、菜籽油、葵花籽油、花生油、亚麻籽油为脂肪源,设计配制6种等氮等脂的饲料(记为FO、SO、RO、SFO、PO和LO),其组成和营养成分见表1。饲料原料经粉碎(9FZ-15型,四川简阳城西精工机械有限公司生产)后过60目筛,按表1将不同固体饲料原料称量,少量的组分(<5%)采用逐级预混法,充分混匀。随后加入脂肪源,再次混合后,加约30%的自来水,用饲料机(120型,山东章丘宇龙机械有限公司生产)制作成直径2 mm的颗粒饲料,自然风干后置于-20 ℃冰箱中保存,备用。试验饲料的脂肪酸组成如表2所示。
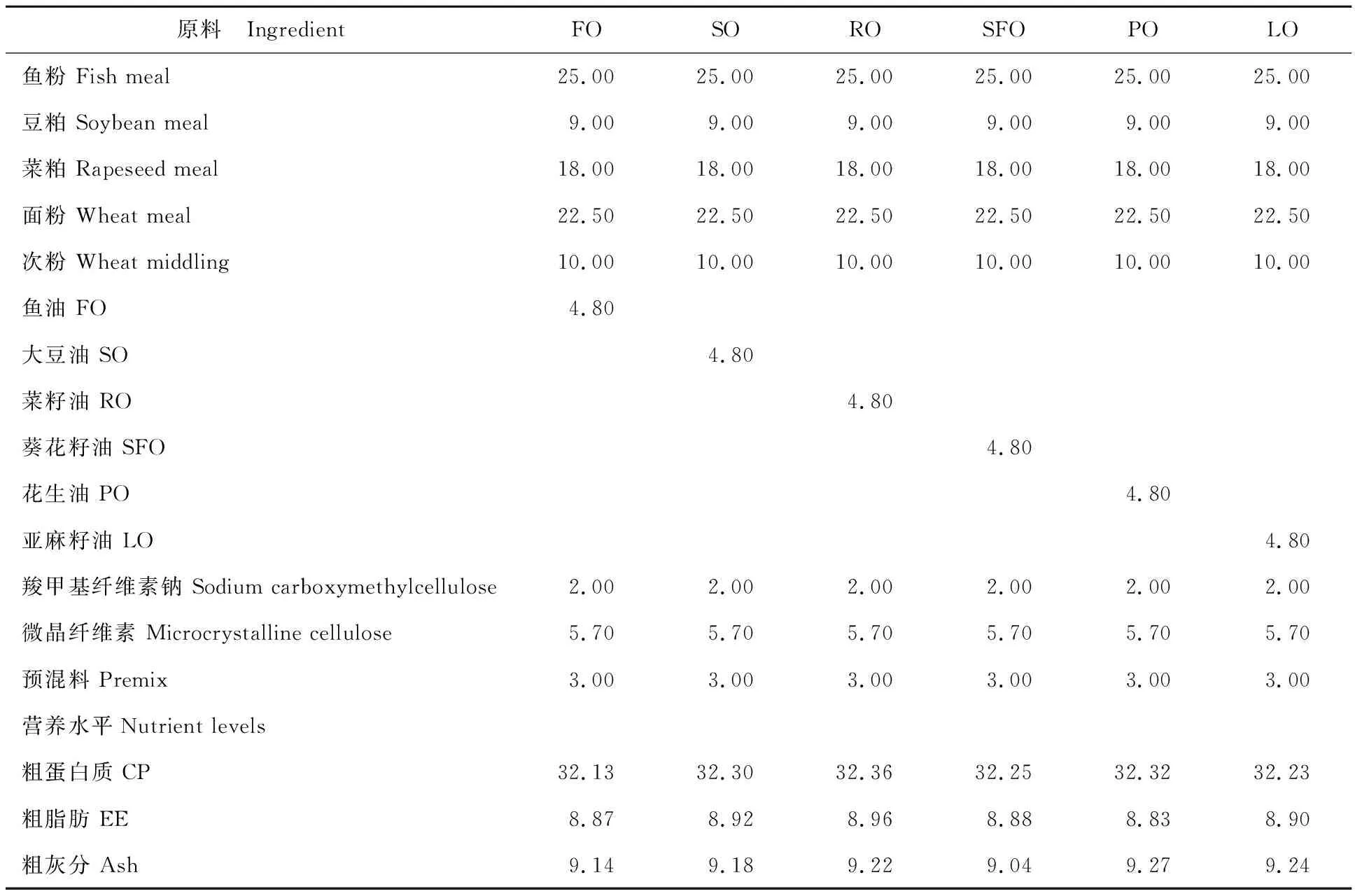
表1 饲料组成及营养成分(风干基础)

表2 试验饲料主要脂肪酸组成
1.2 饲养管理
试验用额尔齐斯河银鲫取自新疆水生野生动物救护中心,为野生亲本经人工繁育获得的池塘养殖驯化1龄鱼种。在正式试验前4周,捕捞放入室内圆形水泥池中用FO组饲料驯养,使其适应试验饲料和养殖环境。试验鱼在正式试验前停食24 h,随后挑选180尾体质健壮、规格整齐的试验鱼,放入同一套循环水养殖系统的18个养殖玻璃缸(长0.6 m×宽0.4 m×高0.7 m)中,每缸放鱼10尾。随机分为6组,每组设3个重复,分别投喂“1.1”中的6种试验饲料。养殖试验持续8周,每天饱食投喂 3次(10:00、14:00和18:00),保证无残饵剩余。
试验用水为充分曝气后的深井水。每个养殖缸的循环水量为100~120 L/h,连续充气。试验期间自然光照,水温为21~23 ℃,pH为8.0~8.6,溶氧质量浓度≥6.0 mg/L,氨氮质量浓度< 0.15 mg/L,亚硝酸盐质量浓度<0.05 mg/L。
1.3 样品采集
饲养试验结束后,停食24 h,每缸随机选取2尾试验鱼麻醉(苯氧乙醇,300 μL/L),测定体长、体质量后,用1 mL无菌注射器于尾静脉取血,在4 ℃下1 000 r/min离心(3K15型,德国希格玛实验室离心机公司生产)10 min后,取血清用于测定血清生化指标,解剖取肝脏、内脏并称量,随后取背部肌肉,置于-20 ℃保存,用于检测肌肉营养成分。另每缸随机选取3尾试验鱼称量后置于-20 ℃保存,用于检测全鱼常规营养成分。最后,对每缸试验鱼进行计数和称量。
1.4 指标测定
1.4.1 生长性能 根据下列公式,计算试验鱼的成活率(Survival rate,SR)、增重率(Weight gain rate,WGR)、特定生长率(Special growth ratio,SGR)、饲料效率(Feed efficiency,FE)、蛋白质效率(Protein efficiency rate,PER)、摄食量(Feed intake,FI)、肥满度(Condition factor,CF)、脏体比(Viscerosomatic index,VSI)和肝体比(Hepatosomatic index,HSI)。
SR=(S1/S0)×100%
WGR=[(W1-W0)/W0]×100%
SGR=[lnW1-lnW0]×100/t
FE=100×(Wf-Wi)/FT
PER= 100 ×(W1-W0)/(FT×P)
FI=FT×2/[(W0+W1)×t]
CF=(W1/L3)×100%
VSI=(Vw/W1)×100%
HSI=(Hw/W1)×100%
式中:S1、S0为试验鱼终末尾数(尾)和初始尾数(尾);W1、W0为试验鱼平均末体质量(g)和初始体质量(g);t为养殖时间;Wf、Wi分别为试验鱼末总质量和初总质量(g);FT为试验期间投喂饲料总质量(g);P为饲料中粗蛋白质含量(%);L为试验鱼的体长(cm);VW为试验鱼内脏质量(g);HW为试验鱼肝脏质量(g)。
1.4.2 常规营养成分 试验样品的水分含量采用103 ℃恒温干燥失重法测定(GB/T 5009.3-2003)测定,粗蛋白质含量采用凯氏定氮法(GB/T 5009.5-2003)测定,粗脂肪含量采用索氏抽提法(GB/T 5009.6-2003)测定,灰分含量采用马福炉灰化法(GB/T 5009.4-2003)测定。
1.4.3 血清生化指标 血清谷丙转氨酶(ALT)、谷草转氨酶(AST)、总蛋白(TP)、球蛋白(GLO)、白蛋白(ALB)、总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白(HDL-C)和低密度脂蛋白(LDL-C)均采用全自动生化分析仪(7180型,日本株式会社日立制作所生产)测定。
1.4.4 饲料及肌肉脂肪酸组成 总脂肪酸测定参照GB/T 9695.2-2008的方法,在谱尼测试集团测定。采用氯仿-甲醇提取法抽提总脂肪,分别用0.5 mol/L NaOH-甲醇和含量14%三氟化硼甲醇溶液使脂肪酸皂化,再用异辛烷和饱和NaCL溶液制备脂肪酸甲酯。样品皂化甲酯化后,加无水硫酸钠脱水,用气相色谱仪(GC-2010型,日本岛津制作所生产)进行分析。气相色谱色谱柱:SP2560,100 m×0.25 mm×0.20 μm。气相色谱操作条件:气化室温度250 ℃;传输线温度280 ℃。色谱柱升温程序:130 ℃,5 min;130~230 ℃,4 ℃/min;230 ℃,30 min。进样方式:分流进样,分流比为10∶1。进样量:1.0 μL。载气为氮气0.90 mL/min,氢气40 mL/min,空气400 mL/min。检测器为氢火焰离子化检测器,各脂肪酸相对含量采用面积归一化法计算。
根据肌肉与饲料中各类脂肪酸占总脂肪酸的质量百分比通过CORREL函数计算皮尔森相关系数(Pearson correlation coefficient,Pearson’s r),分析肌肉脂肪酸组成与饲料脂肪酸组成的相关性[13]。同时,根据下列公式分析不同脂肪酸在肌肉与饲料中的比例关系(relevance,R)[14]。
R=log2(CM/CD)
式中:CM为肌肉中某脂肪酸占总脂肪酸的质量百分比;CD为饲料中对应脂肪酸占总脂肪酸的质量百分比。
1.5 数据处理
试验结果采用SPSS 22.0的one-way ANOVA和Turkey均值多重比较法进行差异显著性分析,所有结果均以“平均值±标准差”表示,P<0.05为差异显著。
2 结果与分析
2.1 生长性能与饲料利用效率
由表3可知,饲料脂肪源对试验鱼的末体质量、增重率、特定生长率、饲料效率、蛋白质效率和摄食量产生显著影响(P<0.05),对成活率无影响(P>0.05)。增重率、特定生长率、蛋白质效率均为FO组显著高于其他组(P<0.05),LO组显著低于其他组(P<0.05),SO组、RO组、SFO组、PO组间无显著差异(P>0.05)。但饲料效率为FO组显著高于其他组(P<0.05);LO与PO组无显著差异(P>0.05),显著低于其他组(P< 0.05)。PO组摄食量显著高于SO组和LO组(P<0.05),与其余各组无显著差异(P>0.05)。

表3 不同饲料脂肪源额尔齐斯河银鲫的生长性能和饲料利用效率
2.2 形体指标
由表4可知,饲料脂肪源对各组试验鱼的肥满度、脏体比和肝体比无显著影响(P>0.05)。

表4 不同饲料脂肪源额尔齐斯河银鲫的形体指标
2.3 体成分
由表5可知,饲料脂肪源对全鱼和肌肉中的水分、粗蛋白质和灰分含量无显著影响(P> 0.05)。全鱼中粗脂肪含量LO组显著高于其他组(P<0.05);肌肉中粗脂肪含量LO组显著高于FO组和SO组(P<0.05),与其他组无显著差异(P>0.05)。

表5 不同饲料脂肪源额尔齐斯河银鲫的全鱼和肌肉成分
2.4 背肌脂肪酸组成
图1显示,各试验组鱼体肌肉各脂肪酸占总脂肪酸的质量百分比中,C17∶0、C16∶1n-7、C20∶4n-6、C22∶6n-3高于饲料,C18∶0、C18∶3n-3、C20∶5n-3低于饲料。植物脂肪源(SO、RO、SFO、PO和LO)各脂肪酸转化率中,C22∶6n-3、C20∶2n-6、C20∶4n-6高于FO组,C18∶2n-6低于FO组。
由表6可知,各试验组鱼体肌肉中的 C16∶0、C18∶1n-9和C18∶2n-6分别在SFA、MUFA、PUFA中占较大比例。各脂肪酸占总脂肪酸的质量百分比中,FO组C14∶0、C16∶0等饱和脂肪酸和C20∶1n-9、C20∶3n-3、C20∶5n-3、C20∶2n-6、C22∶2n-6等不饱和脂肪酸显著高于其他组(P<0.05),FO组C22∶6n-3与SFO、PO组无显著差异(P>0.05),显著高于其余各组(P<0.05);SO组C18∶0与SFO组无显著差异(P>0.05),显著高于其他组(P<0.05);RO组C18∶1n-9、C22∶1n-9显著高于其他组(P< 0.05);SFO组C18∶2n-6、C22∶6n-3、C20∶3n-6、C20∶4n-6显著高于其他组(P<0.05);LO组C18∶3n-3、C18∶3n-6显著高于其他组(P< 0.05)。肌肉中各脂肪酸组成与饲料脂肪酸组成呈明显正相关,相关系数0.93~0.97,FO组与RO组相关系数显著高于其他组(P<0.05)。
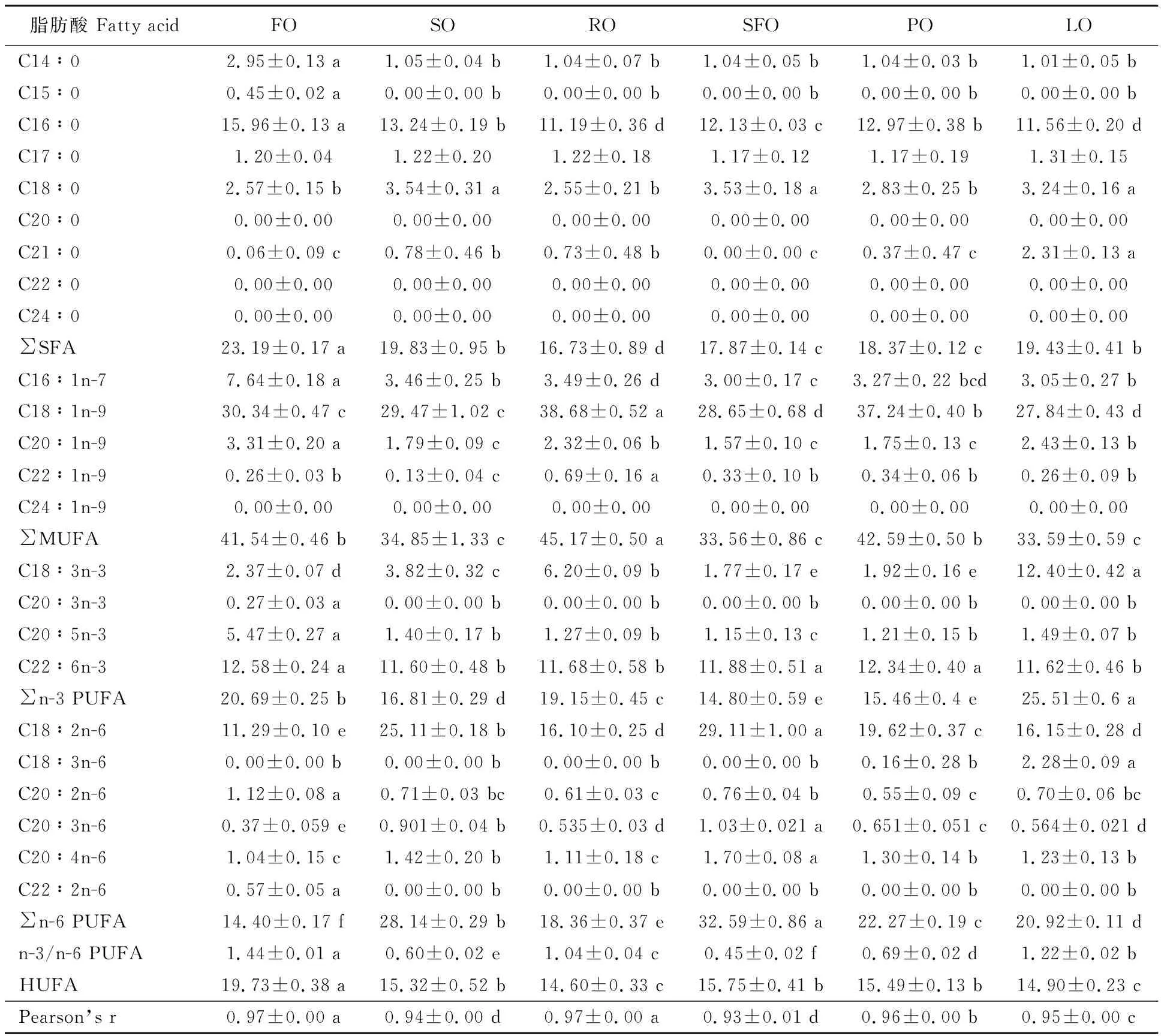
表6 不同饲料脂肪源额尔齐斯河银鲫的背肌脂肪酸组成
2.5 血清生化指标
由表7可知,饲料脂肪源对血清ALT、AST活性及TP、GLO、ALB、TG、HDL-C含量无显著影响(P>0.05)。试验鱼的血清TC、LDL-C含量FO组显著高于其他组(P<0.05)),其他各组之间无显著性差异(P>0.05)。LDL-C/HDL-C比值FO组最高、SO组最低,其他各组无显著性差异(P>0.05)。
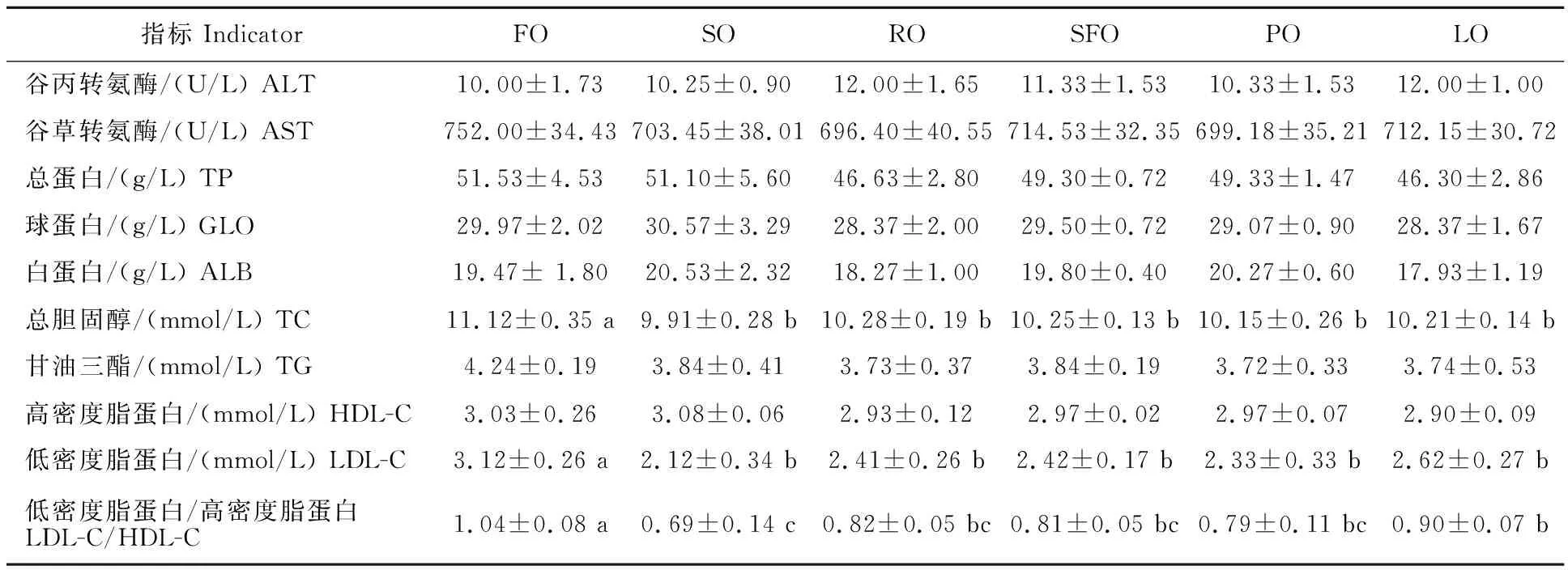
表7 不同饲料脂肪源额尔齐斯河银鲫的血清生化指标
3 讨 论
3.1 饲料脂肪源对大规格额尔齐斯河银鲫鱼种生长性能和饲料利用的影响
鱼油因富含不饱和脂肪酸且易被鱼类吸收利用,被视为渔用饲料的优质脂肪源[15-16]。本试验中,FO组WG、SGR和FE均明显高于其他脂肪源组,表明鱼油在促生长和饲料利用方面具有明显的优势,这与异育银鲫幼鱼的研究结果存在一定差异性。研究发现,体质量6.04 g±0.05 g异育银鲫SO组、PO组与FO组表现出相似的生长性能、表观消化率[11];体质量14.33 g±0.02 g异育银鲫在增重率、特定生长率方面SO组、RO组显著高于FO组[12]。这可能与试验中FO组的芥酸含量有关,本试验中芥酸(C22∶1n-9)含量为0.78%,上述试验饲料芥酸含量为3.11%~3.29%,FO组饲料中高含量芥酸抑制鱼体生长,从而导致未表现出相应的生长效力[17]。
针对异育银鲫幼鱼的研究发现,其不需要太多HUFA,过多的 HUFA 会使其处在不自然或不正常的应激状态,需要通过一些生理代谢反应来缓解这种不良情况[10]。本试验未表现出类似结果,这可能与不同品种鲫鱼对脂肪利用方式和能力存在差异有关。因为额尔齐斯河流域纬度较高,具有气温低、冬季漫长等气候特点,长期寒温带气候条件导致土著鱼类额尔齐斯河银鲫需要较高的不饱和脂肪酸以满足其生长需求[18],从而导致鱼油有更优的促生长表现。
3.2 饲料脂肪源对大规格额尔齐斯河银鲫鱼种形体指标、体成分和脂肪酸组成的影响
形体指标CF、VSI、HIS作为衡量动物体身体状况的特征值,可反映出鱼类个体生理及营养状况[19],不同脂肪源饲料可引起组织脂肪沉积差异,从而导致形体指标变化。从试验鱼体成分分析,全鱼和肌肉中脂肪含量LO组最高,FO组最低,这表明亚麻籽油对肌肉中脂肪沉积的能力高于鱼油,FO组因富含n-3 HUFA,抑制了脂肪合成,继而降低了脂肪沉积量[20-21]。本试验中全鱼和肌肉的脂肪含量差异未表现在鱼体形体指标上,这可能与饲料投喂时间有关,表明形体指标CF、VSI、HIS在额尔齐斯河银鲫的饲料脂肪源研究中不是敏感指标。
对异育银鲫[11-12]、吉富罗非鱼[22]、草鱼[23]、鲟鱼[24]等研究均发现,鱼类肌肉脂肪酸的组成基本反映了饲料脂肪酸的组成。本试验也显示,额尔齐斯河银鲫肌肉脂肪酸组成与饲料脂肪酸含量具有高度相关性。饲料脂肪酸含量中,FO组SFA、C20∶5n-3、C22∶6n-3,RO组C18∶1n-9,SFO组C18∶2n-6,LO组C18∶3n-3、C18∶3n-6含量较高,在鱼体肌肉脂肪酸中均表现出相似性。
比较不同脂肪酸在肌肉与饲料中的比例关系发现,植物脂肪源组(SO、RO、SFO、PO和LO)对C22∶6n-3、C20∶2n-6、C20∶4n-6转化高于FO组,且肌肉中含量高于饲料,而C18∶2n-6,C18∶3n-3含量降低,这与草鱼[25]、异育银鲫[10]的研究结果类似,表明额尔齐斯河银鲫具有利用18碳脂肪酸合成20碳或22碳多不饱和脂肪酸的能力。
3.3 饲料脂肪源对大规格额尔齐斯河银鲫鱼种血清生化指标的影响
鱼类血液指标与机体的代谢有密切关系,被广泛用于评价鱼类的营养状况、健康状况及对环境的适应状况[26]。ALT、AST分别来源于肝细胞的细胞浆、线粒体中,转氨酶尤其是ALT在肝细胞内的浓度大约是血清中的1 100~5 000倍,机体在正常状态下血液中ALT活性极低,若有1%的肝细胞受到损害,就会使血清中ALT的水平显著增高,因此,转氨酶水平是判断肝功能损伤的比较敏感指标[27]。本试验结果显示,饲料脂肪源对额尔齐斯河银鲫血清中ALT、AST活性没有显著影响,这与异育银鲫[17]、黄颡鱼[28]的结果一致。
TP和ALB是检测肝脏健康的重要指标,肝脏损伤会造成血清TP、ALB含量下降[29];同时,它们也与机体营养状况呈正相关[30];GLO能与特异性抗原起免疫反应,是评价机体体液免疫水平的一个重要指标。本试验中,各组的TP和ALB、GLO含量没有显著差异,这与异育银鲫[12]的试验结果相同,说明不同脂肪源对额尔齐斯河银鲫蛋白质的吸收代谢水平、免疫水平均无显著影响。
血浆中TG和TC包括外源和内源性的,外源性的为饲料中获取并经消化道进入血液,内源性的为肝脏、脂肪组织等部位合成进入血液[31],试验中发现,FO组TG、TC高于其他组,表明FO组鱼体的脂代谢水平较高。LDL主要作用是将肝脏合成的内源性胆固醇转运到全身其他器官和组织中,过量LDL易引发动脉硬化;HDL的主要功能是将胆固醇从肝外组织移出并转运回肝脏以进一步代谢,防止胆固醇在血管壁的沉积,有利于预防心血管疾病[32],LDL-C/HDL-C比值可作为评估鱼体心血管健康的指标[33]。本试验中,LDL-C/HDL-C比值FO组最高,SO组最低,表明饲料中添加豆油比鱼油更有利于鱼体心血管健康;FO组鱼体未表现出肝功能损伤,可能是因为LDL-C/HDL-C比值仍在正常范围内,也可能与饲料中HUFA,特别是DHA含量较高,提高了鱼体肝脏的抗氧化能力有关[34-35],具体原因还有待进一步研究。采用鱼油和大豆油混合添加作为额尔齐斯河银鲫饲料脂肪源,可在利于心血管健康的同时,降低因HUFA高含量而发生饲料脂质过氧化的风险[12,36]。
4 结 论
鱼油作为饲料脂肪源能显著提高大规格额尔齐斯河银鲫的生长性能,亚麻籽油不利于额尔齐斯河银鲫生长。额尔齐斯河银鲫肌肉中脂肪酸组成与饲料脂肪酸含量呈明显正相关,其具有利用18碳脂肪酸合成20碳或22碳多不饱和脂肪酸的能力。鱼油作为饲料脂肪源提高机体的脂代谢水平,饲料中添加豆油有利于鱼体心血管健康。

