黄芪皂苷II调控CD45 PTPase诱导抗肿瘤免疫效应的研究*
王 敏,郑 喜,普晓佳,万春平△
(1.云南省第一人民医院急症医学部,云南 昆明 650032;2.云南中医药大学第一附属医院,云南 昆明 650021;3.云南中医药大学中药学院,云南 昆明 650500)
补益中药黄芪具有健脾补中、升阳举陷、益卫固表、利尿、托毒生肌之功效,中医临床上常配伍应用于免疫低下癌症患者,以达到增加疗效、减轻毒副反应的效应[1-2]。现代研究表明,传统黄芪主要活性成分之一—黄芪皂苷具有广泛的生物活性,其中包括抗肿瘤和免疫调节,然而其抗肿瘤免疫作用机制不明确[3-5]。最新研究已证实,T淋巴细胞介导的免疫功能在抗肿瘤免疫中发挥关键作用,T细胞既是免疫应答的主要调节细胞,又是免疫功能的执行者,T淋巴细胞执行的免疫监视功能在机体防疫肿瘤的发生与发展发挥关键作用。因此,如何提高机体的抗肿瘤免疫,尤其是T淋巴细胞功能,对于肿瘤患者的治疗至关重要。CD45分子属于PTPase家族之一,主要表达在淋巴细胞表面,其主要功能传递T细胞抗原受体信号,在T细胞活化信号中扮演重要角色,与肿瘤的发生与发展密切相关[6]。在CD45 PTPase筛选模型和细胞模型中,本研究团队前期发现黄芪皂苷能够激活CD45 PTPase,诱导Th1细胞介导免疫反应[7-9]。然而在真实的H22荷瘤小鼠病理环境中,黄芪皂苷是否通过激活CD45 PTPase介导抗肿瘤免疫,目前尚未明确,值得进一步研究。本研究以H22荷瘤小鼠为模型,研究黄芪皂苷激活CD45 PTPase干预H22荷瘤小鼠的作用机制,为其临床应用提供实验基础。
1 实验材料
1.1 动物 8周龄SPF级雌性BALB/c小鼠21只,体质量(18.00±2.00)g,动物由湖南斯莱克景达实验动物有限公司,合格证号:SCXK(湘)2016-0002,动物饲养在云南中医药大学第一附属医院中心实验室屏障系统,饲料和水消毒后,给予实验动物自由摄取。
1.2 主要药物与试剂 黄芪皂苷II由云南中医药大学中药学院左爱学博士提供,受试药物呈白色粉末状,纯度>99%,黄芪皂苷II用0.5%羧甲基纤维素钠做成混悬剂灌胃给药。Trizol裂解液由天根生化(北京)科技有限公司提供。SYBR Premix Ex TaqⅡ染料和RNA逆转录试剂盒来自Takara公司;荧光标记的抗小鼠IL-17A、抗小鼠Foxp3、抗小鼠CD4和抗小鼠IFN-γ抗体均来自美国Biolegend公司;抗小鼠CD45抗体购自 eBioscience;PMA、Ionomycin以及 BFA购自Sigma公司;H22细胞系购自中国科学院昆明动物研究所。
1.3 主要仪器 Canto II流式细胞仪由美国BD公司提供;核酸扩增荧光检测仪由美国安捷伦公司提供;二氧化碳培养箱购自美国赛默飞世尔科技公司;酶标仪购自美国Molecular Devices公司;离心机购自德国贺利氏仪器公司;PCR基因扩增仪购自美国ABI公司。
2 实验方法及评价
2.1 H22荷瘤小鼠模型的构建、分组和给药 复苏H22细胞株,培养2~3代后,接种在BALB/c小鼠,接种7d后,腹部消毒,抽取腹水,PBS洗2遍,配成浓度为5×106个/mL单细胞悬液,于右侧腋下进行接种,体积为0.2 mL。然后随机分为3个组,即模型组、黄芪皂苷II组和抗CD45抗体+黄芪皂苷II组,每组7只。模型组灌胃给予生理盐水0.2 mL;黄芪皂苷II组以黄芪皂苷II 30 mg/kg灌胃给药;抗CD45抗体组+黄芪皂苷II组给药方式在给黄芪皂苷II组的基础上,注射抗 CD45 抗体(1 μg/kg),每日 1次,连续 21 d。
2.2 小鼠瘤径和瘤重抑制率测定 末次给药后处死小鼠,完整剥离肿瘤,称重,利用游标卡尺测量长径(a)和垂直横径(b),并根据公式:DT=(a× b)1/2,VT=(a×b2)/2,计算。并计算平均瘤径(DT)及瘤积(VT),瘤积抑制率。并计算肿瘤抑制率。
2.3 MTT法检测淋巴细胞的增殖活性 常规制备各组脾淋巴细胞,调细胞浓度为4×106个/mL,接种于96孔板(4×105个/孔),同时加入 2.5 μg/mL ConA 进行刺激,细胞于含5% CO2培养箱中培养48 h,培养结束后,每孔加入 20 μL MTT溶液,继续培养1~2 h,3 000 r/min离心5 min,贴壁吸去上清液,每孔加入150 μL的DMSO,振荡器震荡溶解蓝紫色结晶,酶标仪570 nm处检测吸光度。
2.4 荧光定量PCR检测 常规制备脾淋巴细胞,调细胞浓度为 1×107个/mL,离心,PBS洗 2遍,加入 Trizol裂解液1 mL,裂解脾淋巴细胞。参照产品说明书,采用RNA高效总RNA提取试剂盒提取总RNA,然后进行RNA浓度的定量,反转成cDNA。以转录所得的cDNA为模版,取同一份cDNA作为扩增模板,按照SYBR Premix Ex TaqⅡ染料使用说明书,实时荧光定量 PCR 测定 IL-2、IFN-γ、IL-4、T-bet mRNA 表达水平。荧光定量PCR的结果以Ct值显示。详细的PCR引物序列如下表:

基因 P C R引物序列 扩增产物长度(b p)I L-2 F o r w a r d 5'-T G A G C A G G A T G G A G A A T T A C A G G-3'R e v e r s e 5'-G T C C A A G T T C A T C T T C T A G G C A C-3';3 2 0 I F N-F o r w a r d 5'-A T G A A C G C T A C A C A C T G C A T C-3';R e v e r s e 5'-C C A T C C T T T T G C C A G T T C C T C-3'; 3 3 0 T-b e t F o r w a r d 5'-C C A G G A A G T T T C A T T T G G G A A G C-3';R e v e r s e 5'-A C G T G T T T A G A A G C A C T G-3' 3 5 8 I L-4 F o r w a r d 5'-T A C C A G G A G C C A T A T C C A C G G A T G-3';R e v e r s e 5'-T G T G G T G T T C T T C G T T G C T G T G A G-3';3 6 8 β-a c t i n F o r w a r d 5'-G G C T G T A T T C C C C T C C A T C G-3';R e v e r s e 5'-C C A G T T G G T A A C A A T G C C A T G T-3'; 3 4 6
2.5 流式细胞术检测 流式细胞术检测参照文献[9-10]。简言之,分离各组脾淋巴细胞,与PMA、Ionomycin和 Brefeldin A于 37℃ 5% CO2培养 4 h。收集细胞,阻断非特异性结合,行细胞表面标志染色,固定、穿模,加入APC anti-mouse IL-17A和FITC anti-mouse IFN-γ抗体,流式细胞仪收集细胞,Flowjo软件分析。对于Foxp3胞内荧光染色,按照胞内染色方法染色,无需上述刺激,流式细胞仪收集细胞和分析。
3 实验结果
3.1 黄芪皂苷II对H22荷瘤小鼠抗肿瘤效应的影响抗肿瘤疗效结果见表1,ASI II干预组小鼠瘤重、瘤径(DT)及瘤积(VT)均显著低于模型组,差异具有显著性意义(P<0.05)。抗CD45 Ab+ASI II组小鼠瘤重、瘤径(DT)及瘤积(VT)高于单一 ASI II干预组,其中与模型组差异无显著性意义,提示CD45抗体干预能部分取消ASI II抗肿瘤效应。
表1 黄芪皂苷对H22荷瘤小鼠抗肿瘤效应的影响(±s,n=7)

表1 黄芪皂苷对H22荷瘤小鼠抗肿瘤效应的影响(±s,n=7)
注:与荷瘤模型组比较:*P<0.05;与ASI II组比较:#P<0.05。
组别 剂量/(m g·k g-1)荷瘤模型组 -瘤重/g 0.7 9±0.1 5 A S I I I组 3 0 m g/k g 0.4 5±0.1 0*C D 4 5 A b+A S I I I 1 g.m g/k g+3 0 m g/k g 0.7 8±0.1 5#D T V T 7 4.3 1±9.4 3 1 0 2 3±1 1 9 5 5.9 3±1 2.4 3* 6 6 0±2 2 3*7 4.3 9±1 0.5 8# 9 9 6±1 9 8#
3.2 黄芪皂苷II对肿瘤模型小鼠T淋巴细胞增殖活性影响 图1结果显示,在无丝裂原ConA刺激培养条件下,ASI II干预组显著提高淋巴细胞的增殖功能。抗CD45抗体干预对ASI II促进淋巴细胞的增殖功能无明显影响。在ConA刺激条件下,ASI II干预组淋巴细胞增殖活性高于荷瘤模型组,差异有显著性意义(P<0.05)。抗CD45 Ab+ASI II组小鼠脾脏对ConA诱导的T细胞增殖反应降低,与ASI II干预组比较,差异具有显著性意义(P<0.05)。
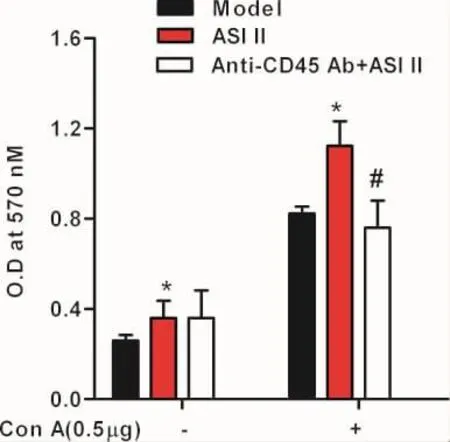
图1 黄芪皂苷II对H22荷瘤小鼠T淋巴细胞增殖的影响
3.3 黄芪皂苷II对H22荷瘤小鼠Th1/Th2细胞因子及转录因子mRNA的影响 荧光定量PCR检测结果表明,与H22荷瘤模型组比较,在转录水平,ASI II干预显著促进Th1细胞因子(IL-2、IFN-γ)及特异性转录因子T-bet mRNA表达,差异均有统计学意义(P<0.05)。抗CD45 Ab+ASI II组小鼠淋巴细胞IL-2、IFN-γ和T-bet mRNA低于ASI II药物干预组,其中IL-2和IFN-γ差异具有统计学意义(P<0.05)。ASI II药物干预显著提高Th2细胞因子(IL-4)mRNA表达,抗CD45 Ab干预部分取消ASI II促Th2细胞因子(IL-4)mRNA 表达(P<0.05),结果见图 2。
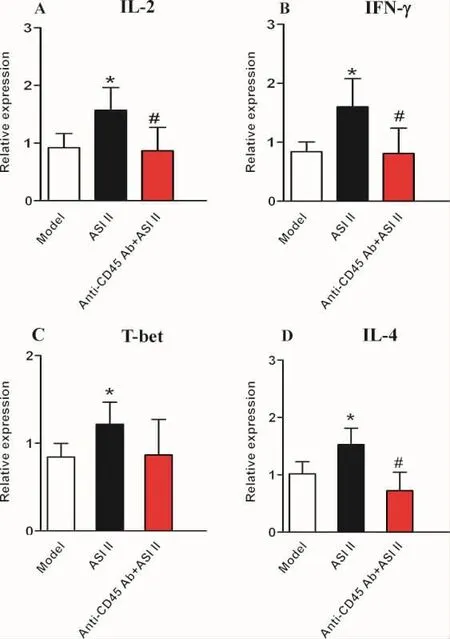
图2 黄芪皂苷II对H22荷瘤小鼠Th1/Th2细胞因子及转录因子mRNA的影响
3.4 黄芪皂苷II对H22荷瘤小鼠淋巴细胞Treg细胞比例的影响 Treg细胞染色结果如图3结果所示,黄芪皂苷II组小鼠脾淋巴细胞中CD4+Foxp3+调节性T细胞比例低于模型组(P<0.05);与模型组比较,抗CD45 Ab+ASI II组小鼠脾淋巴细胞中CD4+Foxp3+调节性T细胞无明显变化,说明CD45 Ab干预无法有效阻断ASI II诱导的Treg下调作用。

图3 黄芪皂苷II对H22荷瘤小鼠淋巴细胞Treg细胞比例的影响
3.5 黄芪皂苷II对H22荷瘤小鼠脾淋巴细胞Th1细胞(IFN-γ)比例的影响 细胞因子胞内染色结果如图4结果所示,黄芪皂苷II组小鼠脾淋巴细胞CD4+IFN-γ+T细胞比例显著高于模型组(P<0.05);与黄芪皂苷II组比较,CD45 Ab+ASI II组小鼠脾淋巴细胞中CD4+IFN-γ+T细胞比例显著降低(P<0.05)。
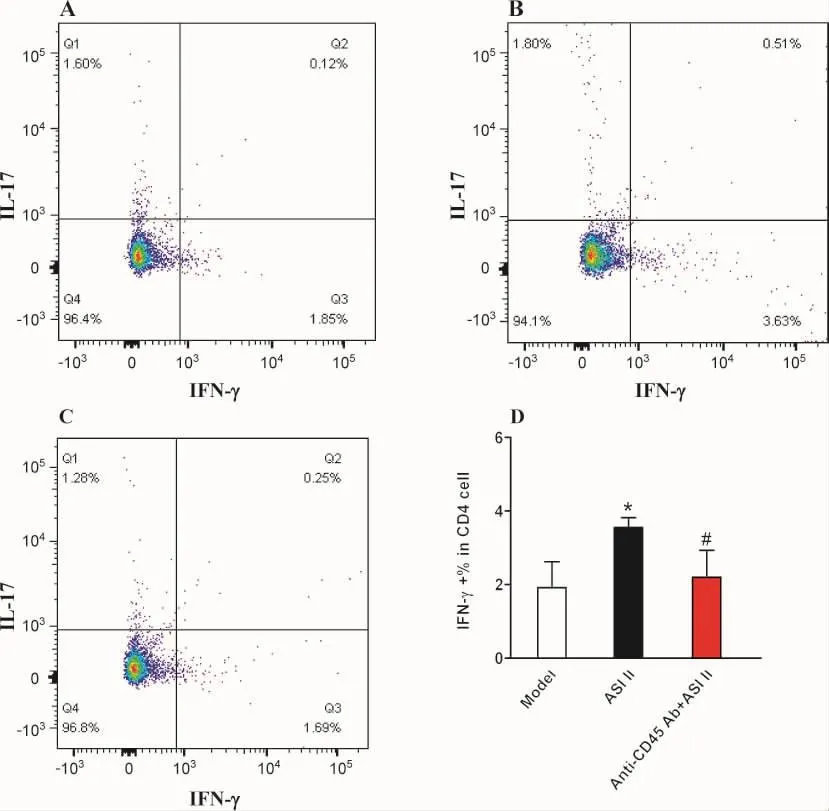
图4 黄芪皂苷II对H22荷瘤小鼠淋巴细胞Th1细胞(IFN-γ)比例的影响
提示在荷瘤病理环境中,CD45抗体阻断了ASI II诱导Th1细胞免疫反应。
4 讨论
CD45分子属于跨膜蛋白酪氨酸磷酸酯酶家族成员之一,研究已证实:CD45分子通过激活胞质区PTPase的活性,在T细胞活化信号中扮演重要角色,与肿瘤的发生与发展密切相关。因此CD45分子已成为抗肿瘤免疫药物筛选重要靶点[6]。
体内、外抗肿瘤研究结果已表明,ASI II体外细胞实验对肿瘤细胞增殖无明显影响,体内灌胃给药对小鼠移植性肿瘤H22和S180的生长具有抑制作用,促进荷瘤小鼠免疫抑制功能的恢复[5]。在原发性肝癌肺转移模型组,ASI II药物干预显著抑制抗肺转移效应,促进Th1细胞因子释放及T淋巴细胞的激活[9]。这些研究结果提示,黄芪皂苷抗肿瘤作用机制与增强机体抗肿瘤免疫效应有关,但具体的抗肿瘤免疫分子机制尚未明确。基于ASI II激活CD45 PTPase前期研究结果,我们提出“黄芪皂苷调控CD45蛋白酪氨酸磷酸酯酶介导抗肿瘤免疫作用”的科学假设。通过腋下注射H22肿瘤细胞,我们构建了H22荷瘤肿瘤模型,模拟真实荷瘤的免疫环境,以CD45抗体为研究工具,进一步阐明ASI II通过调控CD45 PTPase信号通路介导抗肿瘤免疫作用的新机制。本研究结果显示,黄芪皂苷具有显著抗肿瘤效应,促进模型小鼠脾淋巴母细胞增殖。在机体的抗肿瘤免疫反应中,T淋巴细胞发挥关键作用,尤其是Th1细胞免疫反应。辅助性Th1细胞激活主要分泌IFN-γ、IL-2等细胞因子,诱导机体的抗肿瘤免疫反应。本研究结果显示,ASI II促进荷瘤小鼠脾淋巴细胞Th1细胞免疫反应,包括上调IL-2和IFN-γ mRNA的表达和CD4+IFN-γ+h1细胞比例。而ASI II+CD45抗体组脾淋巴细胞的增殖活性、细胞因子IL-2和IFN-γ mRNA表达显著均低于ASI II单一组。结果提示,在荷瘤病理免疫环境中,黄芪皂苷II可能通过调控CD45 PTPase诱导Th1细胞反应。
T-bet是属于T-box家族的转录因子,属于Th1细胞特异转录因子,特异调控Th0细胞向Th1细胞趋向性分化,对辅助性Th1特异分化起着决定作用[12-13]。为明确黄芪皂苷激活CD45 PTPase如何诱导Th1细胞免疫反应反应,我们进一步采用qPCR检测Th1细胞特异转录因子T-bet mRNA的表达水平。结果表明,ASI II显著上调H22荷瘤模型小鼠脾淋巴细胞T-bet转录水平,CD45抗体减少
ASI II促T-bet mRNA表达,提示黄芪皂苷激活CD45 PTPase诱导Th1细胞免疫反应机制可能与诱导转录因子T-bet有关。前期我们在TCR诱导T细胞活化模型和免疫低下模型上,黄芪皂苷II显著增强Th1型免疫反应,两者研究结果一致[8]。Treg细胞主要介导机体的免疫耐受,它是机体维持自身内环境稳定的主要免疫调节机制,与抗肿瘤免疫密切相关[14]。流式细胞检测结果表明,ASI II显著下调荷瘤小鼠脾淋巴细胞CD4+Foxp3+Treg细胞表达水平,然而CD45抗体干预对Treg细胞比例下降无明显作用。提示黄芪皂苷II对Treg细胞的调控作用,可能不是通过激活CD45分子介导免疫反应。
总之,该研究证实黄芪皂苷II可能调控CD45 PTPase,促进Th1细胞因子释放及核转录因子的激活,增强抗肿瘤免疫效应。本研究为黄芪抗肿瘤免疫疗法和临床应用提供实验基础。

