伴肠母细胞分化的胃腺癌合并神经内分泌小细胞癌1例并文献复习
王立娟,曾敏,王成龙,邹凌凤,曹晓静,孙全,郭小红*
(1重庆市中医院病理科 重庆 400021;2重庆市中医院药剂科 重庆 400021)
伴肠母细胞分化的胃腺癌(gastric adenocarcinoma with enteroblastic differentiation, GAED)是胃癌的一种罕见亚型,是一种高度恶性肿瘤,此类肿瘤主要见于国外报道,国内少见报道。前期一直未见统一确切的定义,导致对此病的认识不足,直到2019年第五版消化系统肿瘤WHO分类中才对伴肠母细胞分化的胃腺癌做了形态学描述。目前,国内外报道病例比较统一的临床病理特点包括:此类肿瘤可引起血清AFP升高,表现为具有管状或乳头状结构,癌细胞胞质透明,形态类似于胎儿早期的肠上皮,因此称为伴肠母细胞分化的胃腺癌[1-6]。胃神经内分泌小细胞癌同样少见,同属于高度恶性肿瘤,两种成分同时出现在同一肿瘤中,未见报道。本文旨在通过对伴肠母细胞分化的胃腺癌合并神经内分泌小细胞癌的临床病理特点、免疫组织化学表型、预后及相关国内外文献的复习,进一步加深对此类肿瘤的生物学行为、预后的认识,为临床诊疗积累资料。
材料与方法
1 临床资料
患者,男,67岁,因反复胸闷、心悸半月入院。胃镜显示胃窦大弯巨大圆形溃疡,周围充血水肿,不规则隆起延及幽门,幽门变形。CT显示胃窦壁增厚,考虑癌可能,周围淋巴结稍肿大,余肝胆胰脾未见明显肿物。术前实验室检查未查AFP,术后7天实验室检查:血AFP17.70ng/ml(升高),CEA8.17ng/ml(升高),CA-125 61.0U/ml(升高),CA-199 34.11 U/ml(升高)。术后1月、2月、3月、4月分别复查血清AFP显示正常。术中所见:肿物位于胃窦部,约8×6cm大小,肿物似侵及胃后壁浆膜层,肝、胆、胰、脾及其余肠管未见明显肿物。
2 方法
常规苏木素-伊红(HE)染色,显微镜下病理组织学观察;免疫组织化学采用紧凑型聚合物(Compact polymer)法,抗CK8/18、Her-2、LCK、CK、SALL4、MUC2、MUC6、MUC5AC、villin、glypican 3、CD10、HepPar-1、HCG、SATB2、Syn、CgA、CD56、TTF-1、MSH2、MSH6、PMS2、MLH1、P53、LCA、desmin、SMAD4为小鼠单抗,抗CDX-2、PLAP、AFP、Ki-67为兔抗,所有一抗均购自福建迈新试剂公司,二抗为HRP标记的羊抗兔或羊抗小鼠,购自罗氏公司。免疫组织化学的操作步骤按说明书进行。通过原位杂交检测福尔马林固定、石蜡包埋的组织切片中表达的EB病毒编码的RNA(EBER),探针由地高辛标记,同时进行阳性对照实验,试剂购自福建迈新试剂公司。操作步骤按说明书进行。
结 果
巨检:胃大部切除标本,小弯长15cm,大弯长19cm,距离下切缘2cm处胃窦见溃疡型肿物,大小为6.5×5cm,肿物切面灰白质中,与周围分界欠清,网膜组织一块,大小为30×18cm,其内未扪及明显结节,小弯侧周围扪及淋巴结数枚,直径为0.2~1.5cm,大弯侧周围扪及淋巴结数枚,直径为0.5~2cm。
HE染色镜检:肿瘤主要由两种成分组成,第一种成分:占整个肿瘤的90%,肿瘤由腺样、乳头状、筛状结构组成,筛状结构中央可见粉色分泌物,部分呈胎儿原肠样,乳头状结构间质疏松水肿,似绒毛样结构,部分腺体呈高分化,细胞呈立方或柱状,胞质空亮,染色质呈粗块状,部分可见核仁,核分裂像多见(>20个/10HFP),胞质内可见嗜酸性小球;第二种成分:占整个肿瘤的10%,肿瘤细胞呈弥漫失粘附生长,细胞较小,呈圆形或短梭形,胞浆较少。弥漫生长区和腺样结构区相互交叉生长。
免疫组织化学及原位杂交检测:伴肠母细胞分化的腺癌成分呈LCK、CK、CK8/18、SALL4、MUC6、CDX-2、villin、glypican 3、AFP、MSH2、MSH6、PMS2、MLH1、SMAD4免疫反应阳性,Ki-67增殖指数约为70%,Syn、CgA、CD56、MUC5AC、MUC2、Her-2、TTF-1、P53、HCG、HepPar-1、LCA免疫反应阴性。神经内分泌小细胞癌呈CK、CK8/18、Syn、CgA、CD56免疫反应阳性, Ki-67增殖指数约为80%,余上述抗体阴性表达。原位杂交检测显示伴肠母细胞分化的胃腺癌和神经内分泌小细胞癌均EBER阴性。
病理诊断:伴肠母细胞分化的胃腺癌合并神经内分泌小细胞癌,癌组织侵及胃壁全层。小弯测淋巴结(1/23)见有癌转移,大弯测淋巴结(2/16)见有癌转移。
随访时间截止2021年5月,患者术后4个月进行了4个疗程的化疗,尚存。
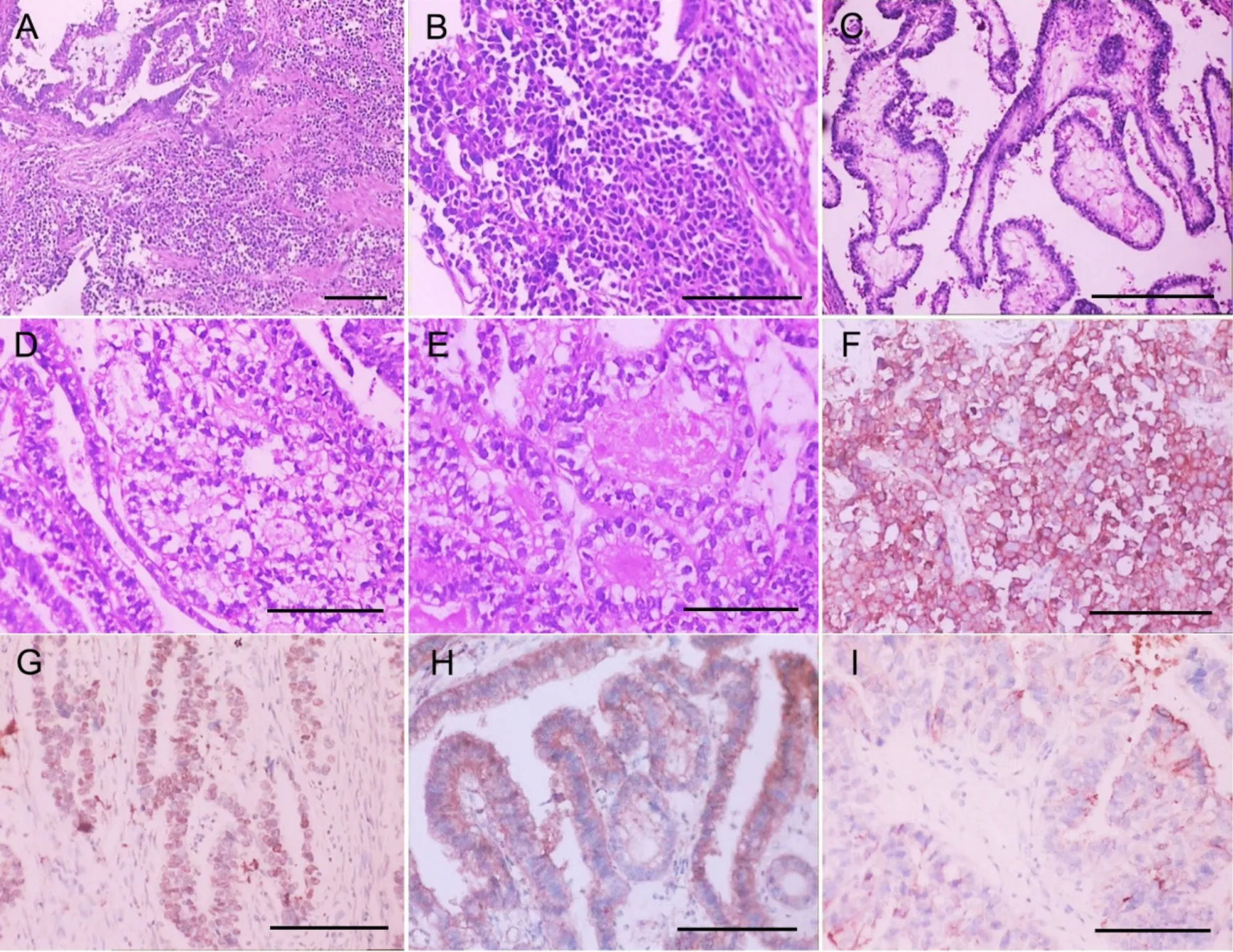
图1 伴肠母细胞分化的胃腺癌合并神经内分泌小细胞癌组织病理学及免疫组织化学观察。A—E,HE染色;F,Syn免疫组织化学染色阳性;G,SALL4免疫组织化学染色阳性;H,glypican-3免疫组织化学染色阳性;I,AFP免疫组织化学染色阳性;比例尺,50μmFig. 1 Histopathological and immunohistochemical observation of gastric adenocarcinoma with enteroblastic differentiation combined with neuroendocrine small cell carcinoma. A to E, HE staining; F, Syn positive immunohistochemical staining; G, SALL4 positive immunohistochemical staining; H,glypican-3 positive immunohistochemical staining; I, AFP positive immunohistochemical staining; scale bar, 50μm
讨 论
伴肠母细胞分化的胃腺癌(gastric adenocarcinoma with enteroblastic differentiation,GAED)于1994年由Matsunou等[2]首次报道,该肿瘤是一种具有高度侵袭性的肿瘤,早期容易发生淋巴结和远处转移。由于比较少见,目前缺乏统一的临床特征。苟思琪等[3]报道的41例GAED,发病年龄39~80岁,平均年龄64.8岁,男女比为4:1,其中14例行血清AFP检查,9例AFP升高(9.01~2000ng/ml),15例发生于胃窦。李巧转等[4]报道的11例GAED,发病年龄为52~76岁,男女比为2.7:1.0,且11例血清AFP均升高,AFP>10ng/ml。Murakami等[5]报道的29例GAED,发病年龄为59~85岁,平均年龄为73岁,男女比为4:1。Kurod等[6]报道的10例GAED,发病年龄52~82岁,平均年龄69.5岁,男女比为9:1。赵苏苏等[7]报道的8例GAED,发病年龄为61~81岁,平均年龄为68.75岁,男女比为3:1,3例血清AFP均升高,4例发生于胃窦。陆敏雅等[8]报道的8例GAED,发病年龄68~83岁,平均年龄76.6岁,男女比为3:1,2例AFP升高,5例发生于胃窦。上述报道均表明GAED多发于中老年人,男性居多,以胃窦多见,部分患者有AFP升高。本文报道病例也是发生于胃窦的老年男性,同时有血清AFP升高。
病理特征:伴肠母细胞分化的胃腺癌大体标本主要表现为溃疡型或隆起型肿物,以溃疡型多见,镜下形态主要由管状及乳头状结构组成,细胞呈立方或柱状,胞质透明,富含糖原,无黏蛋白产生,类似胎肠样结构,部分病例可见胚囊样结构、胞质内均质红染的小滴以及腺腔内的均质红染物,超微结构显示癌细胞具有发育良好的微绒毛和纤芯细丝,其根部随机形成终端网,与胎儿小肠的吸收上皮一致[2,4,7]。本例大体为溃疡型肿物,镜下特征符合上述病理特点,同时部分区域可见少量神经内分泌小细胞癌的区域,细胞失粘附性生长,呈卵圆形或圆形,胞质较少,围绕在腺体结构周围或者位于腺体间质内。
免疫组织化学特征:目前大量文献报道显示GAED主要表达胚胎性指标SALL4、AFP和glypican3。SALL4、AFP和glypican 3阳性表明该肿瘤分化程度较低。SALL4是一种干细胞标记物,GAED呈SALL4阳性表达表明GAED的起源可能和干细胞有关。Matsumoto等[9]对6例GAED进行SALL4、AFP和glypican 3免疫组织化学标记发现,每例至少有3种标记物中的一种阳性表达,且以glypican 3的敏感性最强。Murakami等[5]报道的29例GAED的免疫组化显示,SALL4、AFP和Glypican3三项中至少有一项阳性表达,其中glypican 3的阳性率约83%,SALL4阳性率约72%,AFP阳性率约45%,以glypican 3阳性率最高。李巧转等[4]报道的11例GAED中,8例表达SALL4,7例表达glypican 3,5例表达AFP,以SALL4阳性例数最多。赵苏苏等[7]报道的8例GAED中,7例表达SALL4,7例表达glypican 3,4例表达AFP。同时该肿瘤表达肠腺癌的标记物CD10、CDX-2和MUC6,而更成熟肠上皮标记物MUC2通常阴性。本例患者腺样结构区域免疫组织化学灶性表达SALL4、AFP和glypican3,同时表达MUC6、CDX-2和villin,与上述研究一致,同时圆形及卵圆形细胞区域表达神经内分泌标记Syn、CgA、CD56、CK。
鉴别诊断:GAED主要应与肝样腺癌、转移性肝细胞肝癌和胃卵黄囊瘤鉴别。①肝样腺癌:肝样腺癌也表达AFP,但GAED主要以乳头状结构为主,而肝样腺癌以实性为主,且SALL4在GAED中呈弥漫强阳性表达,在肝样腺癌中呈局灶性表达,肝样腺癌表达MUC2、MUC5AC,而GAED不表达这两项标记物[10]。②转移性肝细胞肝癌:转移性肝细胞肝癌原发部位有肿物,组织形态以梁状或腺样为主,表达HepPar-1,不表达SALL4、CDX-2,而GAED主要以乳头状结构为主,表达SALL4、CDX-2,不表达HepPar-1。③胃卵黄囊瘤:虽然二者血清均有AFP升高,且两者SALL4、glypican 3、AFP都阳性表达,但组织学形态上卵黄囊瘤更具多样性,主要表现为微囊、网状、内胚窦样、实性、管泡状、乳头状、肝样、腺样等,且卵黄囊瘤见常见Schiller-Duval小体,而GAED主要以腺样及乳头状结构为主。
生物学行为及预后:国内外多项研究表明产AFP的胃癌较普通胃癌预后差,其中也包括产AFP的GAED。Akazawa等[11]研究发现产AFP的胃癌通常预后差,肝转移率高。Liu等[12]报道了一项包括胃肝样腺癌、其他产AFP的胃癌和AFP阴性的胃癌的研究,发现三者1年生存率分别为30%、64%和95%,3年生存率分别为13%、47%和57%,5年生存率分别为9%、41%和38%,提示AFP阳性的胃腺癌预后较AFP阴性者差。也有部分研究发现GAED的预后和基因改变有关。Akazawa等[13]研究发现与普通胃腺癌相比,TP53基因突变在GAED中更常见,且几乎发生错义突变的病例均出现p53过表达,更具有侵袭性,且在GAED中常见ERBB2扩增,曲妥珠单抗对其治疗可能有效。Yatagai等[14]研究发现与普通胃腺癌相比,GAED中SMAD4基因缺失率更高,因此推测SMAD4可能是GAED的易感基因之一,SMDA4的失活导致肿瘤的侵袭性更强。Kataoka等[15]研究发现胃腺癌中DNMT3A阳性病例容易发生血管侵犯和淋巴结转移,生存期较短,而DNMT3A在GAED中的表达高于胃普通腺癌,因此也说明GAED比普通胃腺癌预后更差,且DNMT3A可能作为GAED的潜在治疗靶点。本例患者术后切除标本中胃小弯及大弯测均有1个及2个淋巴结转移,且转移成分为GAED,局灶区域可见少量Syn、CgA阳性的小细胞神经内分泌癌区域,Ki-67的增殖指数80%,也提示预后较差。Naritomi等[16]对337例胃腺癌回顾性研究发现,当肿瘤发生粘膜下及固有肌层浸润时,神经内分泌表型阳性组比阴性组发生淋巴结转移的比率更高,从而导致更差的预后。张等[17]研究发现胃癌伴有神经内分泌分化患者1年和3年生存率比不伴有神经内分泌分化患者低,预后更差。结合前期文献对GAED和胃癌伴神经内分泌分化的研究,推测本例GAED合并小细胞神经内分泌癌的预后较单纯性GAED预后更差,目前术后随访4个月,患者存活。
总之,GAED合并神经内分泌小细胞癌预后差,较早发生淋巴结转移,GAED治疗主要以手术切除和术后化疗为主,前面多项研究显示靶向治疗可能具有一定潜在可行性,但还需要更多的研究深入探讨。

