丝素蛋白/氨基氧化石墨烯复合水凝胶的制备及性能研究
朱燕祥,焦玉全,黄佳涔,李 莉,彭晓佳,张鲁中,赵亚红
(1.南通科技职业学院,江苏 南通 226001)(2.南通大学神经再生重点实验室,江苏 南通 226001)(3.南通大学公共卫生学院,江苏 南通 226001)
在诸多生物材料中,水凝胶因临床操作简单、组织相容性好等优点,被广泛应用于再生医学领域,如心肌治疗、整形外科、骨修复等[1-3]. 此外,还可以对水凝胶进行物理或化学改性,提高其机械性能、生物降解性能、热敏感性以及药物/细胞承载能力等以满足不同组织器官的修复需求[4-6]. 目前,用于制备水凝胶的材料可分为3类,即合成聚合物、天然聚合物以及脱细胞基质[7]. 其中天然聚合物如胶原、壳聚糖、海藻酸盐、透明质酸等与细胞外基质理化性质极其相似,在生物仿生和细胞融合等性能方面更具优势[8],但也存在机械力学性能差、降解速度快等缺点,限制了其在组织器官修复中的应用.
丝素蛋白(SF)是蚕丝脱胶后提取的纯天然高分子化合物,虽然力学性能下降,但具有较好的组织相容性和低免疫原性,可被加工成纤维、膜以及海绵等,应用于组织器官如神经、血管、骨和皮肤等的修复等[9-10]. SF在有机溶剂、超声、快速涡旋以及改变pH 值的条件下可制备成水凝胶,作为骨充填材料和药物缓释载体等[11-12]. 然而SF水凝胶的某些理化性质如强度和导电性能仍不能满足再生医学领域中的特殊需求. 因此,有针对性地开发临床适用型新型SF水凝胶十分必要.
氧化石墨烯(GO)是石墨烯氧化后的衍生物,含有大量含氧基团,具有较好的水溶性和分散性. 此外,GO比表面积大,结构柔韧,导电性优异,联合制备水凝胶可增加凝胶强度和导电性能[13]. GO经过化学修饰改性,可以与多种天然高分子化合物交联,形成结构特异和功能多样的复合生物材料[14-15]. 氨基化修饰的GO(氨基氧化石墨烯,NGO),在高分子基体中的分散性和界面相互作用等性能更为优异,同时导电性能提高,组织相容性增加,细胞毒性显著降低[16]. 本文采用CaCl2/H2O/C2H5OH三元溶剂体系制备了SF溶液,同时加入氨基化氧化石墨烯,利用京尼平对氨基进行交联制备丝素蛋白/氨基氧化石墨烯(NGO/SF)复合纳米水凝胶. 该水凝胶在力学性能和导电性等方面明显改善,使其在心肌治疗和神经修复等再生医学领域的应用更具备可行性.
1 材料与方法
1.1 丝素蛋白溶液
称取新鲜蚕丝(含丝胶)50 g,将其溶解在2 000 mL Na2CO3水溶液脱丝胶,溶液煮沸30 min,以此重复3次,Millipore纯水充分浸泡洗涤,确保表面无残留,后置于超净台内室温晾干,得到约40 g丝素蛋白样本(SF). 将SF于78 ℃ 溶解在CaCl2/H2O/C2H5OH三元溶剂体系中,直至完全溶解得到黄色透明溶液. 将丝素三元溶液置于纤维素管中,在Millipore水中透析,每4 h一次换水,直至3 d. 透析后即为SF溶液,经滤纸过滤,收集液再浓缩至质量分数10%,置于4 ℃保存.
1.2 水凝胶制备
将2 g京尼平(美伦生物公司)加热溶解于10 mL去离子水中,制备20%京尼平水溶液作为交联剂. NGO(购自先丰纳米公司)直径190~320 nm,溶解于水至终浓度5 mg/mL. 将NGO溶液、SF溶液以一定的体积混合(如表1). 制备的NGO/SF复合纳米水凝胶置于相应孔板或EP管中,37 ℃孵育24 h.
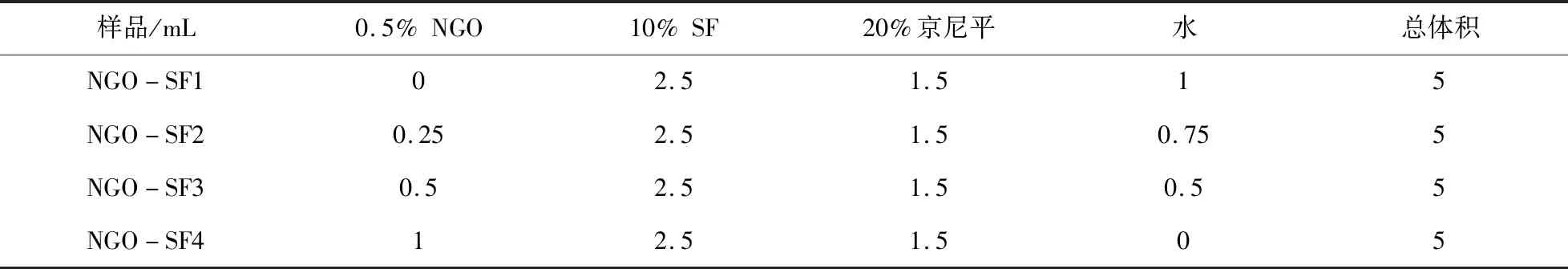
表1 NGO/SF复合纳米水凝胶成份配比Table 1 Proportion of ingredients of NGO/SF polymeric hydrogel
1.3 形态学观察
用相机和光学显微镜观察并记录纳米水凝胶的宏观和微观形态. 制备的水凝胶样品用去离子水浸泡24 h后,选取不同倍数观察检测.
1.4 溶胀率测定
将制备的水凝胶样品进行冷冻干燥约12 h,称得干重Ws. 将干燥水凝胶样品室温条件下浸入0.1 mol/L的PBS溶液(pH 7.4)中24 h,取出用滤纸将样品表面残留液体吸干再称重,记为Wd. 每组设置3个平行样. 溶胀比(SR)计算公式如下:SR=(Wd-Ws)/Ws×100%.
1.5 降解性能测试
NGO/SF复合纳米水凝胶制备成膜状,裁切成等同大小,分别置于离心管中,并精确称量每个样本初始重量W0. 于离心管中加入5 mL的 0.1 mol/L PBS(pH 7.4)溶液(或蛋白酶溶液),置于 37 ℃恒温振荡器中,每天换液. 不同时间点取出离心管,4 000 rpm 的转速离心 10 min,弃去上清液加入三蒸水再次洗涤离心,重复3次. 将离心管置于真空干燥箱18 h,待水分完全蒸发后再次称量记录为W1. NGO/SF复合纳米水凝胶降解率根据下列公式计算:
Degradation%=(W0-W1)/W0×100%.
1.6 力学性能
使用电子万能试验机(拓丰仪器科技有限公司,TFW-5s)测量水凝胶的抗压机械性能. 将水凝胶溶液注入模具制备成直径为20 mm 的圆盘状,厚度5 mm. 将试验机设定为压缩模式,将样品放置于基座,以 5 mm/min 的位移速率测定其在压缩测试下的应力-应变曲线,直至样品破裂. 设置5个平行样,根据压缩测试的应力-应变曲线统计最大应力、最大位移.
1.7 电导率测试
使用FT-341四探针仪(宁波瑞柯仪器有限公司)测量NGO/SF复合水凝胶的电导率性能. 将水凝胶溶液注入模具,制备成直径10 mm的圆形胶,厚度为2 mm. 真空干燥箱中干燥后取出,置于4根排成直线的探针下,设置测量温度25 ℃,检测薄片的电导率.
1.8 循环伏安分析
采用三电极体系(上海辰华CHI660D)在NGO/SF复合纳米水凝胶成胶前进行电化学测试. 铂丝电极为对电极,饱和铁氰化钾电极为参比电极,复合材料修饰的玻碳电极为工作电极. 每个样品取10微升滴于玻碳电极表面,自然晾干.
玻碳电极预处理:将玻碳电极用三氧化二铝抛光成镜面. 电极分别在无水乙醇和二次蒸馏水中超声清洗,使用前在氮气流中干燥以消除吸附在电极表面的物质.
1.9 静电性能
利用织物感应式静电测试仪(温州市大荣纺织仪器YG(B)342D),采用定压法对NGO/SF复合纳米水凝胶的静电性能进行测试. 选择高压10 kV,倍率0.5. 将制备试样夹紧,待电机转速稳定(1 500 r/min)后,按下高压放电按钮放电,30 s后停止放电. 记录加压30 s的峰值即峰值电压. 加压停止时,衰减时间计时器开始计时,静电释放,静电电压值减少,当达到峰值*所设倍率时,静电电压锁定,此为半衰期电压. 记录显示的衰减时间,此为半衰期.
2 结果与讨论
2.1 NGO/SF复合水凝胶的颜色变化
水凝胶中通过添加各种化学示踪剂如O2敏感型的苯并卟啉等,便于实时观察组织器官的修复效果[17]. 对制备的NGO/SF复合水凝胶外观检测发现,该水凝胶呈蓝色. 随着NGO含量的增高,复合纳米水凝胶的颜色从浅蓝色(近绿色)变至深蓝色(近黑色)(图1). 由此可见,京尼平与氨基石墨烯的氨基以及丝素蛋白的氨基反应,生成栀子蓝色的新型复合材料. 该新型水凝胶的颜色改变,不但避免添加其它化学染料给机体带来的潜在副作用,而且有利于其在组织器官修复后的形态、位置和效果示踪,提高原位修复的精准性. 如原位注射水凝胶治疗心肌梗死,通过水凝胶颜色即可判断水凝胶在心室壁中的位置以及降解情况等[3].

图1 NGO/SF复合水凝胶的光学照片图Fig.1 Photograph of the NGO/SF polymeric hydrogel
2.2 NGO/SF复合水凝胶的溶胀性分析
不同组织器官的缺损修复,对复合材料的溶胀性能具有不同的技术要求. 对添加不同含量NGO的 4种复合水凝胶进行溶胀性分析,结果发现,随着NGO浓度的增加,复合水凝胶的溶胀性减小(图2). 不添加NGO的水凝胶(NGO-SF1)平衡溶胀比高达451.4%,显著高于NGO-SF2(253.9%)、NGO-SF3(190.8%)和NGO-SF4(159.8%). 因此NGO/SF复合水凝胶中NGO含量与溶胀性呈负相关. 该结果为临床选用特定溶胀性能的SF水凝胶提供了参考.
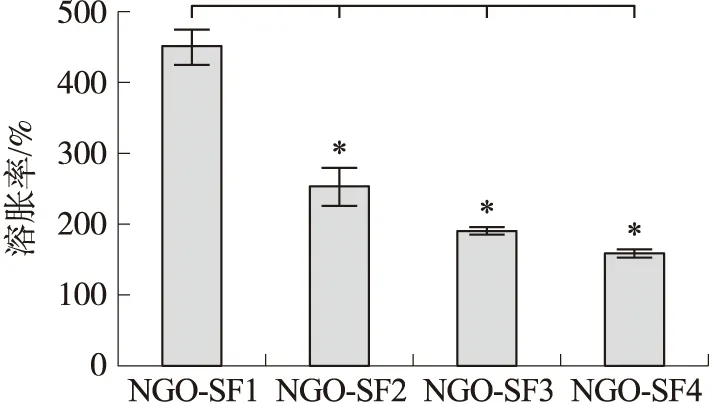
图2 不同NGO含量的NGO/SF复合水凝胶溶胀性检测Fig.2 Water absorption measurement of the NGO/SF polymeric hydrogels containing different concentration of NGO
2.3 水凝胶的稳定性分析
在神经、软骨和骨等组织工程中,要求水凝胶等作为支架基材的生物材料具备一定的稳定性. 将制备的NGO/SF复合水凝胶置于0.1 mol/L的PBS(pH 7.4)溶液中进行稳定性分析. 检测结果显示,不同时间点NGO-SF1的降解率小于5%,表明SF水凝胶本身稳定性较好. NGO-SF1降解率显著高于NGO-SF2、NGO-SF3和NGO-SF4(图3),表明NGO能够提高复合水凝胶的稳定性.

图3 不同NGO含量的NGO/SF复合水凝胶在PBS溶液中降解率的检测Fig.3 Degradation assay of the NGO/SF polymeric hydrogels in PBS solution
2.4 复合水凝胶抗压力学性能测试
水凝胶普遍力学强度较低,结构易损,制约了其作为组织工程材料应用于骨、软骨、心脏和血管等组织器官的修复. 为了检测NGO对复合水凝胶力学性能的影响,对4组样品进行了抗压力学性能分析. 应力-应变曲线数据表明,增加NGO含量可以显著提高NGO/SF复合水凝胶的抗压强度,且呈现正相关(图4). 结果提示,NGO能够提高复合水凝胶抗压力学性能.
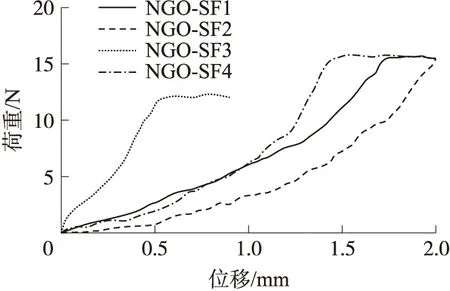
图4 NGO/SF复合水凝胶的抗压应力-应变曲线Fig.4 Compressive stress-strain curve of the NGO/SF polymeric hydrogels
2.5 复合材料的电导率检测
复合水凝胶的导电性能与指导组织细胞的迁移、分化和生长等密切相关. 传统导电水凝胶是在水凝胶中引入聚苯胺、聚吡咯以及聚噻吩等高分子材料,同时也增加了复合材料的毒性和易聚积性. 诸多文献表明,GO能够提高复合材料的电导率. 为了了解NGO对NGO/SF复合水凝胶电导率的影响,实验检测了不同NGO含量的4种复合水凝胶的电导率. 结果可以看出,不含NGO的水凝胶电导率为0.007 7 ms·cm-1. 随着NGO含量的增加,NGO/SF复合水凝胶电导率显著上升,且呈现正相关(图5),提示NGO有助于提高复合材料的电导率.

图5 不同NGO含量的NGO/SF复合水凝胶电导率的检测Fig.5 Conductivity measurement of the NGO/SF polymeric hydrogels
2.6 循环伏安曲线
循环伏安行为是衡量材料储能性能的一项重要指标. 为了评价NGO/SF复合水凝胶电荷储存能力,对该水凝胶进行了循环伏安测试,并记录电流-电势曲线. 结果可以看出,随着NGO含量的增加,水凝胶样品的循环伏安曲线越来越接近四角长方形,表明其导电性能逐渐增强(图6).
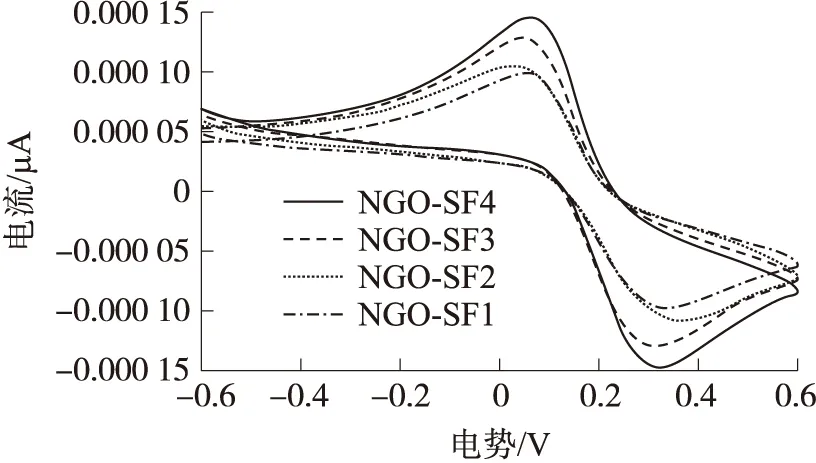
图6 不同NGO含量的NGO/SF复合水凝胶循环伏安曲线Fig.6 Cyclic voltammetry curve of the NGO/SF polymeric hydrogels
2.7 静电性能
实验采用定压法检测了NGO/SF复合水凝胶的3个静电性能指标,包括峰值电压、终点电压和衰减周期. 随着复合水凝胶中NGO含量的增加,材料峰值电压显著上升,表明累积电荷明显增加;衰减周期也相应延长,提示复合纳米水凝胶表面的电荷比较稳定,不易造成逃逸,易累积形成静电(表2).
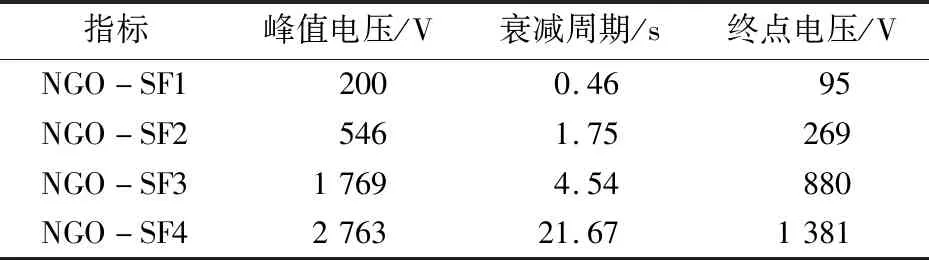
表2 NGO/SF复合水凝胶的3个静电性能指标Table 2 Electrostatic performance of the NGO/SF polymeric hydrogels
综上所述,NGO/SF复合水凝胶除了因化学交联生成蓝色外,在稳定性、力学性能以及导电性能等方面均有显著提高,且溶胀性降低. 这些理化性质的优化,使得NGO/SF复合水凝胶作为新型生物材料在皮肤、神经、血管、心肌、软骨和骨修复等再生医学领域极具应用前景. 同时,在3D组织和器官构建、肿瘤原位化疗等方面也具有潜在的应用价值. 虽然不少研究对GO的细胞和生理毒性仍存有争议,但如果在GO上交联羧基、氨基等基团或者丝素等,功能化的GO几乎没有毒性,并具有良好的生物相容性[18]. 因此,NGO/SF复合水凝胶是一种新型安全的生物材料.
3 结论
(1)本实验在丝素蛋白溶液中添加了不同含量的NGO,通过京尼平交联,合成制备了NGO/SF复合水凝胶. 该水凝胶呈蓝色,且随着水凝胶中NGO浓度的增加颜色逐渐加深. 因此,该技术制备的水凝胶有利于其在组织器官修复中的效果示踪.
(2)制备的NGO/SF复合水凝胶吸水率小,且具有较好的稳定性. 随着NGO的添加,NGO/SF复合水凝胶吸水率逐渐降低,稳定性增强.
(3)抗压力学性能检测表明,NGO有利于提高SF水凝胶的抗压强度(弹性). 据分析,添加NGO后的水凝胶抗压力学性能提高超过1.6倍(NGO-SF2 vs NGO-SF1). SF水凝胶力学性能的提高,将大大提高水凝胶的临床修复效果和使用寿命.
(4)通过对添加NGO复合材料的电导率、循环伏安和静电性能的检测表明,NGO有利于改善SF水凝胶的导电性以及储电性能. 在神经组织以及心肌修复中,生物材料导电性能的提高,有助于组织器官的功能恢复. NGO-SF复合水凝胶的开发,将进一步提高其在临床使用中的修复效果.

