黄粉虫粪有机肥对冷水花生长的影响*
唐 宇, 曹亚军, 欧庆宇, 张昌义, 刘国军, 熊晓莉
(1.重庆工商大学 环境与资源学院, 重庆 400067; 2.张家港兴茂昆虫生物科技有限公司, 江苏 张家港 215000; 3.成都优耕生态农业科技有限公司, 成都 610000; 4.成都正本源生化科技有限公司, 成都 610502; 5.成都市四友生物科技有限公司, 成都 610000)
0 引 言
黄粉虫粪作为一种优质的有机肥原料,含有丰富的营养物质,见表1。经检测,黄粉虫粪有机物含量77.68%~81.15%、全氮3.970%、全磷 1.860%和全钾2.660%,且富含锌、硼、铁、镁、钙、铜等多种微量元素,可用于农业施用与家庭种植[1-2]。不仅养分优于现有的禽畜粪便,也避免了禽畜粪便堆肥存在的氨气缺失、处理时间较长等问题[3]。黄粉虫粪有机肥(TMF)肥效稳定且持久,有提高土壤的活性的效用;也可以将虫粪沙与农家肥、化肥混合施用,具有改性和促进肥效的功能;同时,也可以调节土壤的微生态平衡并且能够起到良好的保水作用[4-5]。王久兴等[6]的研究表明:TMF对黄瓜壮苗有积极的作用,并且能显著提高幼苗的各项指标。武帅[7]等研究了TMF对花卉的生长及品质的影响,表明TMF能显著提高万寿菊的花朵质量、延长花期和减少倒伏。从以上文献可以看出TMF对蔬菜和花卉的生长均起到正面作用,但文献的评价指标仅从简单指标、相对指标、复合指标对植物生长进行考察,如叶长、叶宽、茎高、侧枝数等,未对植物生长过程中的理化指标进行深入的研究。
以冷水花为例,考察TMF对其生长的影响。测试叶片中的N、P、K、叶绿素、含水率、过氧化物酶活性和株高的变化,以考察TMF对冷水花的生长影响及最佳用量。
1 材料与方法
1.1 试验材料
TMF(张家港兴茂昆虫生物科技有限公司),其营养成分见表1;冷水花(成都优耕生态农业科技有限公司)。其他试剂为分析纯,市购。

表1 黄粉虫粪发酵有机肥的营养成分表Table 1 Nutrient composition of tenebrio molitor fermentation organic fertilizer
1.2 试验仪器
全自动凯氏定氮仪(K1100F,济南海能仪器股份有限公司)、石墨消解仪(SH420F,济南海能仪器股份有限公司)、紫外分光光度计(UV1102,上海天美科技教学仪器有限公司)和火焰光度计(FP6432,上海仪电分析仪器有限公司)。
1.3 试验设计
将TMF与土壤分别按质量比0、3%、6%、9%、12%(T1、T2、T3、T4、T5)混合作为冷水花的培养基质,每组培育45盆,共计225盆,其中T1为对照组。在试验过程中,每隔12 d对冷水花进行一次取样,测量其在48 d培育过程中,冷水花叶片中的N、P、K、叶绿素、含水率、过氧化物酶活性、株高的变化。测量值取其测量的平均值。
1.4 测定项目及方法
1.4.1 总N的测定
采用凯氏定氮法进行总氮的测定。称取新鲜叶片0.2 g,剪碎,放入消煮管中,再加入0.2 g的催化剂和20 m浓硫酸,同时做一组空白对照。使用消解仪在320 ℃下消解90 min。冷却至室温后,放入全自动凯氏定氮仪,设置相应的参数,进行测定。所得结果乘以系数6.25,即得到粗蛋白含量。
1.4.2 总P的测定
采用钼酸氨分光光度法进行总磷的测定。
(1) 消煮。准确称取新鲜剪碎的叶片0.5 g,放入凯氏瓶,同时加入浓硫酸5 mL,摇匀,过夜。使用电炉小火加热,等浓硫酸冒白烟后,再升温,直到溶液呈均匀的棕黑色时停止加热,冷却后加入6滴过氧化氢,消煮10 min,冷却后再次加入过氧化氢,重复数次,消煮到溶液无色为止,冷却后定容至100 mL。
(2) 标准曲线的绘制。取数只50 mL的具塞比色管,分别加入0、1.5、2.5、5、10、15、20 mL的磷酸盐溶液,用蒸馏水稀释到50 mL。向比色管中滴入2~3滴的2,4二硝基酚指示剂,用6 mol/L氢氧化钠溶液和0.5 mol/L硫酸溶液调节pH到溶液刚好呈微黄色为止,再加入1 mL抗坏血酸溶液,混匀。30 s后加入2.0 mL钼酸盐溶液,摇匀,静置15 min。配制的标准溶液的含P量分别为0、2.5、5、10、20和25 μg。用30 mm比色皿于700 nm的波长处,分别测定其吸光度,用于绘制标曲。
(3) 样品的测定。准确吸取澄清的消煮液5 mL,放入50 mL的容量瓶中,再滴入2~3滴二硝基酚指示剂,用6 mol/L氢氧化钠溶液滴至刚好呈现黄色,再加入1滴硫酸溶液,使溶液的黄色消失,最后加入5 mL钼锑抗显色剂,摇匀,定容。在室温超过15 ℃的温度下静置30 min,于波长700 nm处测定其吸光度。总P含量(fP)的计算公式如下:
1.4.3 总钾的测定
采用火焰光度法进行总钾的测定。
(1) 消煮。具体操作步骤同1.3.2中(1)。
(2) 标准曲线的绘制。准确吸取含K量为100 mg/L的标准溶液10 mL于100 mL容量瓶中,用蒸馏水稀释定容。准确吸取0、2.5、5.0、7.5、10 mL的10 mg/L钾标准溶液于50 mL比色管中,同时加入与吸取体积相同的空白溶液,用蒸馏水稀释定容。在火焰光度计上,以空白溶液作零点,测定其吸光度,用于绘制标曲。
(3) 样品的测定。移取5 mL的样品溶液于50 mL比色管中,用蒸馏水稀释定容。按照(2)的方法测定吸光度,并从标准曲线上读出对应的浓度。总K的含量(fK)计算公式如下:
1.4.4 叶绿素的测定
采用分光光度法进行叶绿素含量的测定。
(1) 叶绿素的提取。称取新鲜叶片0.3 g,剪碎放入研钵,加入少量的石英砂和碳酸钙粉,再加入2~3 mL 95%乙醇,研磨成匀浆,最后再加入10 mL乙醇,继续研磨直至叶片变白。过滤,冲洗,直至滤纸和残渣看不到绿色,最后用95%乙醇定容至25 mL,摇匀。
(2) 吸光度的测定。用95%乙醇作为空白,分别在665 nm、649 nm和470 nm下测定提取液的吸光度。叶绿素的计算公式如下:
Ca=13.95A666-6.88A649
Cb=24.96A649-7.32A666
CT=Ca-Cb
其中:Ca、Cb分别是叶绿素a、b的浓度,mg/g;A665、A649分别是在665 nm、649 nm波长时,叶绿素色素提取液的吸光度,L/(g·cm);CT为叶绿素总浓度mg/g;C为叶绿素含量mg/g。
1.4.5 含水率的测定
采用干重法测定含水率。
取新鲜的待测叶片,洗净,剪碎,称重,得到叶片的鲜重Wf。再用蒸馏水浸泡叶片,将烧杯和浸泡的叶片放入真空干燥箱中,向真空抽滤泵中注满水,抽滤30 min,使叶片吸水达饱和状态。将叶片表面水分吸干后称重,再用蒸馏水浸泡,抽滤30 min,直至称重的质量相等为止,就得到叶片吸水达到饱和时的质量,记为饱和鲜重Wt。最后将其放入烘箱,105 ℃干燥4~6 h。取出,冷却至室温后,将叶片称重,得到叶片干样品的总质量Wd。相对含水率的计算公式如下:

其中:Wf、Wd、Wt分别为叶片鲜重、叶片干样品的总质量以及饱和鲜重(mg)。
1.4.6 过氧化物酶活性的测定
采用比色法测定过氧化氢酶[8]。
(1) 酶液的制备。称取新鲜叶片1 g,剪碎放入研钵中,加入适量的磷酸缓冲溶液,研磨成匀浆,倒入离心管中,用4 000 r/min的转速离心15 min,提取上清液到容量瓶,向残渣中加入5 mL的磷酸缓冲溶液,再次提取上清液,用磷酸缓冲溶液定容。
(2) 活性的测定。向第一个比色杯中分别加入反应混合液、磷酸缓冲溶液3 mL和1 mL,用作对照,向第二个比色杯中分别加入反应混合液、上述酶液3 mL和1 mL,立即开始计时,在波长470 nm下用分光光度计测定其吸光度,每隔1 min记录一次。过氧化氢酶活性的计算公式如下:
其中:ΔA470为反应时间内的吸光度的变化,L/(g·cm);W为叶片重(g);Vt为提取酶液的总体积(mL);Vs为测定时取用酶液的体积(mL);t为反应时间(min)。
2 结果与讨论
2.1 对冷水花叶片N含量的影响
由图1可知,不同处理下的冷水花叶片中含N量是呈现一种缓慢增长的趋势。T1最高含氮量为2.59%,增长率是61.83%,T4含N量最高,增长率为106.96%,T5、T3、T2次之。可知,TMF的施用,给冷水花提供大量的氮元素,使其叶片氮含量明显增加。但T5处理下的氮含量增长却低于T4,表明过多的施用TMF,不利于冷水花的氮吸收量。因此,从含N量来说,TMF最佳基质配比为9%。
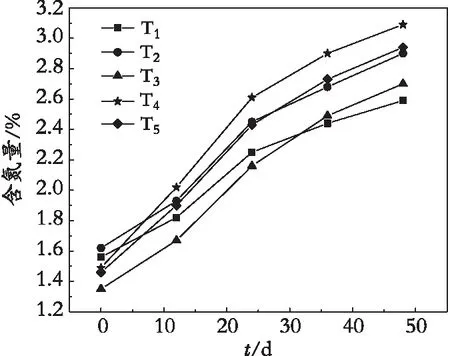
图1 冷水花含N量的变化Fig. 1 Change of nitrogen content in Pilea notata C. H. Wrigh
2.2 对冷水花叶片P含量的影响
由表2可知,不同实验组下,冷水花的P含量在整个实验周期在±1%范围内浮动。众所周知,植物体内P的主要作用是抗寒、促进果实的发育和提前成熟。而在实验期间,冷水花并未开花结果,同时,试验所处地区温度较高,所以冷水花吸P量较低,其叶片中总P的含量变化微乎其微[9]。

表2 冷水花含P量的变化/%Table 2 Change of phosphorus content in Pilea notata C. H. Wrigh/%
2.3 对冷水花叶片K含量的影响
由图2可知,T1、T2、T3实验下,叶片含K量,在整个实验周期过程中变化不大,但T4、T5组变化较为明显,均呈先增后减的趋势,其中,T4组的K含量的增长率最大。总体来说,与T1对比,TMF的施用对冷水花的K含量的增长,起到了正面的作用。
同时,冷水花在第24 d后,含钾量会出现下降现象,分析其中原因可能为:在该时段后,试验所处地区气温升高,会影响植物吸收钾离子的通道开放,从而影响其吸收,而导致消耗的钾离子高于吸收的钾离子,造成了其后期下降的现象[10-12]。

图2 冷水花钾含量的变化Fig. 2 Changes of potassium content in Pilea notata C. H. Wrigh
2.4 对冷水花叶绿素含量的影响
由图3可知,冷水花的叶绿素总量,在所有实验组下,呈现明显先升高再小幅下降的变化趋势,且在T4处理下,叶绿素含量达到最高2.65 mg/L,增长率为59.47%,之后依次为T5、T3、T2。叶绿素的合成受诸多条件的影响,其中也受植物中含氮量的影响。由此可知,TMF的施用可较大程度的增加冷水花体内的氮含量,从而可进一步促进叶绿素的合成。所以,TMF的施用可明显促进植物内的叶绿素的合成。
同时,冷水花在24 d后,叶绿素会出现下降现象,分析其中原因可能为,一是栽培的基质营养被消耗完毕,没有足够的营养提供冷水花叶绿素的合成;二是由于温度升温过高时,植物体内与光合作用相关的酶的活性会有所下降,从而影响叶绿素的合成;三是当植物受到逆境的胁迫时,会影响叶绿素的吸收,植物的光合作用也受到影响,进而导致叶绿素的含量更低[14]。
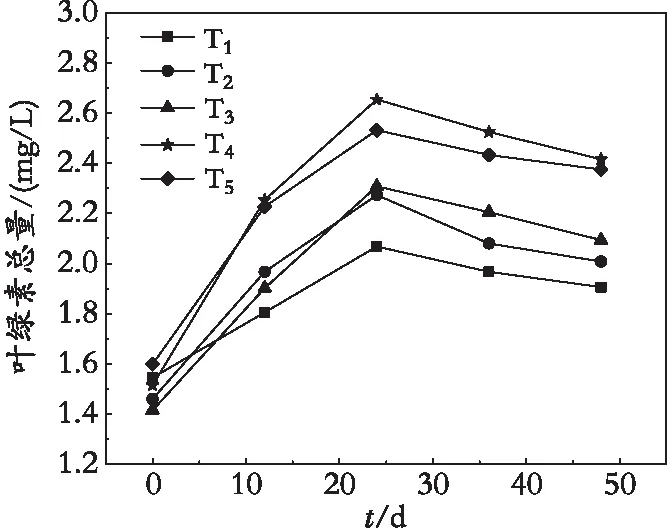
图3 冷水花叶绿素总量的变化Fig. 3 Changes of the total chlorophyll content in Pilea notata C. H. Wrigh
2.5 对冷水花含水率的影响
由图4可知,冷水花叶片的相对含水率,除T1处理外,均呈单峰曲线变化,同时在T4处理下的含水率最高达到91.03%,增长率为5.60%,到T5处理次之。相较于T1处理下的含水率呈负增长,其他处理的增长率均为正值,故TMF对植物的吸水能力与叶片的保水能力具有促进作用。
在第24 d后,含水率几乎达到了最大值,而后开始下降,分析其中原因可能是,在此时段后,试验所在地区进入迅速升温的阶段,空气的温度较高,湿度迅速降低,水蒸发快,冷水花吸收水量变少,叶片的相对含水量出现下降的现象。

图4 冷水花叶片含水率的变化Fig. 4 Changes of moisture content in Pilea notata C. H. Wrigh leaves
2.6 对冷水花过氧化氢酶活性的影响
过氧化物酶(POD)是一种在植物内普遍存在、具有较高活性的酶,可反应植物内在某一时期代谢的变化。由图5可知,冷水花POD的总体趋势是呈现单峰变化的。在T4处理下,POD最高达到1.3ΔA470/(g·min),增长率为75%,且为最高,T5、T2、T3次之。相较于对照组的增长率13.89%,施用TMF能够提高过氧化氢酶的活性,可促进冷水花体内的新陈代谢。
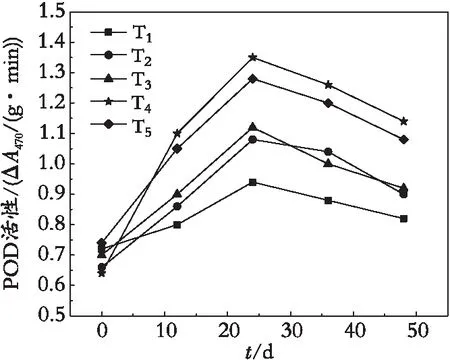
图5 冷水花POD活性的变化Fig. 5 Changes of POD activity in Pilea notata C. H. Wrigh
在第24 d后,出现比较明显的下降趋势,分析其中原因:POD活性与呼吸作用、光合作用以及生长素的氧化均有关系,同时会随着温度的升高,呈先上升后下降的趋势。由于该时段后,试验地区气温的升高,使原本适合冷水花生长的环境变成一种逆境,体内旺盛的生命活动受到影响,导致其进入一种低度休眠的状态,用以抵制逆境带来的影响,致使POD活性的降低。
2.7 对冷水花株高的影响
由图6可知,冷水花的株高在所有处理下,均呈增长的趋势。在T4处理下,株高长势最好,最高达到25.22 cm,总增长率为30%,其次为T5组,增长率为25.20%。相反,T1组的增高率是最低的,仅为10.29%。由此可知,TMF的施用对冷水花的增长有正面效果,且对抗逆境作用有增强的效果。
T5组效果比T4组差,随着TMF施用量的增加,对株高产生正面效应,但是超过一定范围,冷水花的增长会减缓,甚至呈现出下降的趋势。因为冷水花对营养元素吸收有限,过多施用反而会对植物生长产生负面影响。

图6 冷水花株高的变化Fig. 6 Changes of the height of Pilea notata C. H. Wrigh
3 结 论
TMF的施用对冷水花生长过程均起促进作用,在含N量、含K量、叶绿素、含水率、过氧化氢酶活性、株高均有明显的提升。尤其在T4组的配比下,冷水花叶片的含N量增长率为106.96%;叶绿素的增长率达59.47%,是T1组的3倍;过氧化氢酶活性增长率高达75%,是T1组的5倍以上;株高增长率,最高可达30%。综合各指标来看,TMF施用对冷水花则生长有较大的正面效应,且在培养基质中存在最佳配比,当TMF占培养基质的9%时,效果最佳。同时,理化指标间也相互影响。黄粉虫粪富含N、P、K及其他微量元素,其中,N含量可以促进叶绿素的合成,与K含量均可影响植物光合作用;P含量可影响植物的新陈代谢作用,故植物中N、P、K含量的升高,可以促进植物根系的发育、植物的生长,激发过氧化氢酶的活性,同时也促进了株高的增长。

