经颅电刺激在啮齿动物中的研究进展*
宋美慧, 王玉梅, 周 正, 褚光辉, 付 玉
(昆明理工大学医学院,云南昆明 650000)
经颅电刺激(transcranial electrical stimulation,tES)是一种通过在头皮上施加微弱电流来改变大脑功能的神经调节工具。该方法在上世纪80 年代被提出,随着社会老龄化和神经系统疾病发病率的日益增长,该方法由于其无创、副作用小、成本低、易操作等优势,近年来逐渐受到重视[1]。目前tES 已应用于改善认知功能和运动功能障碍,以及治疗包括阿尔茨海默病(Alzheimer disease,AD)和帕金森病(Parkinson disease,PD)在内的神经退行性疾病。
tES 的装置因简单,主要包括刺激仪和电极。tES 依据刺激电流主要分为经颅直流电流刺激(transcranial direct current stimulation,tDCS)和经颅交流电流刺激(transcranial alternating current stimulation,tACS)两种,依据刺激电极极性tDCS 又分为阳极tDCS(anodal tDCS,atDCS)和 阴 极tDCS(cathodal tDCS,ctDCS)。tACS 则主要提供特定频率的正弦交流电刺激,伪刺激在tDCS 和tACS 中作为对照使用。刺激电极的选材也十分简单,如生理盐水浸泡的海绵、导电凝胶等,不仅可以减少刺激部位与电极接触的不良反应,还可以避免如tDCS 中的电极极化等问题。此外,根据刺激方案不同,tES 刺激电极可置于头皮的任一位置,其对电极在啮齿动物中通常置于胸腹部(图1A)。刺激状态通常可分为自由活动状态和束缚状态(图1B)。
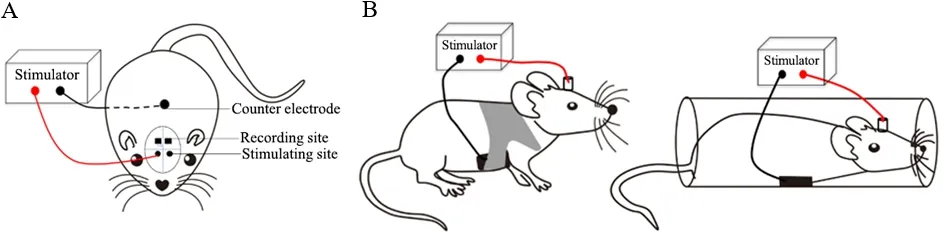
Figure 1. Schematic diagram of tES in rodents. A:the set-up of tES in rodents;B:tES for freely moving rodents(left)and restrained rodents(right). During freely moving state,animals can move freely in an experimental apparatus,such as in a cage. tES includes two electrodes:active electrode and counter electrode. The active electrode is positioned over the skull,and the counter electrode is usually applied over the ventral thorax. The active electrode consists of a plastic tube filling with saline solution just prior to stimulation. The counter electrode can be an adhesive conductive gel,and can be fixed by a custom corset to ensure its stability. The wires from the counter electrode to the tES stimulator can also be fixed in the corset. The size of the active electrode is specified by the diameter of the tube,and that of the counter electrode is specified by the size of the conductive gel(refer to“A fixation device for nerve stimulation in mice",patent No. 201921895884.6). There is no custom corset for the restrained animals during tES,and the counter electrode can be directly connected to the stimulator.Animals are placed in a plastic container with their heads and the above active electrodes outside,and with their noses and mouths located in a curved semicircle ring for avoiding moving. The plastic container can be fixed by several rubber bands during tES(refer to“A fixation device in mice",patent No. 201710120994.4).图1 啮齿动物tES示意图
在生物医学研究领域中,啮齿动物模型是最常用、最有利的工具之一。啮齿动物具有遗传背景清晰、方便饲养和繁殖等优势,尤其在制备各种疾病或某种症状的模型方面较为理想,如早衰小鼠模型、AD 小鼠模型等。在啮齿动物中进行tES研究具有很多优势,不仅便于操作,还可以精确地了解神经元所承受的电流强度和方向,尤其是对于一些非常规且风险较高的刺激方案[2]。简言之,啮齿动物模型为探索tES增强脑功能的研究提供了诸多便利,已成为临床应用前的“试验场”。本文总结了近年来tES 在啮齿动物上的研究进展,重点阐述了其作用效果以及相关机制。
1 tES的功能研究
目前,tES 的功能研究中,tDCS 一直备受关注。tDCS 在啮齿动物模型中主要用于缓解神经系统疾病,还可用于改善认知功能,增强运动能力。而tACS的功能研究在啮齿动物上几乎没有。临床研究报道tACS 可以调节听力、运动、认知和记忆功能等,而啮齿动物研究则侧重于阐述tACS可能的作用机制。
1.1 tDCS 在神经系统疾病中的作用 tDCS 在AD、PD、中风、抑郁、癫痫、谵妄等多种类型的神经系统疾病模型中对其病理症状均有缓解作用。(1)就AD 而言,tDCS 可以改善AD 大鼠和小鼠的认知功能[3-4],单次和重复多次的tDCS 均可改善其空间学习和记忆能力,并且这种改善作用可维持长达2个月[5]。(2)就PD 而言,tDCS 可暂时改善PD 啮齿动物模型的运动行为[6-7],增加PD 小鼠多巴胺含量,通过调节自噬来缓解1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine,MPTP)引起的PD症状[8],并且具有神经保护作用[9]。(3)tDCS还可缓解中风。有研究表明ctDCS 在中风的急性期发挥神经保护作用[10]。tDCS调节小鼠的神经发生并激活小胶质细胞,表明tDCS 可促进中风后功能的恢复[11]。(4)tDCS 还具有显著的抗抑郁作用[12]。tDCS 具有持久(3 周)的抗抑郁作用,同时不会影响动物的运动功能,也不会使动物产生焦虑样行为,但其作用效果依赖于刺激参数的设置[13-15]。有研究者认为tDCS 有望成为重度抑郁症的一种极其有效的干预措施[16]。(5)tDCS 还具有抗癫痫作用。tDCS 能有效治疗癫痫发作,并且可以对癫痫的发作产生短期和长期抑制作用;同时确定100 μA 是癫痫发作和其他行为障碍的tDCS 使用最低阈值[17]。(6)tDCS 还能够使啮齿动物从谵妄中快速恢复,特别在右侧额叶区域中tDCS 的应用受到越来越多研究者的关注,表明它可能具有预防或快速治疗谵妄的潜力[18]。相关文献的数据总结见表1。
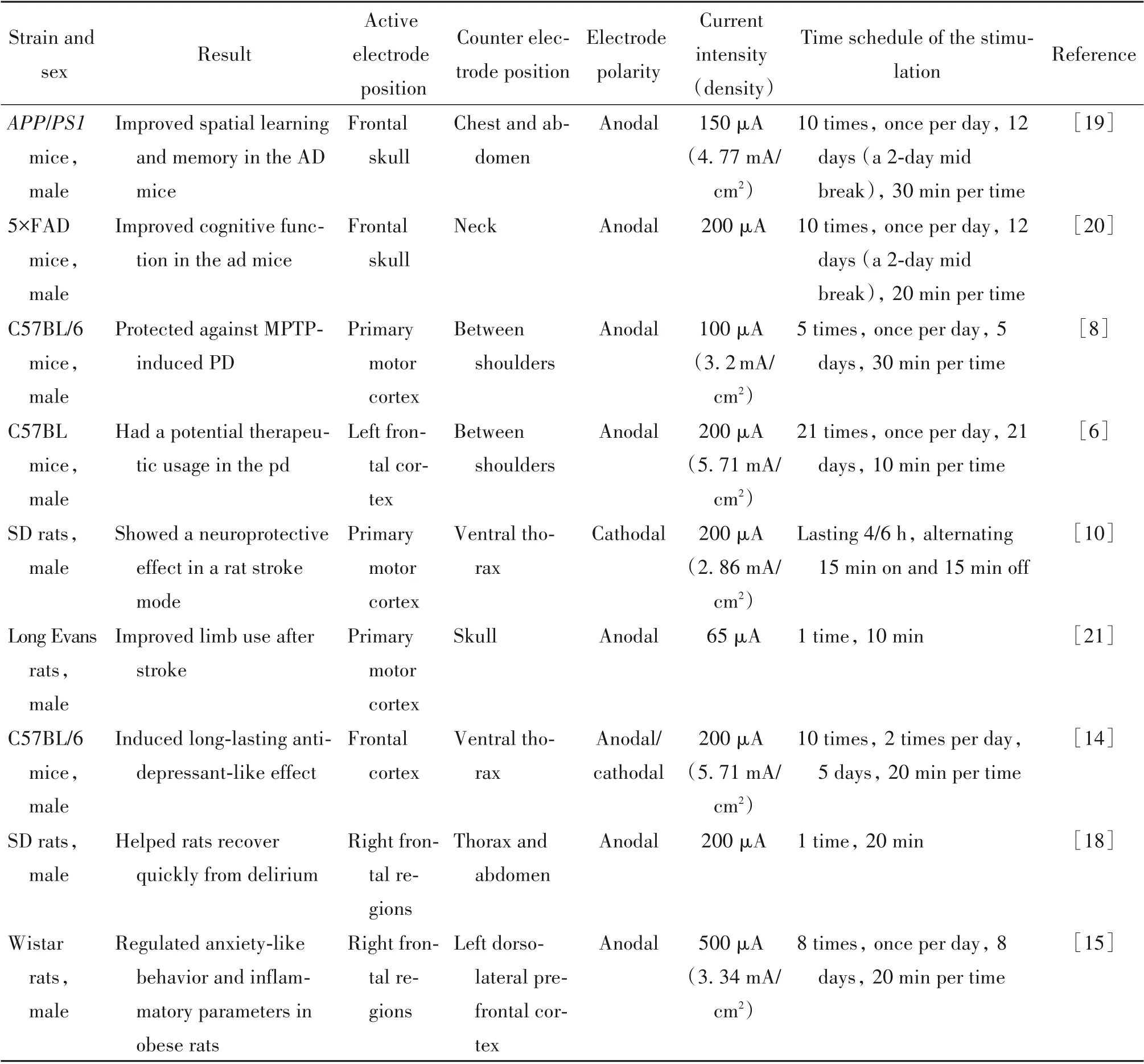
表1 tDCS在啮齿动物神经系统疾病中的作用Table 1. Effect of tDCS on nervous system diseases in rodents
1.2 tDCS 对认知功能的作用 (1)tDCS 可改善小鼠的认知功能。有研究表明,重复多次的atDCS 可以改善空间记忆和工作记忆,而不影响运动和焦虑等行为,并且tDCS 对小鼠工作记忆的改善在4 周后仍然存在[22]。还有研究发现,tDCS除了可以逆转AD转基因小鼠的认知障碍,还可以改善正常小鼠的认知能力[3]。atDCS 在AD 的早期也可改善空间学习和记忆,减轻Aβ 沉积并对神经元具有保护作用[19]。此外,atDCS可增加小鼠脑中微血管流动和组织的氧合指数,这有助于改善神经系统的认知功能[23]。(2)tDCS也能改善大鼠的认知功能[5]。tDCS可以提高大鼠的记忆能力,有效缓解其认知障碍[19]。已有研究证明atDCS 对大鼠空间记忆的提高具有长期效果[24]。对于AD 大鼠进行单次和重复多次的tDCS 不仅能改善空间学习和记忆[4],而且具有明显的神经保护作用[5]。此外,Leffa 等[25]也证明tDCS 能有效治疗大鼠颅脑外伤后的注意力障碍。相关文献的数据总结见表2。
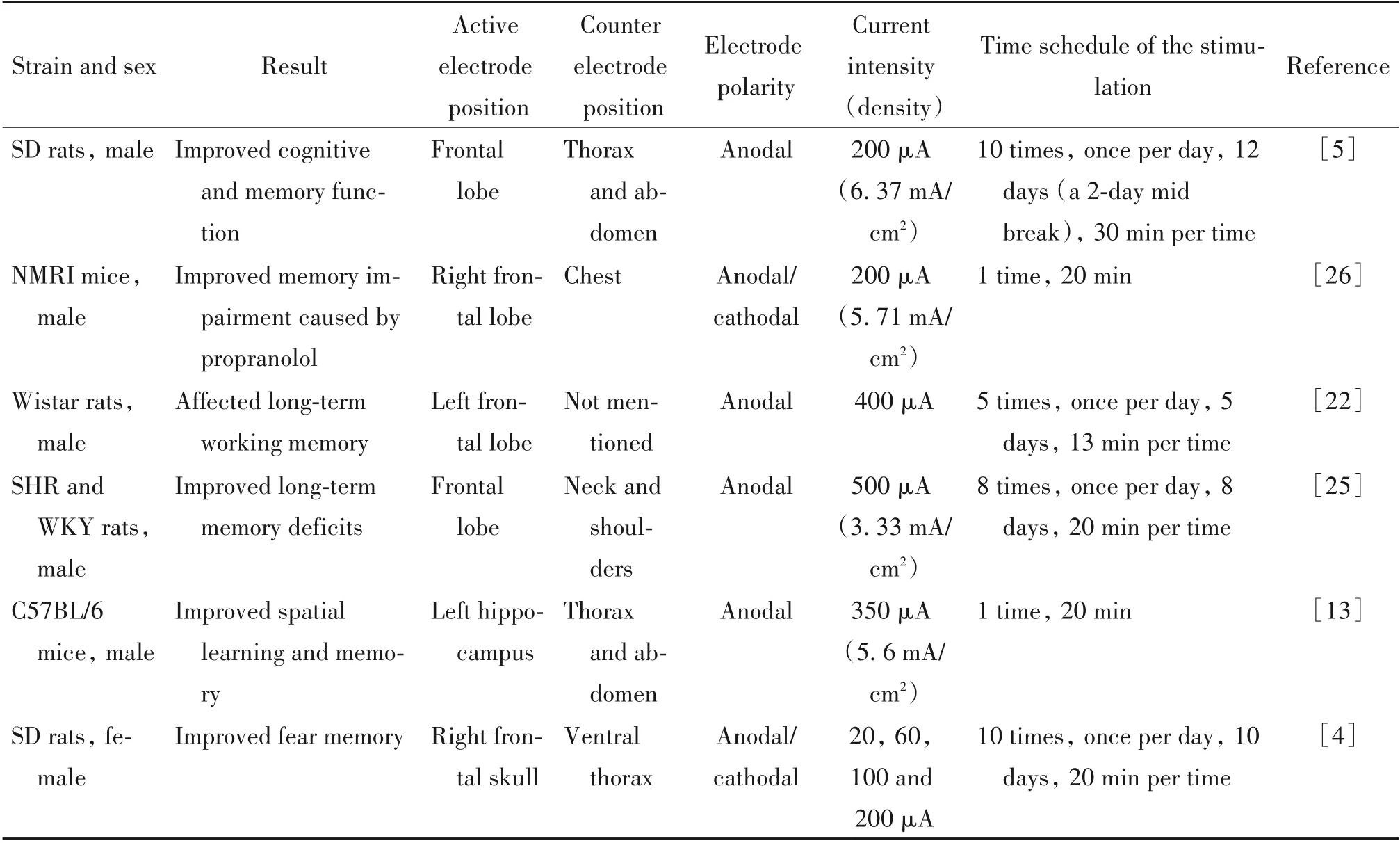
表2 tDCS对啮齿动物认知功能的作用Table 2. Effect of tDCS on cognitive function of rodents
1.3 tDCS 对运动功能的作用 tDCS 对运动功能的影响在临床上研究较多,在啮齿动物上研究较少。啮齿动物上的研究主要偏向于tDCS 影响运动功能的机制,如对皮层兴奋性的影响,相关脑区主要为运动皮层,如初级运动皮层(primary motor cortex,M1)和次级运动皮层(secondary motor cortex,M2)。M1区与运动执行、运动技巧记忆的形成和巩固相关。研究发现,atDCS能够增强大小鼠运动皮层的运动诱发电位,而ctDCS 则具有抑制作用[27],表明tDCS 可以影响运动神经系统的功能。其次,tDCS 能够影响大鼠运动皮层的神经元单位放电[28]、诱发场电位[29],以及运动皮层之间的神经传导[30]。而在小鼠上的研究发现,tDCS 能够增强M1 区BDNF 依赖的突触可塑性,提示tDCS 在提高运功技能学习中具有潜在作用[9,31]。再次,在PD 模型上的研究显示,tDCS 应用于大小鼠的M1区均具有潜在的神经保护作用,并促进 肢 体 运 动 等[10,21,28]。相 关 文 献 的 数 据 总 结见表3。
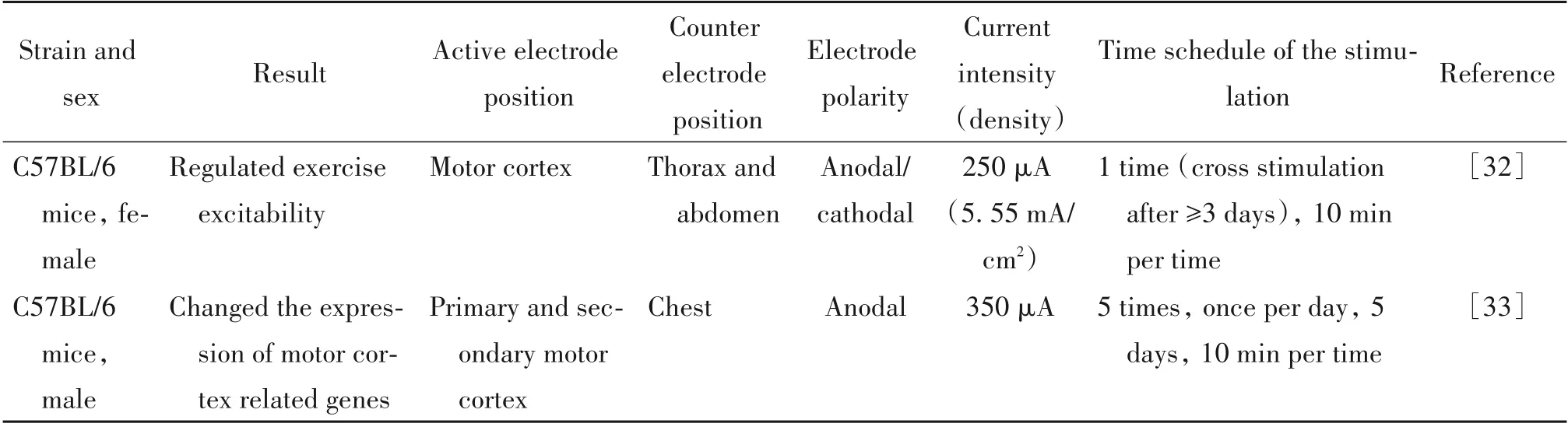
表3 tDCS对啮齿动物运动功能的作用Table 3. Effect of tDCS on motor function of rodents
1.4 tDCS 对其他功能的作用 tDCS 在其他功能上的研究主要是在大鼠上,在改善视觉功能和调节脑血流量方面均有报道。有研究表明,tDCS 可改善弱视大鼠的视觉能力[34],重复多次的atDCS 提高了弱视大鼠的视觉敏感度,有效恢复弱视动物的视觉功能。还有研究发现tDCS 可调节局部脑血流量,对大鼠给予atDCS,30 min后其脑血流量增加,ctDCS则降低脑血流量,因此表明tDCS 通过电极极性依赖的方式调节脑血流量[35]。此外,ctDCS在动物实验中亦可引起长达90 min 的可逆性局部脑血流量的减少,并且脑血流量减少的区域并不局限于刺激的部位[36]。相关文献的数据总结见表4。
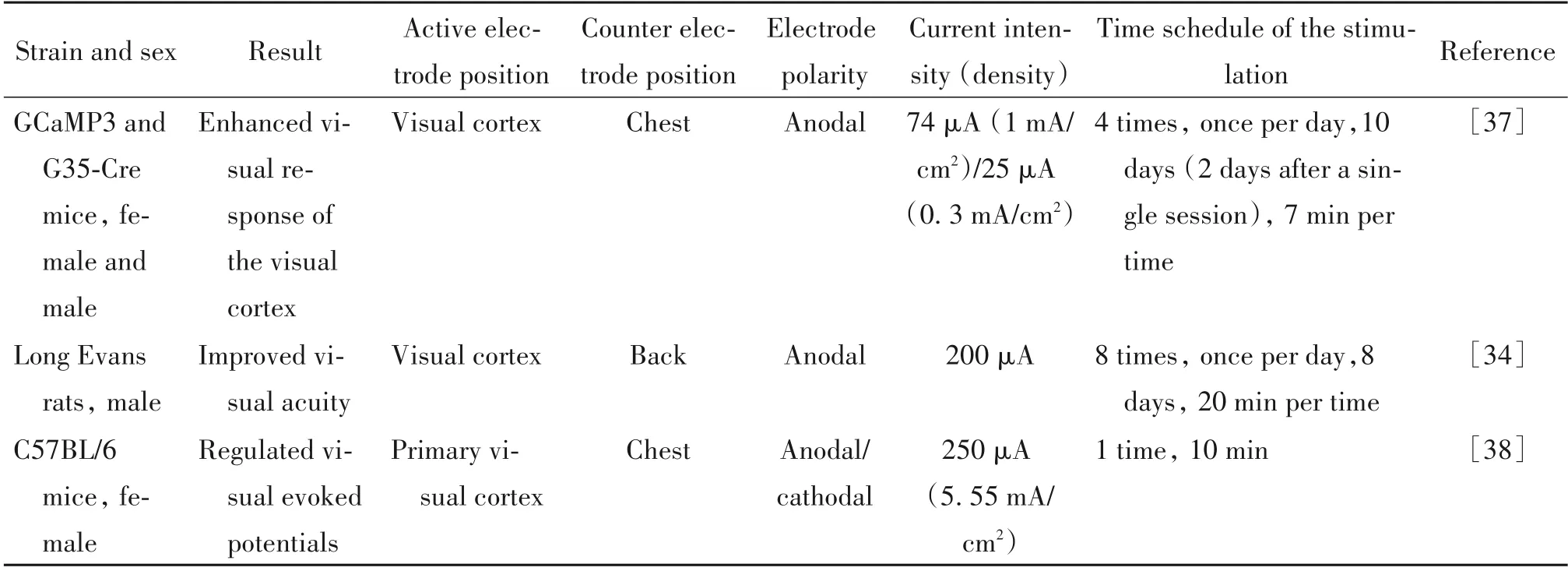
表4 tDCS对啮齿动物其他功能的作用Table 4. Effect of tDCS on other functions of rodents
2 tES的机制研究
tES 因其潜在的治疗价值而受到关注,因此近年来对其机制的研究也逐渐增加。tDCS的机制研究较多,主要体现在对神经元兴奋性、突触可塑性与Ca2+浓度的影响等方面;tACS的机制研究较少,主要涉及调节脑节律,并影响兴奋/抑制平衡等方面。
2.1 tDCS 对神经元兴奋性的影响 tDCS 对神经元兴奋性的具有调节作用[32,39]。根据阳极或阴极刺激,tDCS分别增加或降低皮质兴奋性,这取决于电流的极性。由于不同极性直流电所引起的静息膜电位变化不同,从而引起神经元的放电速率增加或降低。atDCS 导致神经元的去极化引起兴奋性作用,而在ctDCS则引起超极化抑制皮层神经元活动[32],进而影响动物的认知和行为表现[40]。tDCS 对动物的额叶、海马、运动皮层、视皮层等脑区的神经元兴奋性均可产生显著影响,并在这些皮层中产生持久的刺激后效应[37-38,41-43]。
tDCS对神经元兴奋性的影响与脑内中枢神经递质兴奋/抑制平衡调节有关。tDCS 可以调节脑内谷氨酸能、γ-氨基丁酸(γ-aminobutyric acid,GABA)能和多巴胺能系统的活动[44]。tDCS 能够增强大鼠脑内的GABA 抑制作用,引起GABA 浓度的降低,并且这些变化与大鼠的运动学习、运动记忆过程高度相关[45]。此外,atDCS 能够增强PD 大鼠中多巴胺能神经细胞移植的存活和整合[7]。
2.2 tDCS 对突触可塑性的影响 tDCS 能够改变神经元的突触可塑性[33,42,46]。tDCS 调节感觉运动皮层[47]和听觉皮层[48]神经元的突触可塑性。tDCS可以影响突触可塑性及长时程增强(long-term potentiation,LTP)的分子决定因素,如脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)。atDCS 增强大鼠的海马LTP,ctDCS 则具有相反的作用,并且atDCS 对海马LTP 的影响在刺激结束一周后仍持续存在[49-50]。atDCS 可以通过调控BDNF 的表达来增强啮齿动物的皮层神经元突触可塑性,进而提高动物的记忆能力[13]。atDCS 可以促进运动皮层的神经元活动,增加BDNF 的分泌,影响运动皮层神经元的突触可塑性,提示BDNF 在tDCS 诱导的突触可塑性变化中具有重要作用[13]。
2.3 tDCS 对Ca2+浓度的影响 tDCS 能够引起大脑中Ca2+的积聚。在tDCS刺激的同侧大脑半球中,Ca2+积累的程度比在对侧大脑半球中更大,并且在海马和下丘脑皮层中也发现了Ca2+积聚[51]。据报道,tDCS 能够引起整个大脑皮层星形胶质细胞中Ca2+大幅度激增,同时降低小胶质细胞的活性,增强神经元间的突触传递,但局部场电位并没有发生明显的改变[52]。研究表明,tDCS 引起细胞内Ca2+水平增加[13],主要是由于电压门控钙通道的激活引起的。此外,Ca2+浓度的升高对神经元突触可塑性及动物的抑郁样行为具有改善作用[53]。
有关tDCS机制研究的总结见表5。
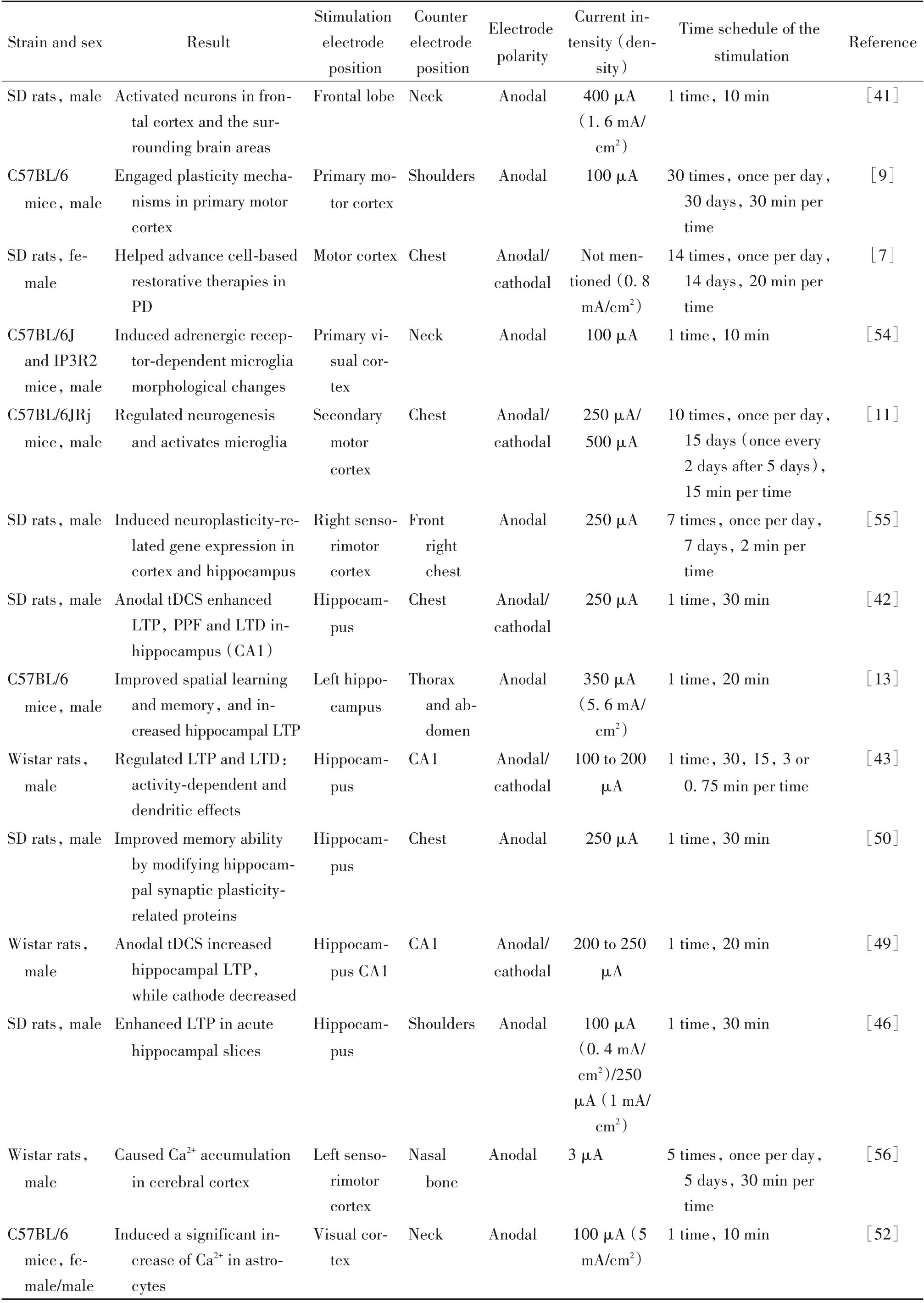
表5 tDCS在啮齿动物中的作用机制Table 5. The mechanisms of tDCS in rodents
2.4 tACS 的机制 相对tDCS 而言,tACS 的机制研究较少。现有观点认为tACS 的机制主要是同步化或去同步化神经元网络,从而改变大脑振荡节律,但其具体的作用原理尚不明确。tACS在啮齿类模型中的机制研究主要分为两方面。一方面,tACS 可以调节兴奋性和抑制性皮层神经元的活动,对皮层兴奋/抑制平衡产生影响。tACS 可以改变脑内GABA 水平,特别是对GABAA受体介导的神经活动产生影响,在各脑区之间的连接性方面产生调节作用[57]。另一方面,tACS可以直接干扰并调节大脑节律,从而影响认知过程[58]。已有研究对多个皮质区域进行tACS,发现tACS 在较低频率下可以调节细胞膜电位,引起神经元振荡,但在较高频率下却对大脑神经活动没有明显作用[59]。也有研究表明tACS 在麻醉和清醒动物中对其感觉和视皮层具有调节作用[5],但有研究者提出tACS 的刺激作用是高度依赖动物状态的,因为深度麻醉本身会影响大脑的振荡,从而干扰tACS 的刺激效果[60]。此外,还有研究认为tACS 到达皮层的电位较少,不足以引起神经活动。研究证明tACS对运动皮层的作用是由经皮刺激引起周围神经活动而产生的,并不是由经颅刺激皮层神经活动引起的[61]。因为近75%的电流通过软组织和颅骨后会衰减,实际到达刺激脑区的电流只有25%,特别是在电极非常靠近时,电流的流失比例会更高,电流更有可能在头皮上分流[62]。
3 tES的刺激参数
tES 刺激参数设置,如电极极性(tDCS)、刺激频率(tACS)、电流强度(密度)、刺激时间、重复刺激次数、实验周期等,以及tES 实验动物参数,如动物品系、性别、年龄等,对tES 实验结果都具有较大影响。(1)在小鼠中,通常选择C57 小鼠或者特定模型的雄性小鼠。对于电极极性而言,阳极刺激的研究较多,其研究进展也较多。研究中所使用的电流密度差异性较大,但使用5.71 mA/cm2电流密度的研究较多,此外,使用电流强度为200~350 μA 的研究也较多。对于刺激次数而言,单次和重复多次的均有使用,且重复刺激的次数也不太统一,但重复10 次的研究较多,刺激的持续时间一般为10~20 min。(2)在大鼠中,通常选择SD 和Wistar 大鼠或者特定模型的雄性大鼠。对于电极极性而言,也是阳极刺激的研究居多。电流强度(密度)设置的差异性也比较大。对于重复次数而言,单次和重复多次刺激均有使用,且重复次数也不太统一,但刺激的持续时间与小鼠相似,通常为10~20 min。
tDCS应用的脑区会产生不同的效果,位置不同,电流强度也会有少许差异。在小鼠中刺激脑区为额叶皮层、海马、顶叶皮层、运动皮层、视皮层和听皮层;而对电极多数置于胸腹部,少数置于肩颈部。在大鼠中的刺激区域与小鼠类似。
4 tES的安全性
对于tES 在啮齿动物中的安全性分析,目前对tDCS 的关注稍多,但还不够完善。在tDCS 中其不良反应和癫痫发作风险均很低。当使用atDCS 在20 A/m2的电流密度下观察到刺激部位病变,该电流密度低于先前报道的ctDCS 为142.9 A/m2的安全阈值[2]。但Jackson等[63]的研究表明,在大脑内部进行tDCS处理期间,当电流密度小于20 A/m2时不会引起运动功能和学习记忆能力损伤;tDCS 对脑形态、神经结构、神经递质水平或脑温没有显著影响;而电流密度较高的刺激会导致小胶质细胞表型变化。此外,有研究发现ctDCS 在500 μA 的电流强度下对啮齿动物是安全的,对成年雄性大鼠的运动能力、运动耐力和空间学习记忆等行为指标均没有影响[64]。相关文献的数据总结见表6。
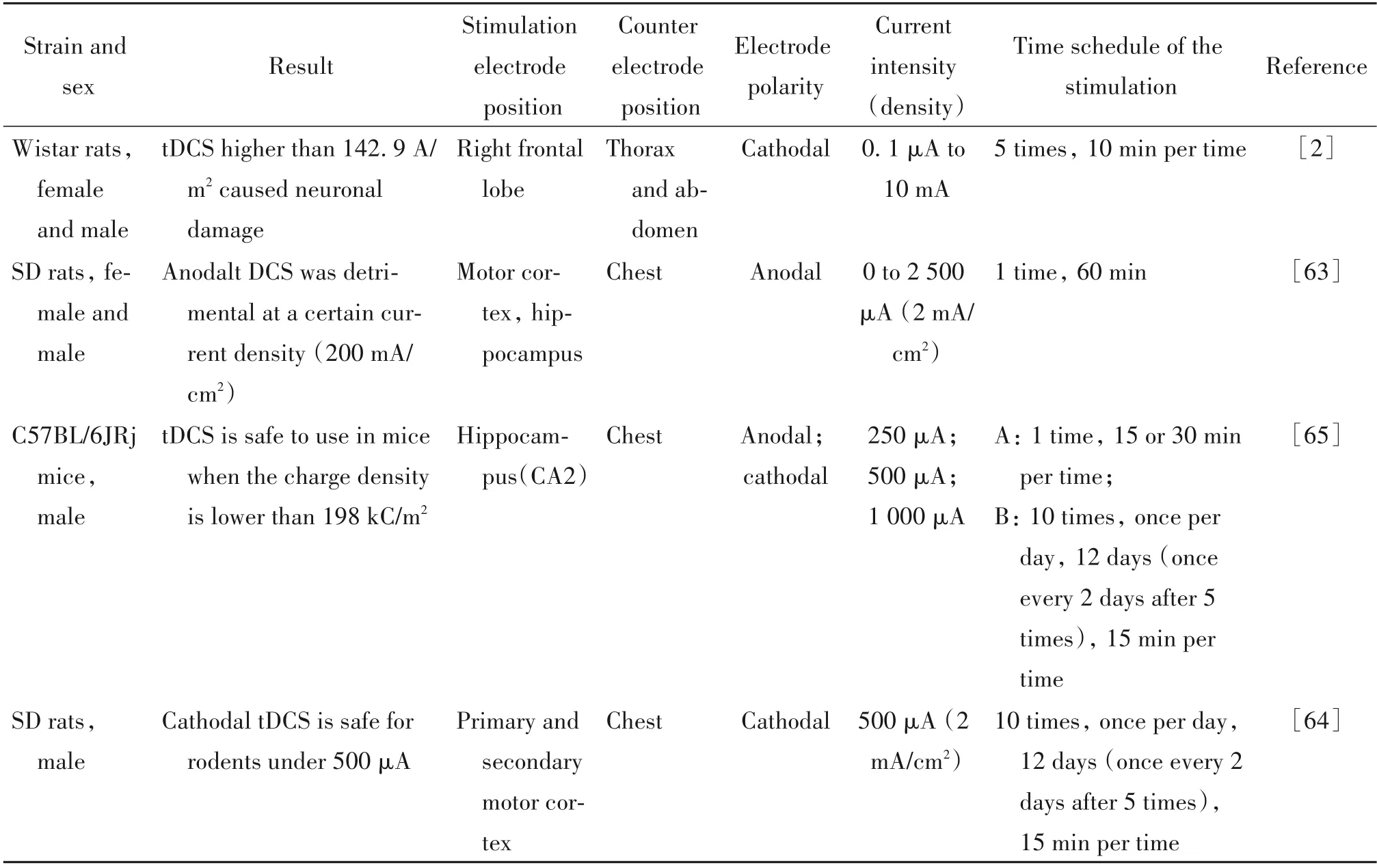
表6 tDCS在啮齿动物中的安全性Table 6. The safety of tDCS in rodents
5 小结
tES 在啮齿动物(小鼠和大鼠)上的研究进展表明:tES在改善AD、PD、抑郁、癫痫等神经系统疾病方面有潜在作用,也可以有效改善认知、调节运动兴奋性等脑功能。这些进展可为后续的tES 相关研究提供参考。一方面,tDCS的研究偏向于功能方面,近年来对tES机制上的研究逐渐增加,但关于功能与机制结合的研究目前较少,期待进一步的研究。另一方面,目前tACS 在啮齿动物上的基础研究相对较少,机制研究也较为欠缺,相反,在临床上的研究较多,因此,可以通过在啮齿动物模型上的试验,验证tACS在临床上的研究结果,以此进一步探索与促进tACS这种神经调节技术的发展。此外,tES 的刺激参数需要标准化,目前使用的参数不一,从而引起的作用效果差异较大,其中以电流密度至关重要,但这一参数在啮齿动物的研究尚存较大差异。最后,tES 的安全性也需要开展进一步研究,目前为止,对电流大小和密度以及其它参数的安全阈值报导尚少,因此tES参数设置的安全范围还有待界定。

