右美托咪定通过调控TXNIP/NLRP3炎症小体途径减轻脂多糖诱导的小鼠肠道屏障损伤*
贾 彤, 邢 珍, 王会娟, 李国利△
(河北北方学院附属第一医院1麻醉科,2重症医学科,河北张家口 075061)
肠道作为主要的消化吸收场所,肠道黏膜中含有丰富的血管,发生炎症会造成肠道屏障损伤,而肠道屏障损伤参与多种肠道疾病的发生,与炎症性肠病、细菌性肠炎和克罗恩病等关系密切[1];肠道损伤会造成患者消瘦、营养不良和生长受阻,严重时可导致死亡[2]。右美托咪定(dexmedetomidine,DEX)是一种α2受体激动药物,其既可发挥镇静镇痛作用,又可抑制炎症介质释放而发挥抗炎作用[3],在肠道中可以缓解烧伤引起的肠屏障损伤[4]。核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3,NLRP3)炎症小体参与肠道屏障损伤过程,能够激活胱天蛋白酶1(caspase-1)/白细胞介素1β(interleukin-1β,IL-1β)通路,从而介导中性粒细胞浸润,加重肠道损伤[5];NLRP3 与其介质硫氧还蛋白相互作用蛋白(thioredoxin-interacting protein,TXNIP)结合,可以激活NLRP3 炎症小体[6]。因此,抑制TXNIP/NLRP3 通路的激活可能对于缓解肠道屏障损伤具有重要的意义。本项工作以小鼠为研究对象,采用脂多糖(lipopolysaccharide,LPS)诱导小鼠肠道屏障损伤,初步探讨DEX 治疗肠道屏障损伤的机制,以期为临床应用提供动物实验依据。
材 料 和 方 法
1 动物
60 只SPF 级雄性C57BL/6 小鼠,6 周龄,(20±2)g,购自北京维通利华实验动物技术有限公司,生产许可证号为SCXK(京)2019-0009。在温度23 ℃、湿度50%、12 h 黑暗/12 h 光照条件下自由饮水摄食,所有动物暂养1 周,动物实验符合3R 原则。本研究经河北北方学院附属第一医院实验动物伦理委员会审核并通过。
2 主要试剂及仪器
盐酸DEX 注射液(江苏恒瑞医药股份有限公司);LPS(Santa Cruz);pcDNA3.1 载体和pcDNA3.1-TXNIP 过表达载体购自广州锐博生物有限公司;引物均由上海生工生物技术有限公司合成;丙二醛(malondialdehyde,MDA)、活性氧(reactive oxygen species,ROS)、超氧化物歧化酶(superoxide dismutase,SOD)和谷胱甘肽(glutathione,GSH)试剂盒(上海碧云天生物技术有限公司);小鼠IL-1β和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)酶联免疫 吸 附 测 定(enzyme-linked immunosorbent assay,ELISA)试剂盒及TXNIP、NLRP3、caspase-1 和IL-1β抗体(Abcam);苏木素-伊红(hematoxylin-eosin,HE)染色试剂盒(北京索莱宝科技有限公司)。RT-qPCR仪(Abbott;型号:Abbott m2000rt);蛋白凝胶成像仪(Tanon;型号:Tanon 4200)。
3 主要方法
3.1 模型制备及分组 实验小鼠随机分为对照(control)组、模型(model)组、DEX组、DEX+pcDNA3.1组和DEX+TXNIP 组,每组12 只。除对照组外,其余各组小鼠参考文献[7]方法给予腹腔注射15 mg/kg LPS诱导肠道屏障损伤,对照组小鼠则注射等体积生理盐水。在LPS 诱导肠道屏障损伤前30 min,DEX组小鼠腹腔注射30 μg/kg DEX[8](浓度为30 mg/L),DEX+pcDNA3.1 组和DEX+TXNIP 组分别在DEX 组基础上皮下注射5 nmol pcDNA3.1 和pcDNA3.1-TXNIP,对照组和模型组小鼠则皮下注射等体积生理盐水。
3.2 样品采集 建模6 h 后处死小鼠,经心室采血,1 000×g离心10 min,取上清置于-20 ℃冰箱保存待用;收集回肠组织,部分置于-80 ℃冰箱保存,部分置于4%多聚甲醛中固定。
3.3 ELISA 检测血清中IL-1β 和TNF-α 水平 采用小鼠IL-1β 和TNF-α ELISA 试剂盒检测血清中IL-1β和TNF-α水平。
3.4 HE 染色观察肠道组织形态 从4%多聚甲醛中取出肠道组织,经乙醇脱水、二甲苯透明、石蜡包埋后,切片(5 μm)。切片经二甲苯脱蜡、梯度乙醇水化、苏木精染色、0.1%盐酸乙醇分化、伊红复染、乙醇脱水、二甲苯透明后封片,光学显微镜下观察肠道组织形态。根据肠道组织绒毛破损,细胞脱落、坏死,炎症细胞浸润等病理严重程度进行评分。具体评分标准为:0 分,无损伤;1 分,细胞出现局部萎缩、坏死,局部炎症细胞浸润;2分,细胞片状萎缩、坏死,片状炎症细胞浸润,黏膜结构完整;3分,细胞大量萎缩、坏死,炎症细胞浸润明显,黏膜结构不完整;4分,细胞大部分坏死,肠黏膜结构消失,炎症细胞浸润。
3.5 试剂盒检测肠道组织中氧化应激指标 严格按照试剂盒说明,检测肠道组织中氧化应激指标MDA、ROS、SOD 和GSH 水平,其中MDA 用硫代巴比妥酸法,ROS 用荧光酶法,SOD 用ELISA 法,GSH 用微量酶标法。
3.6 RT-qPCR 检测肠道组织中TXNIP、NLRP3、caspase-1 和IL-1β 的mRNA 水平 取30 mg 肠道组织,经RNA 提取试剂盒提取总RNA 后,采用cDNA 第一条链合成试剂盒合成cDNA,于PCR 仪中进行TXNIP、NLRP3、caspase-1 和IL-1β 的mRNA 扩 增。20 μL 反应体系:2× SYBR Premix Ex TaqTMⅡProbe qPCR Mix 10 μL,ddH2O 8.0 μL,50 mg/L cDNA 1 μL,上、下游引物(10 μmol/L)各0.5 μL。反应条件:95 ℃5 min;94 ℃15 s,59 ℃30 s,40 个循环。采用2-ΔΔCt法对TXNIP、NLRP3、caspase-1和IL-1β的mRNA进行相对定量分析。各引物序列见表1。

表1 RT-qPCR引物序列Table 1. Primer sequences for RT-qPCR
3.7 Western blot 检测肠道组织中TXNIP、NLRP3、caspase-1和IL-1β蛋白水平 30 mg肠道组织经手术剪剪碎,添加蛋白裂解液冰上研磨,研磨后冰上裂解20 min,4 ℃、16 000×g离心20 min,BCA 试剂盒测定蛋白浓度,沸水煮10 min 使蛋白变性。每孔上样30 μg,凝胶分离蛋白,PVDF 膜转膜;5%脱脂奶粉溶液室温封闭2 h;对应加入Ⅰ抗(TXNIP、NLRP3、caspase-1、IL-1β 和β-actin 抗体),4 ℃孵育过夜;对应加入Ⅱ抗,室温孵育2 h。DAB 显色试剂显色,蛋白凝胶成像仪拍照和定量分析。
4 统计学处理
GraphPad Prism 7.0 对数据进行统计学分析。计量数据以均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q法。以P<0.05为差异有统计学意义。
结 果
1 DEX对小鼠血清中IL-1β和TNF-α水平的影响
与对照组相比,模型组、DEX 组、DEX+pcDNA3.1 组和DEX+TXNIP 组小鼠血清中IL-1β 和TNF-α 水平均升高(P<0.05);与模型组相比,DEX 组和DEX+pcDNA3.1 组血清中IL-1β 和TNF-α 水平降低(P<0.05);分别与DEX 组和DEX+pcDNA3.1 组相比,DEX+TXNIP 组小鼠血清中IL-1β 和TNF-α 水平升高(P<0.05),见图1。

Figure 1. The levels of IL-1β and TNF-α in the serum of mice. Mean±SD. n=12.#P<0.05 vs control group;*P<0.05 vs model group;&P<0.05 vs DEX group;△P<0.05 vs DEX+pcDNA3.1 group.图1 各组小鼠血清中IL-1β和TNF-α水平
2 DEX对肠道组织形态的影响
对照组肠上皮细胞完整,层次清晰,病理评分0分;模型组肠道组织完整性被破坏,出现明显的细胞脱落现象,炎症浸润明显,病理评分为3.76±0.19,与对照组相比评分升高(P<0.05);DEX 组和DEX+pcDNA3.1组肠道组织完整,但出现明显的炎症浸润现象,病理评分分别为1.96±0.23 和2.03±0.17,与模型组相比评分降低(P<0.05);DEX+TXNIP 组肠道完整性被破坏,出现细胞脱落现象,炎症浸润明显,病理评分为3.16±0.21,与DEX+pcDNA3.1 组相比评分升高(P<0.05),见图2。
3 DEX 对小鼠肠道组织中氧化应激指标MDA、ROS、SOD和GSH的影响
与对照组相比,模型组肠道组织中MDA 含量和ROS 水平升高(P<0.05),而SOD 和GSH 活性降低(P<0.05);与模型组相比,DEX 组肠道组织中MDA含量和ROS 水平降低(P<0.05),SOD 和GSH 活性升高(P<0.05);分别与DEX 组和DEX+pcDNA3.1 组相比,DEX+TXNIP 组肠道组织中MDA 含量升高(P<0.05),SOD和GSH活性降低(P<0.05),见图3。

Figure 3. MDA content,ROS level,SOD activity and GSH activity in mouse intestinal tissues of each group. Mean±SD. n=12.#P<0.05 vs control group;*P<0.05 vs model group;&P<0.05 vs DEX group;△P<0.05 vs DEX+pcDNA3.1 group.图3 各组小鼠肠道组织中MDA含量、ROS水平及SOD和GSH活性
4 DEX 对小鼠肠道组织中TXNIP、NLRP3、caspase-1和IL-1β mRNA和蛋白水平的影响
与对照组相比,模型组小鼠肠道组织中TXNIP、NLRP3、caspase-1 和IL-1β 的mRNA 和蛋白水平升高(P<0.05);与模型组相比,DEX 组小鼠肠道组织中TXNIP、NLRP3、caspase-1 和IL-1β 的mRNA 和蛋白水平降低(P<0.05);分别与DEX 组和DEX+pcDNA3.1 组相比,DEX+TXNIP 组肠道组织中TXNIP、NLRP3、caspase-1 和IL-1β 的mRNA 和蛋白水平升高(P<0.05),见图4、5。

Figure 4. TXNIP,NLRP3,caspase-1 and IL-1β mRNA levels in mouse intestinal tissues of each group. Mean±SD. n=12.#P<0.05 vs control group;*P<0.05 vs model group;&P<0.05 vs DEX group;△P<0.05 vs DEX+pcDNA3.1 group.图4 各组肠道组织中TXNIP、NLRP3、caspase-1和IL-1β的mRNA水平
讨 论
肠黏膜损伤的主要损伤机制包括炎症反应、氧化应激、细胞凋亡等,炎症反应是肠道屏障功能损伤的关键原因[9],Zhang 等[10]研究显示,在小鼠中肠道菌群异位会刺激肠黏膜炎症,导致肠道机械屏障和黏膜免疫发生障碍,引起免疫抑制。因而,减少炎症因子释放对于缓解肠黏膜损伤具有重要作用。DEX作为新型α2肾上腺素受体激动剂,已广泛应用于临床,能完全溶于水,可快速被吸收,半衰期仅6 min,具有镇静、催眠、抗焦虑、镇痛和神经保护等作用[11];也可调节免疫系统,能够抑制免疫反应,同时抑制炎症因子TNF-α 和IL-1β 等的作用[12]。在本研究中,DEX 能够降低血清中炎症因子IL-1β和TNF-α水平,且能够减轻LPS 诱导的肠道完整性破坏现象和炎症细胞浸润现象,缓解LPS诱导的肠黏膜损伤。
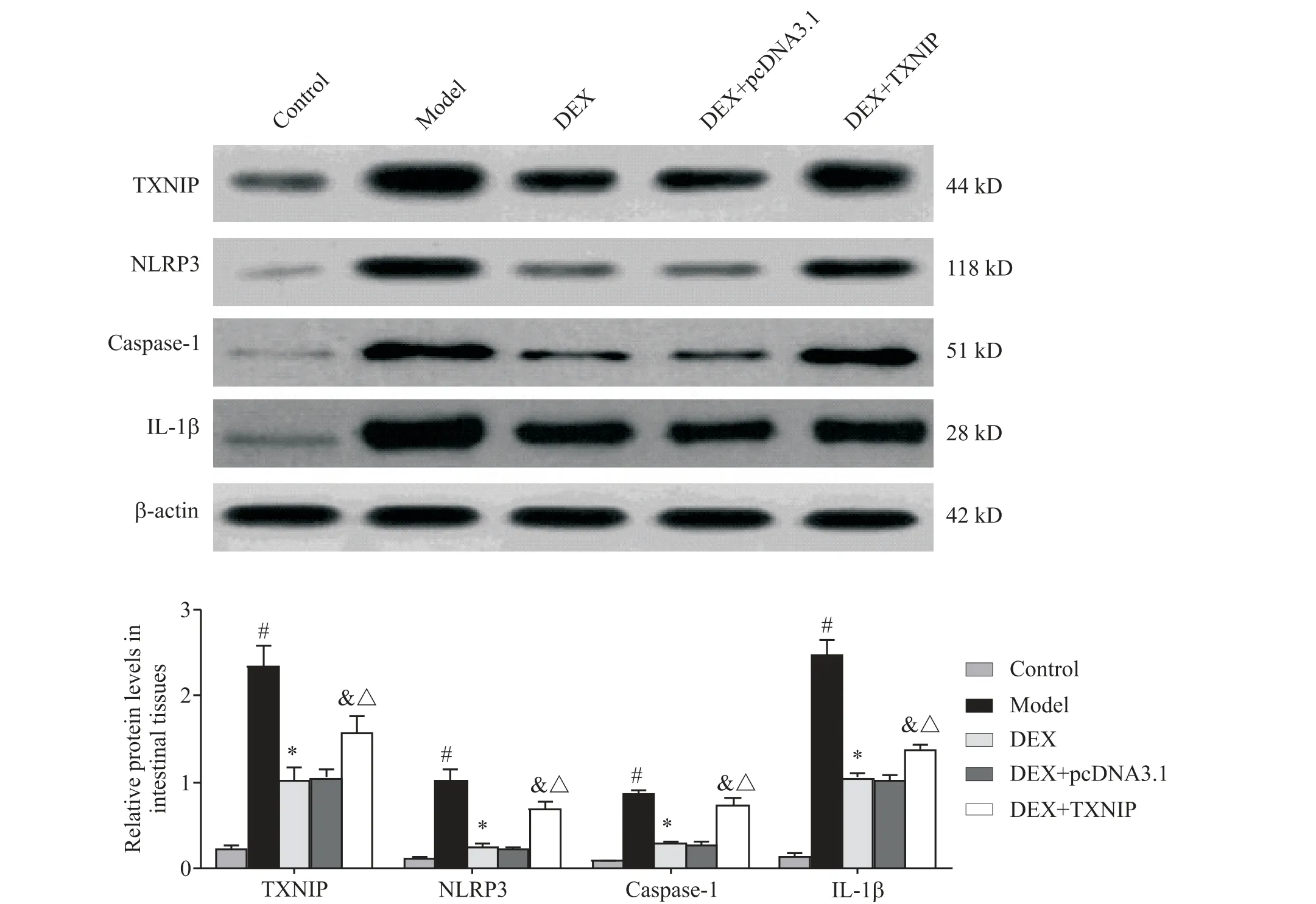
Figure 5. TXNIP,NLRP3,caspase-1 and IL-1β protein levels in the intestinal tissues of mice in each group. Mean±SD. n=12.#P<0.05 vs control group;*P<0.05 vs model group;&P<0.05 vs DEX group;△P<0.05 vs DEX+pcDNA3.1 group.图5 各组小鼠肠道组织中TXNIP、NLRP3、caspase-1和IL-1β的蛋白水平
肠黏膜上皮细胞在正常肠道环境不发生炎症反应,呈现免疫耐受状态,当肠黏膜上皮细胞通过自身模式识别受体(pattern recognition receptors,PRRs)识别病原菌时,促进炎症反应发挥机体防御作用[13]。核苷酸结合寡聚化结构域样受体(nucleotide-binding oligomerization domain-like receptors,NLRs)是PRRs之一,NLRP3 属于NLRs 家族成员,在免疫细胞中广泛表达,也在肠黏膜上皮细胞中表达,能够识别大部分病原微生物,LPS 是其中之一[14]。受LPS 刺激后,NLRP3 炎症小体异常活化,能够促进caspase-1 和IL-1β等效应分子的产生,进而发挥生物学效能,参与机体炎症和免疫过程[15]。本研究显示,NLRP3 炎症小体在LPS 诱导的肠黏膜损伤中处于激活状态,DEX能够降低NLRP3 mRNA 和蛋白的表达水平,进而缓解疾病。炎症损伤伴随氧化损伤在LPS 诱导的肠黏膜损伤中发生,在本研究中检测氧化应激指标MDA含量、ROS 水平及SOD 和GSH 活性,结果显示,在LPS 诱导的肠黏膜损伤中MDA 含量、ROS 水平升高及SOD 和GSH 活性降低。而MDA 具有细胞毒性和诱变性,是氧化应激标志;ROS 表示氧化应激情况;SOD 和GSH 作为保护因子,可在氧化应激反应下,清除机体自由基及过氧化物[16-17],提示LPS 诱导的肠黏膜损伤中抗氧化应激水平降低,氧化应激水平升高,肠道组织发生氧化应激损伤。DEX 能够减轻自由基的产生,影响MDA 水平及过氧化氢酶活性,进而降低机体中氧化应激水平[18]。与He 等[19]研究结果类似,本研究中DEX 能够降低MDA 含量、ROS 水平,升高SOD和GSH活性,从而清除机体自由基,缓解肠道组织氧化应激损伤。TXNIP 作为硫氧还蛋白的内源性抑制蛋白,可通过与硫氧还蛋白活性部分相互结合引起细胞内活性氧化物的堆积进而诱导机体损伤,还可激活NLRP3炎症小体从而调控炎症反应[20]。本研究在DEX 干预基础上过表达TXNIP 后,机体氧化应激指标、炎症因子水平升高,推测DEX通过抑制TXNIP 水平进而调控NLRP3 表达从而降低LPS 诱导的炎症、氧化应激损伤,实现对肠黏膜的保护作用。

