柚皮素通过miR-22抑制NLRP3炎症小体并减轻溃疡性结肠炎大鼠模型肠屏障损伤*
谢春燕, 谢 刚, 季语竹
(绵阳市中心医院病理科,四川绵阳 621000)
溃疡性结肠炎(ulcerative colitis,UC)是一种由宿主肠道微生物区系免疫反应失衡引起的结肠慢性炎症性疾病,严重威胁患者身心健康[1]。UC 的病理特征是黏膜和黏膜下层炎症和溃疡性病变[2]。目前认为,UC 的发病机制主要与个人遗传易感性、免疫功能障碍、肠上皮细胞完整性受损和肠道菌群改变有关[3]。由于病因病机不明,临床治疗UC 较为困难。虽然氨基水杨酸、类固醇、免疫抑制剂和生物制剂可以缓解UC,但它们也有许多副作用[4],因此,寻找更可靠、更有效的药物显得尤为迫切。柚皮素(naringenin)是一种食品添加剂,从葡萄柚、酸橙和柑橘类种子中提取。研究发现,柚皮素具有抗炎和抗氧化等多种生物活性[5]。Cao 等[6]研究发现,柚皮苷可通过抑制核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3,NLRP3)炎性小体的激活,发挥对UC 小鼠的治疗作用。NLRP3在宿主抗炎和免疫应答的发生中起着关键作用。另外,经生物信息学预测发现,NLRP3 的3′-UTR 中 具 有 微 小RNA-22(microRNA-22,miR-22)的结合位点。因此,本研究中拟通过葡聚糖硫酸钠(dextran sodium sulfate,DSS)诱导大鼠,构建UC 模型,探究柚皮素调控miR-22/NLRP3 信号通路对UC大鼠肠屏障的保护作用。
材 料 和 方 法
1 动物
SD 雄性大鼠,8 周龄,体质量200~220 g,购自西南医科大学,许可证号为SCXK(川)2018-17。在整个饲养和研究期间,所有动物都可以随意获得食物和水,温度(21±2)℃,相对湿度为(45±10)%并保持12 h 的光/暗周期。所有实验均按照《实验动物管理及使用指南》进行,并经动物伦理委员会批准。
2 主要试剂
大鼠小肠隐窝上皮IEC-6 细胞购自中国农业大学。柚皮素(纯度≥98%)购自北京索莱宝生物科技有限公司;白细胞介素1β(interleukin-1β,IL-1β)测试盒购自南京建成生物工程研究所;引物由上海生工生物工程有限公司合成;总RNA 提取试剂盒购自天根生化科技(北京)有限公司;反转录试剂和TB Green 荧光试剂均购自宝日医生物技术(北京)有限公司;抗ZO-1、occludin、claudin-1和NLRP3抗体均购自Abcam。
3 主要仪器
H-7650 透射电子显微镜购自HITACHI;实时荧光定量PCR 仪和多功能酶标仪购自Thermo Fisher Scientific;化学发光成像仪购自GE Healthcare;电泳仪和转膜仪购自Bio-Rad;光学显微镜购自Leica。
4 主要方法
4.1 动物分组及模型制备 参考Liu 等[7]方法,使用DSS 诱导UC 大鼠模型,先用5% DSS 溶液灌胃5 d,再改用自来水饮水10 d,整个过程重复3 次,建立UC 大鼠模型。每天观察大鼠一般情况,体重,粪便性状、潜血或血性情况。死亡大鼠被排除在本研究之外。对照组大鼠只饮用自来水。
4.2 动物分组及给药 造模成功后,将UC 大鼠分成模型(model)组、低剂量柚皮素(low-dose naringenin)组、高剂量柚皮素(high-dose naringenin)组和柚皮素+miR-22 antagomiR 组,每组10只。另取10只大鼠做对照组处理。低、高剂量柚皮素组大鼠分别以25 和100 mg/kg 剂量腹腔注射[6],每天1 次。柚皮素+miR-22 antagomiR 组大鼠在给予100 mg/kg 柚皮素腹腔注射的基础上,再尾静脉注射5 mL/kg miR-22 antagomiR,每周2 次。对照组和模型组灌胃并尾静脉注射等量生理盐水,连续4周。
4.3 疾病活动性指数(disease activity index,DAI)评估 观察大鼠体重变化、粪便稠度以及粪便和肛门的血液。DAI 根据大便稠度、粪便血液和体重下降率3 个参数得分之和进行评分。(1)体重下降率:0分,0;1 分,1%~5%;2 分,5%~10%;3 分,10%~20%;4分:≥20%。(2)大便稠度:0分,形状良好;1分,柔软但仍在形成的小球;2 分,非常软;3 分,腹泻。(3)粪血:0分,无血;1分,阳性血块;2分,大便可见血迹;3分,大便大出血[8]。
4.4 样本采集 实验结束后,将大鼠麻醉采血,离心取上清,置于-20 ℃中保存备用。然后通过颈椎脱位处死大鼠,收集大鼠肠组织,然后将大鼠部分肠组织固定在10%中性福尔马林溶液中,另一部分肠组织置于冰块上,去除肠系膜和脂肪组织,并沿肠系膜一侧进行纵向解剖。根据Yuan 等[9]描述的评分系统,用肉眼评分对肠黏膜损伤进行量化。评分标准如下:0 分,正常肠黏膜;1 分,黏膜充血无溃疡病变和出血;2 分,散发性黏膜溃疡或轻度出血;3 分,广泛溃疡坏死或肠黏膜粘连并出血;4分,严重出血,巨结肠狭窄或穿孔。记分结束后,用pH 7.4 的PBS 冲洗肠道内容物,并用滤纸吸干水分。然后用液氮速冻肠组织,并将其保存在-80 ℃备用。
4.5 血清炎症因子含量的检测 采用酶联免疫吸附法(ELISA)对血清中促炎症因子IL-1β 水平进行检测。
4.6 组织病理学观察 将10%中性福尔马林固定的肠组织,石蜡包埋,切成5 μm 厚切片。HE 染色后由光学显微镜观察病理变化。用组织病理学评分来量化肠损伤程度,包括肠上皮细胞损伤程度和炎症浸润程度。评分标准概括为:0 分,形态正常,无炎症;1 分,杯状细胞丢失,轻度炎症浸润;2 分,杯状细胞大面积丢失,中度炎症浸润;3 分,腺泡丢失,黏膜肌层广泛炎症浸润,黏膜水肿增厚;4分,腺泡大面积丢失,黏膜下层广泛炎症浸润[10]。
4.7 透射电子显微镜观察肠上皮细胞 透射电镜观察肠上皮细胞间的紧密连接(tight junctions,TJs)特征。取1 cm 大小的结肠组织切片,用3%戊二醛固定,然后用0.1 mmol/L PBS 冲洗3 次。然后再用1%锇酸溶液固定后,丙酮分级脱水,然后包埋,切成50 nm 的超薄切片,使用醋酸双氧铀-柠檬酸铅染色。将处理好切片在透射电子显微镜上进行观察。
4.8 RT-qPCR 检测肠组织中miR-22 水平 利用Trizol 试剂从肠组织匀浆中提取总RNA。NanoDrop分光光度计测定RNA 的浓度和纯度,并使用Prime-Script RT 试剂盒反转录成cDNA。反应条件为:95 ℃预变性10 min;95 ℃变性15 s,60℃退火30 s,72 ℃延伸1 min,45 个循环。以U6 为内参照,采用2-ΔΔCt法对组织中miR-22 表达水平进行相对定量分析。根据基因数据库中基因序列的公开数据,设计引物,序列见表1。
4.9 Western blot 法检测肠组织中蛋白的表达水平 将保存在-80 ℃的肠组织研磨匀浆,提取总蛋白,并检测蛋白质浓度。使用SDS-PAGE 分离蛋白质样品,然后转移到PVDF 膜上。在室温下用5%脱脂奶粉封闭1 h,然后将膜上的蛋白质与抗ZO-1、occludin、claudin-1 和NLRP3 抗体(1∶1 000)4 ℃孵育过夜,TBST 洗膜。在室温下与Ⅱ抗孵育1 h,TBST 洗膜。ECL 发光液显色,使用化学发光成像仪分析蛋白质相对表达量,以β-actin为内参照。
4.10 萤光素酶报告基因实验 利用microRNA.org预测miR-22 与NLRP3 的靶向结合位点。从含有miR-22 编码区的NLRP3 3′-UTR 启动子区域扩增序列,构建NLRP3-3′-UTR-WT 质粒。然后根据质粒分离试剂盒中的说明,突变结合位点以构建NLRP3 3′-UTR-MUT 质粒。将对数生长期的IEC-6 细胞接种到96 孔板中,直到细胞达到70%融合为止。然后,用Lipofectamine 2000 试剂盒转染细胞。将NLRP3-3′-UTR-WT 质粒与miR-22 模拟物(mimics)充分混合共转染到IEC-6 细胞中。同时将NLRP3-3′-UTR-WT+miR-22 NC(对照组)、NLRP3-3′-UTR-MUT+miR-22 NC 和NLRP3-3′-UTR-MUT+miR-22 mimics 分别转染IEC-6细胞。孵育6 h后,将IEC-6细胞与10%胎牛血清一起培养48 h,使用双萤光素酶试剂盒检测萤光素酶活性。
5 统计学处理
所有数据分析均使用SPSS 22.0 软件进行。统计数据以均数±标准差(mean±SD)表示。单因素方差分析用于多组间比较,进一步两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
结 果
1 UC大鼠肠组织中miR-22表达水平
与对照组相比,模型组大鼠miR-22 水平显著降低(P<0.05);与模型组相比,低、高剂量柚皮素组大鼠的miR-22 水平显著升高(P<0.05);与高剂量柚皮素组相比,柚皮素+miR-22 antagomiR 组大鼠的miR-22水平显著降低(P<0.05),见图1。
2 柚皮素对UC 大鼠DAI 和肠黏膜损伤肉眼评分的影响
与对照组相比,模型组大鼠DAI 和肠黏膜损伤肉眼评分显著升高(P<0.05);与模型组相比,低、高剂量柚皮素组大鼠DAI 和肠黏膜损伤肉眼评分显著降低(P<0.05);与高剂量柚皮素组相比,柚皮素+miR-22 antagomiR 组大鼠DAI 和肠黏膜损伤肉眼评分显著升高(P<0.05),见表2。
3 柚皮素对UC大鼠血清中炎症因子水平的影响
与对照组相比,模型组大鼠血清中IL-1β 的水平显著升高(P<0.05);与模型组相比,低、高剂量柚皮素组大鼠血清中IL-1β的水平显著降低(P<0.05);与高剂量柚皮素组相比,柚皮素+miR-22 antagomiR 组大 鼠 血 清 中IL-1β 的 水 平 显 著 升 高(P<0.05),见表2。

表2 各组大鼠DAI、肠黏膜损伤肉眼评分和血清中IL-1β水平的比较Table 2. Comparison of disease activity index(DAI),intestinal mucosal injury naked-eye score and the serum levels of IL-1β of the rats in each group(Mean±SD. n=10)
4 柚皮素对UC大鼠肠组织病理变化的影响
对照组大鼠肠组织结构正常;模型组大鼠肠组织黏膜结构破坏严重,隐窝广泛缺失,黏膜及黏膜下层有出血、水肿及大量炎症细胞浸润;低、高剂量柚皮素组大鼠肠组织结构清晰可见,黏膜和黏膜下层有轻度或中度炎症细胞浸润和水肿,较模型组明显减轻;柚皮素+miR-22 antagomiR 组大鼠肠组织较高剂量柚皮素组大鼠肠组织损伤明显严重,炎症细胞浸润增加。
与对照组相比,模型组大鼠肠组织病理学评分明显升高(P<0.05);与模型组相比,低、高剂量柚皮素组大鼠肠组织病理学评分显著降低(P<0.05);与高剂量柚皮素组相比,柚皮素+miR-22 antagomiR 组大鼠肠组织病理学评分显著升高(P<0.05),见图2。
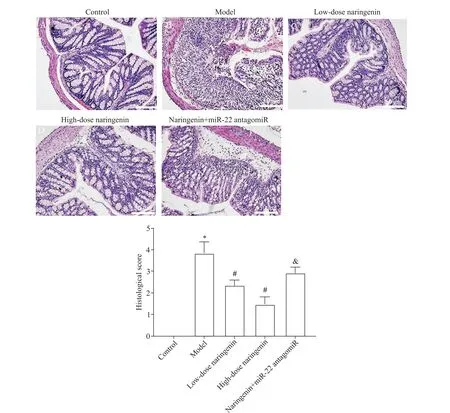
Figure 2. The histopathological changes(×200)and histological scores of rat intestine tissues in each group. Mean±SD. n=10.*P<0.05 vs control group;#P<0.05 vs model group;&P<0.05 vs high-dose naringenin group.图2 各组大鼠肠组织病理学变化及组织学评分的比较
5 柚皮素对UC大鼠肠上皮细胞TJs的影响
对照组肠上皮细胞与桥粒之间的接触结构清晰,提示肠黏膜屏障完整;模型组肠黏膜屏障受损,桥粒消失,细胞间隙增宽;与模型组相比,柚皮素给药可减轻肠上皮TJs 损伤;与高剂量柚皮素组相比,柚皮素+miR-22 antagomiR 组肠上皮TJs 损伤严重,见图3。

Figure 3. The effect of naringenin on tight junctions of intestinal epithelial cells in UC rats was observed under transmission electron microscope. →:tight junctions. A:control group;B:model group;C:low-dose naringenin group;D:high-dose naringenin group;E:naringenin+miR-22 antigomiR group.图3 透射电镜观察柚皮素对UC大鼠肠上皮细胞紧密连接的影响
6 柚皮素对UC 大鼠肠组织TJs 蛋白表达水平的影响
与对照组相比,模型组大鼠肠组织ZO-1、occludin和claudin-1的蛋白表达水平显著降低(P<0.05);与模型组相比,低、高剂量柚皮素组大鼠肠组织ZO-1、occludin和claudin-1的蛋白表达水平显著升高(P<0.05);与高剂量柚皮素组相比,柚皮素+miR-22 antagomiR 组大鼠肠组织ZO-1、occludin 和claudin-1 的蛋白表达水平显著降低(P<0.05),见图4。
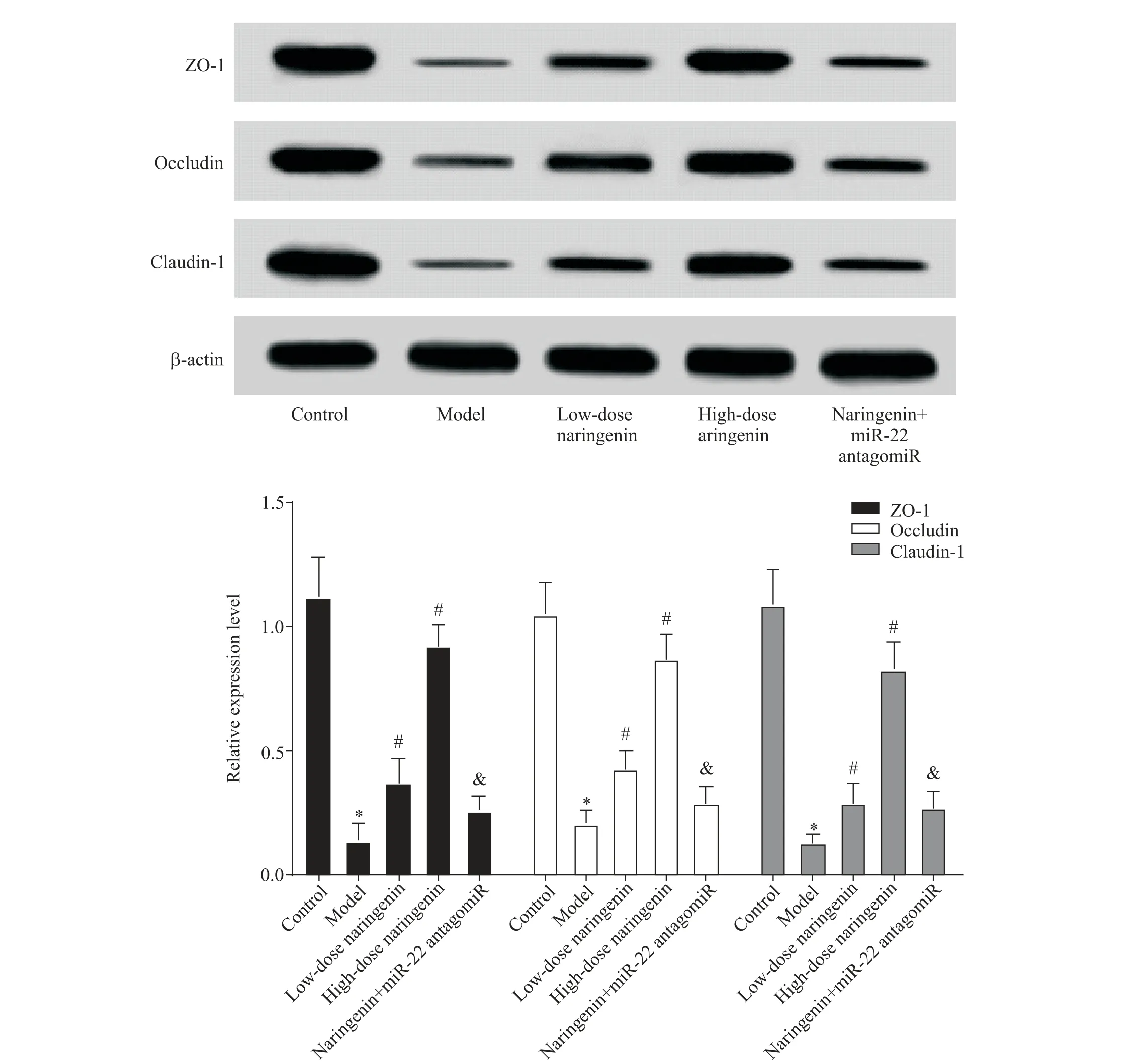
Figure 4. The expression of tight junction-related proteins in the intestinal tissue of UC rats. Mean±SD. n=10.*P<0.05 vs control group;#P<0.05 vs model group;&P<0.05 vs high-dose naringenin group.图4 紧密连接相关蛋白在UC大鼠肠组织中的表达
7 柚皮素对UC 大鼠肠组织NLRP3 蛋白表达水平的影响
与对照组相比,模型组大鼠肠组织NLRP3 的蛋白表达水平显著升高(P<0.05);与模型组相比,低、高剂量柚皮素组大鼠肠组织NLRP3的蛋白表达水平显著降低(P<0.05);与高剂量柚皮素组相比,柚皮素+miR-22 antagomiR 组大鼠肠组织NLRP3 的蛋白表达水平显著升高(P<0.05),见图5。
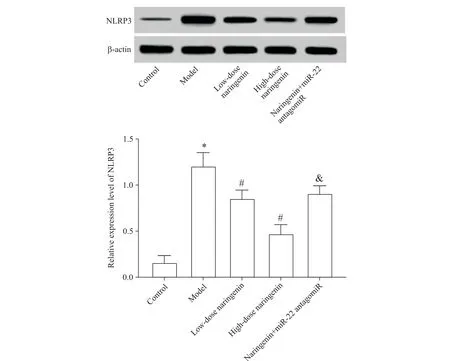
Figure 5. The expression of NLRP3 protein in the intestinal tissue of UC rats. Mean±SD. n=10.*P<0.05 vs control group;#P<0.05 vs model group;&P<0.05 vs high-dose naringenin group.图5 NLRP3蛋白在UC大鼠肠组织中的表达
8 miRNA-22与NLRP3靶向关系的预测与验证
通过microRNA.org 数据库分析得到,miR-22 与NLRP3 mRNA 序列之间存在互补(图6)。miR-22 NC+NLRP3 WT 组的萤光素酶活性为1.03±0.09,miR-22 mimics+NLRP3 WT 组的萤光素酶活性为0.57±0.06、miR-22 NC+NLRP3 MUT 组的萤光素酶活性为1.05±0.12,miR-22 mimics+NLRP3 MUT 组的萤光素酶活性为1.16±0.10。与miR-22 NC+NLRP3 WT 组相比,miR-22 mimics+NLRP3 WT 组的萤光素酶活性显著降低(P<0.05),miR-22 mimics+NLRP3 MUT 组和miR-22 NC+NLRP3 MUT 组的萤光素酶活性无明显变化(P>0.05)。

Figure 6. Bioinformatic prediction of the binding sites between miR-22 and 3′-untranslated region(UTR)of NLRP3.图6 生物信息学预测miR-22与NLRP3 3′-UTR的结合位点
讨 论
UC 是一种以慢性复发性炎症为特征的特发性炎症性肠道疾病,是结肠炎相关性结肠癌的危险因素。现有药物疗效有限,患者容易复发且疼痛难忍并需支付高昂的医疗费用。UC 患者表现出黏膜下水肿、溃疡、血性腹泻、粒细胞浸润等特征[11]。由于DSS 诱导的实验性UC 模型具有相似的临床表现,被认为是最成功和最合适的UC 模型制备方法之一[12-13]。DAI 评分是评价UC 严重程度的主要参数。因此,本研究采用DSS 诱导大鼠UC 模型,结果发现,UC 大鼠DAI 评分升高,肠组织黏膜结构破坏严重,黏膜及黏膜下层有出血、水肿及大量炎症细胞浸润,表明UC 大鼠模型构建成功。柚皮素是一种黄酮类化合物,主要存在于柑橘类水果和西红柿中。研究报道称,柚皮素具有抗炎、抗氧化应激、抗菌、抗肿瘤、抗糖尿病、保护神经和保护心脏等多种药理作用[14]。研究发现,柚皮素对DSS 诱导的小鼠肠水肿有一定的减轻作用。在本研究中,UC 大鼠经柚皮素治疗后,大鼠的DAI 评分显著降低,且肠组织结构损伤减轻,黏膜和黏膜下层仅有轻度或中度炎症细胞浸润。
UC 的发病机制尚不清楚,通常认为是多种因素共同作用的结果。其中,肠黏膜屏障功能在UC 的发生发展中起重要作用[15-16]。肠黏膜屏障是抵御恶劣环境的第一道屏障,主要由上皮细胞的紧密连接形成。TJs 由跨膜蛋白(occludins 和claudins)和辅助蛋白(zonula occludens,ZO)组成,以防止病原体和有害抗原在上皮内传播[17]。ZOs、occludin和claudins可封闭相邻肠上皮细胞之间的缝隙,并将抗原和微生物等物质保留在肠腔内,在维持肠道通透性、组织分化和内环境稳定方面起着重要作用[18]。因此,调节TJs以保持UC 上皮屏障的完整性至关重要。Nakashima等[19]研究发现,柚皮素和槲皮素等橘柑类黄酮可保障上皮细胞TJs 完整性。在本研究中,我们观察到UC 大鼠肠黏膜屏障受损,桥粒消失,细胞间隙增宽,经柚皮素治疗后,肠上皮TJs 损伤明显减轻,且肠组织ZO-1、occludin 和claudin-1 蛋白表达水平上调,表明柚皮素可促进TJs蛋白表达,从而维持肠黏膜屏障功能,减轻UC。
促炎细胞因子的产生是DSS 诱导结肠炎的一个标志,在这些细胞因子中,IL-1β 在肠道炎症中起重要作用。在本研究中,柚皮素以剂量依赖的方式成功地抑制了UC 大鼠IL-1β 水平的上调。IL-1β 产生需要caspase-1 激活,caspase-1 依赖于激活的炎症小体将IL-1β转化为成熟的活性形式。因此,炎症小体介导宿主对微生物病原体的防御,并促进炎症性疾病和结肠癌的发生发展[20]。NLRP3炎性小体是由核苷酸结合寡聚化结构域样受体(nucleotide-binding oligomerization domain-like receptors,NLRs)、含胱天蛋白酶募集结构域的凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a caspase recruitment domain,ASC)和胱天蛋白酶1(caspase-1)组成的多蛋白复合体[21]。NLRP3 是NLRP3 炎性小体的关键成分,其表达是NLRP3 炎症小体激活的限速步骤。因此,它的表达必须受到严格的调控。我们发现,UC 大鼠肠组织NLRP3 蛋白水平升高,在柚皮素的作用下,NLRP3蛋白水平下降,表明柚皮素可抑制NLRP3炎症小体的激活。
微小RNA(microRNA,miRNA,miR)是一种小的(18~24 个核苷酸)非编码RNA,在动植物中发挥着重要调控作用,是多细胞生物体中含量较丰富的基因调控分子之一。miRNAs 与特定靶标mRNA 的3′-UTR 的互补序列结合,可以阻止蛋白质合成。越来越多的证据表明miRNAs 在调节炎症过程中发挥着不可或缺的作用。我们研究发现,UC 大鼠肠组织中miR-22 水平显著下调。另外,经microRNA.org 数据库分析显示,miR-22 与NLRP3 具有靶向关系,miR-22 可负向调控NLRP3 炎症小体活性。已有研究发现,miR-22 可通过抑制NLRP3 炎症小体途径,降低促炎细胞因子水平,保护冠状动脉内皮细胞[22]。在本研究中,与高剂量柚皮素组大鼠相比,miR-22 antagomiR 处理可明显逆转柚皮素对UC 大鼠的改善作用,促进NLRP3 蛋白表达,造成严重的肠屏障损伤。因此我们推测,柚皮素可通过上调miR-22 水平,抑制NLRP3 炎症小体激活,减轻UC 大鼠炎症反应。
综上所述,柚皮素对DSS 诱导的肠上皮屏障功能障碍大鼠具有保护作用,其机制可能与miR-22 水平上调,抑制NLRP3 炎症小体激活有关。本研究表明柚皮素可作为治疗UC 的有效候选药物,具有潜在的临床应用价值。然而,充分了解柚皮素的治疗作用还需进行全面的安全性评估,尚需进一步研究和探索。

