非小细胞肺癌组织中T细胞免疫球蛋白区黏蛋白-3、程序性死亡因子-1及程序性因子配体1的表达分析
梁乐乐,王 鹏 ,刘俊霞, 董 玉,郭 华
(1.陕西省人民医院急诊科,陕西 西安 710068;2.西北工业大学医院,陕西 西安 710109; 3.西安市中心医院呼吸与危重症医学科,陕西 西安 710004)
肺癌为现阶段发病率和病死率较高的恶性肿瘤疾病,此种疾病发病因素较为复杂,非小细胞肺癌则为肺癌内发病率最高的肿瘤疾病,可占肺癌总数约80%左右。多数非小细胞肺癌患者被确诊后已经处于中晚期,且由于免疫系统失调,癌细胞可快速增殖并可转移至其他位置,使得患者预后效果较差,生存率较低。有研究认为,免疫系统在肿瘤转移和增殖过程中有重要作用[1-2]。在不同肿瘤免疫应答细胞内,T细胞免疫球蛋白区黏蛋白-3(T cell immunoglobulin domain mucin-3,TIM-3)可表达于多种细胞内,主要为:巨噬细胞、自然杀伤细胞(NK)以及单核细胞等,可有效调节机体自然免疫、特意性免疫,充分发挥负向免疫调节。程序性死亡因子-1(Programmed death factor-1,PD-1)和程序性因子配体1(Programmed factor ligand 1,PD-L1)则为负性T细胞刺激分子,可产生负性调节机制免疫应答,并可介导免疫逃逸[3-4]。免疫治疗属于现阶段疾病治疗热点,本次研究主要分析PD-1、PD-L1、TIM-3于非小细胞肺癌组织、正常组织内表达状况,进而判定各种指标和患者疾病之间关系,进而为疾病治疗提供新方向。
1 资料和方法
1.1 一般资料 选取2018年6月至2019年12月我院收治的67例非小细胞肺癌患者及健康患者60例。非小细胞肺癌患者中男34例,女33例,年龄55~70岁,平均(63.41±3.87)岁,高分化16例,中分化23例,低分化28例,TNMⅠ期13例,TNMⅡ期29例,TNMⅢ期25例,32例患者存在淋巴结转移。健康患者中男30例,女30例,年龄56~68岁,平均(62.94±4.03)岁。病例纳入标准:①患者首次确诊为非小细胞肺癌;②近期接受手术切除、放疗、化疗患者;③患者均签署知情同意书。排除标准:①合并其他恶性肿瘤患者;②合并肝肾功能异常患者;③合并严重恶化。两组研究对象的一般资料比较差异无统计学意义(均P>0.05),具有可比性。本研究获得医院医学伦理委员会审批。
1.2 实验方法 肿瘤细胞质、细胞膜有棕黄色颗粒时可判定为阳性。使用5个高倍视野×400,依据细胞染色强度进行评分(0分为五色;1分为浅黄色;2分为棕黄色;3分为棕褐色);阳性细胞率计分时:0分表示阴性,1分为阳性细胞0~10%;2分为阳性细胞11%~50%;3分为阳性细胞51%~75%;4分为阳性细胞76%~100%。染色强度×阳性细胞率为3分之上可判定为阳性。PD-1 阳性:低倍镜观察切片,随机选择5个高倍镜,观察阳性细胞数,平均值为PD-1阳性计数。所有患者出院之后均通过电话方式进行随访,主要随访内容为门诊复查以及住院信息,生存期,肿瘤转移和复发等状况。
1.3 观察指标 对比非小细胞肺癌患者临床指标变化。其中主要以不同检测方式阳性率为判定标准,判定TIM-3、PD-1、PD-L1阳性率。
2 结 果
2.1 非小细胞肺癌患者TIM-3、PD-1、 PD-L1阳性率比较 非小细胞肺癌组TIM-3、PD-1、PD-L1诊断时阳性率高于健康组,差异有统计学意义(均P<0.05),见表1。

表1 非小细胞肺癌患者TIM-3、PD-1、PD-L1阳性率比较[例(%)]
2.2 非小细胞肺癌患者临床指标和病理特征关系 男性、女性,不同年龄患者TIM-3、PD-1等指标阳性率比较差异无统计学意义(均P>0.05);无淋巴结、无转移、中高级患者、Ⅱ期患者PD-1、TIM-3等指标阳性率比较差异有统计学意义(均P<0.05),见表2。
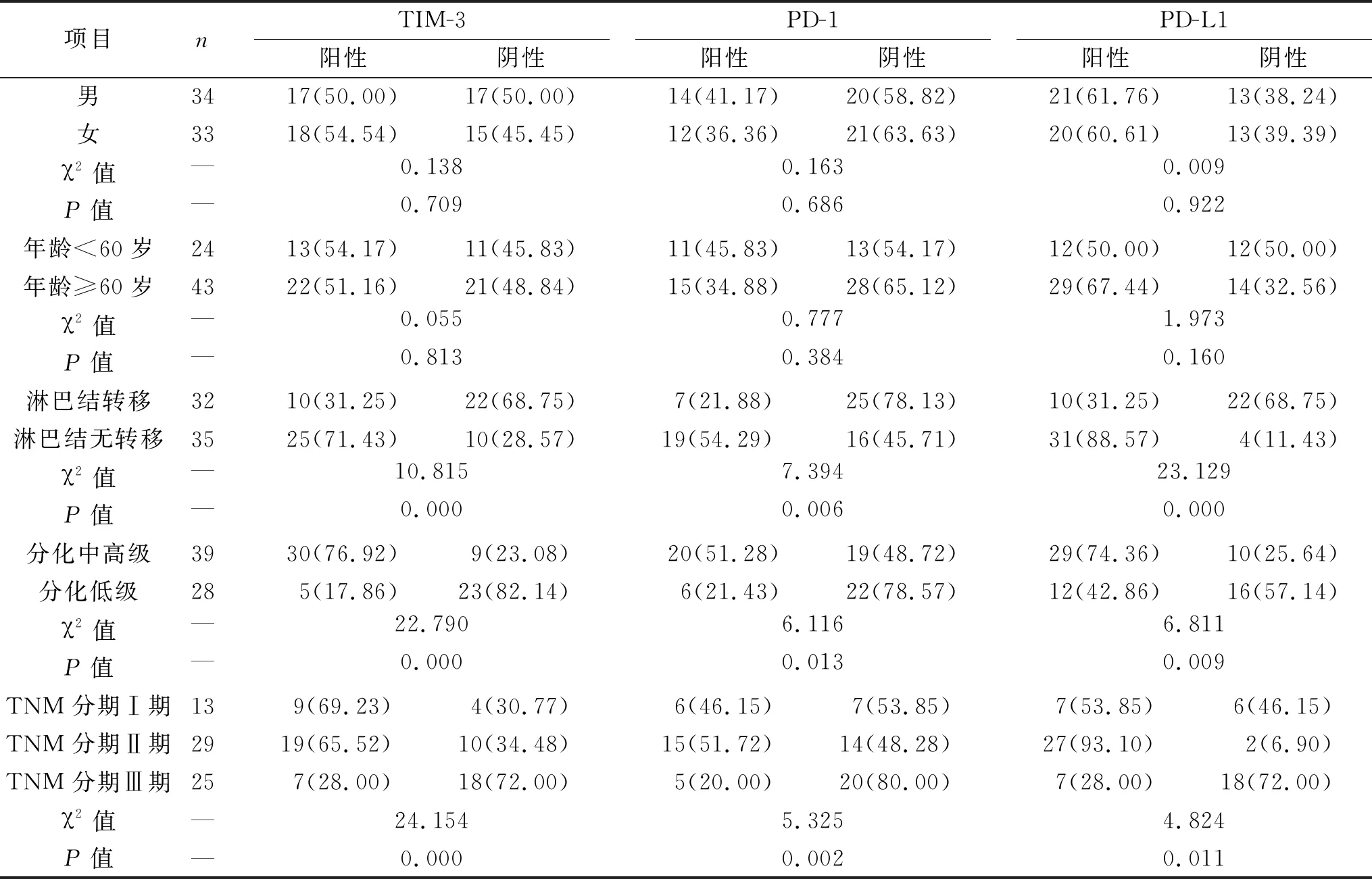
表2 非小细胞肺癌患者临床指标和病理特征关系[例(%)]
2.3 非小细胞肺癌患者TIM-3、PD-1、 PD-L1的Logistic回归分析 以研究TIM-3淋巴结转移、TIM-3分化、TIM-3TNM分期、PD-L1淋巴结转移、PD-L1分化、PD-L1TNM分期为自变量,以研究对象是否发生非小细胞肺癌疾病为因变量进行Logistic回归分析,结果见表3,TIM-3、PD-L1指标为独立判定患者肺小细胞癌指标。
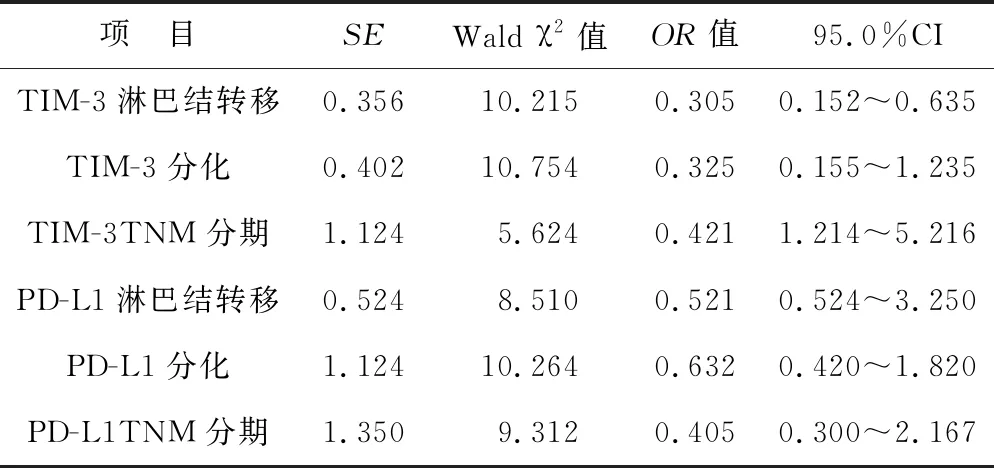
表3 非小细胞肺癌患者TIM-3、PD-1、PD-L1的Logistic回归分析
3 讨 论
肺癌为常见疾病,近年有发病率和病死率逐步提升趋势,严重威胁人们身体健康。多数患者诊断时已经处于晚期,传统治疗方式为化疗和放疗,虽然可控制疾病但改善效果远远无法满足人们真实需求,深入研究疾病和疾病内各指标的变化便十分重要[5-6]。肿瘤细胞在增殖和浸润、扩散过程中,巨噬细胞和炎症因子对于促使肿瘤血管生长有重要作用。巨噬细胞活化不仅可加速新陈代谢,同时也可通过免疫介导信号通路促进肿瘤细胞增殖和转移。T细胞为重要肿瘤免疫应答细胞,T细胞激活之后可有效控制肿瘤细胞生长,也可调控T细胞激活所需协同信号刺激,在各种免疫检查方法中主要分子为:TIM-3、PD-1、PD-L1三个指标均在肿瘤发展过程中起到重要作用。
TIM-3也可称之为HAVCR-2,此为TIM庞大家族重要成员,主要作用为调节免疫细胞功能。其中TIM-3基因结构和家族其他编码蛋白基因一样,结构较为复杂,其中主要包括多个结构域、横跨细胞膜。现阶段多数研究认为TIM-3可在多类型肿瘤细胞表达,且在生长和转移过程中可起到重要作用,且严重影响预后效果[7-9]。有学者提出,干扰脑胶质瘤内TIM-3表达之后药物杀伤作用可显著提升,该研究结果表示TIM-3参与恶性肿瘤耐药[10]。也有对于肺癌的研究发现,肺癌细胞上常会出现TIM-3表达,且PD-1仅于TIL上进行表达,无论为肿瘤细胞还是TIM-3阳性,均和患者高细胞毒性T细胞和CD8表面蛋白相关[11]。TIM-3主要出现在肿瘤细胞内,且和患者疾病恶化程度呈负相关关系。TIM-3高表达可引发免疫抑制、肿瘤免疫逃逸,当TIM-3和陪体Gal-9结合之后会诱导CTL、Th1细胞凋亡进而表现出免疫耐受。TIM-3也可通过控制T细胞扩增有效抑制树突状细胞活化进而出现肿瘤免疫逃逸。本次研究过程中发现,TIM-3检测时非小细胞肺癌阳性率可达52.23%之上,且随着患者淋巴结转移、疾病持续恶化、分化加剧可使得患者阳性率逐步提升。因此可知TIM-3在疾病发展和恶化过程中有重要作用,同时也影响患者生存的重要因素。也有研究提出随着TIM-3阳性率提升疾病恶化程度逐步提升,其中淋巴转移以及分期晚的阳性率显著高于无淋巴转移患者。该研究结果也表示,随着TIM-3高表达和患者恶性程度较高,更容易出现淋巴结转移。
PD-1、PD-L1则为负性共刺激分子免疫球蛋白超家族成员,PD-1主要出现在各种细胞内,主要为B细胞、T细胞以及树突状细胞,其中PD-L1主要出现在内皮细胞和B细胞内,食管癌和非小细胞肺癌患者也会出现[12]。PD-1也可称之为CD279,也为268-氨基酸蛋白质,主要出现于T细胞,也有少量表达在活化NKT细胞等免疫细胞,PD-L1也可和PD-L2特异性结合。其中PD-1和配体结合时可有效控制T淋巴细胞活化,也可引发肿瘤免疫逃逸。在多数研究中认为PD-1可在恶性肿瘤中出现表达异常,且可直接影响患者生活质量[13-14]。也有研究提出PD-1可直接参与恶性肿瘤转移,并和患者总生存率有关,随着PD-1水平提升患者生存率也逐步降低[15]。也有研究认为随着PD-1阳性率提升,肿瘤分化程度更为严重,且更易出现淋巴结转移,分期相对更晚,患者生存率也会受到影响[16]。
肿瘤微环境内,PD-L1/PD-1信号主要负责调控T细胞免疫应答,进而形成负性肿瘤环境,不仅会引发肿瘤免疫逃逸,同时在疾病发展过程中也有重要作用。分析本次研究过程数据时发现,PD-L1诊断时患者阳性率为61.19%,同时非小细胞肺癌患者阳性率和肿瘤大小、淋巴结转移情况呈正相关关系,随着疾病恶化逐步加剧阳性率呈逐步提升趋势[17-18]。当PD-1和PD-L1结合之后,可使得PD-1胞质区免疫受体酪氨酸抑制基序结合内酪氨酸磷酸化,也会使得SHP-2磷酸酶逐步提升,进而使得SHP-2磷酸酶可持续提升,引发Syk以及磷脂酞肌醇3各种下游分子去磷酸化,抑制喜好传导。淋巴细胞增殖活化以及辅助细胞T分化也会受到抑制,进而使得患者机体呈现免疫负调节。其中PD-1/PD-L1刺激分子也可使得免疫应答产生负调节,最终使得肿瘤免疫出现逃逸。也有学者提出,对于无禁忌证非小细胞肺癌患者,采用免疫检查和抑制剂治疗后,总有效率良好,此种治疗方式主要原理即为控制PD-1/PD-L1,使得患者产生抗性,其中TIM-3也可作为免疫抑制剂进行治疗[19-21]。因此可知TIM-3等指标不仅可用于诊断患者疾病,同时也可用于监测患者疾病恶化。
综上所述,非小细胞肺癌患者中TIM-3、PD-1、PD-L1的阳性率均较高,其中TIM-3、PD-L1可作为监测非小细胞肺癌的分子标志物,且各分子也有望成为疾病治疗新方向。

