人胃癌细胞Caveolin-1基因的表达与DNA甲基化修饰之间的关系研究
毛立祺 戴春艳 金威洋 傅宇斐 陈喆 吕宾 王曦
1.浙江中医药大学附属第一医院浙江省消化道疾病病理生理研究重点实验室 杭州 310006 2.湖州市第一人民医院 3.杭州师范大学生命与环境科学学院
胃癌是严重危害人类健康和生命的最常见恶性肿瘤之一,在世界所有癌症死亡率中排名第二[1]。胃癌发生早期,多数患者无明显症状,而多数患者诊断出胃时都已经发展为进展期胃癌。统计发现,超过50%的胃癌患者会选择外科手术治疗,但是术后约60%~70%会发生转移。一般而言,胃癌患者平均5年生存率约22%,其中晚期胃癌患者5年生存率小于5%[2-3]。
小窝蛋白-1或窖蛋白-1(Caveolin-1,Cav-1)分子量22kDa,是胞膜窖(caveolae)的标志性蛋白,是近年发现的一个候选抑癌基因,在很多生理和病理过程中扮演着重要的角色,不仅参与细胞内吞、胆固醇运输、信号转导、血管生成等过程,与肿瘤的发生、发展、浸润、转移等生物学行为也密切相关[4]。国内外研究发现,Cav-1在胃上皮细胞中的表达水平随着胃癌的发生和发展而呈进行性下调乃至缺失[5-7];而胃癌晚期,Cav-1的表达再次升高,且与胃癌晚期患者的不良预后密切相关[8]。研究表明,肿瘤晚期Cav-1的再次高表达能够提高肿瘤细胞侵袭、转移能力及对抗肿瘤药物的耐受能力,并抑制细胞凋亡,维持细胞存活[9-10]。由此可见,Cav-1在肿瘤发生、早期转化以及恶性发展中的作用存在异质性,但其具体的调控机制尚不清楚。研究发现,Cav-1基因的表达受到转录前水平和转录水平的调控,且该基因的表达变化与甲基化修饰导致的转录活性改变有关[11]。越来越多证据指出,基因的表观遗传学调控是引起基因转录活性改变,导致基因功能异常或丧失的主要形式[12-15]。因此,本研究拟探讨甲基化修饰对胃癌Cav-1基因表达的影响,以期为胃癌的临床治疗寻找新的治疗靶点。
1 材料和方法
1.1 材料
1.1.1 细胞 人正常胃黏膜上皮细胞(gastric epithelial cells,GES1)、人胃癌细胞系MGC-803和AGS均购于中国科学院细胞库/干细胞库。
1.1.2 主要试剂 洛斯韦尔·帕克纪念研究所(Roswell Park Memorial Institute,RPMI)1640培养基和F12培养基均购于美国Hyclone公司(批号:22400105、11765062);胎牛血清购于兰州民海生物有限公司(批号:SA112.02);含0.02%乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)的胰酶购于杭州吉诺生物有限技术公司(批号:GNM25200);逆转录试剂盒和荧光定量PCR试剂均购于大连宝生物技术有限公司(批号:RR036A、RR091A);总DNA/RNA提取试剂盒购于美国Omega Bio-tek公司(批号:R6731-001);甲基化荧光定量PCR试剂盒购于美国Zymo生物有限公司(批号:D5310)。
1.1.3 主要仪器和设备 DK-8D型电热恒温水槽购于上海精宏实验设备有限公司;Sorvall ST 16R型高速冷冻离心机、ABI 7900型实时荧光PCR仪和3131型二氧化碳培养箱均为赛默飞世尔科技公司产品;ND-1000型分光光度计购于基因有限公司。
1.2 方法
1.2.1 细胞培养 GES1、MGC-803和AGS细胞均采用含10%胎牛血清的RPMI 1640培养基,置于37℃、5% CO2的水套式细胞培养箱中培养。
1.2.2 实时荧光定量聚合酶链式反应(Real-time quantitative polymerase chain reaction,Real-time qPCR)检测Cav-1基因的mRNA水平 使用总DNA/RNA提取试剂盒,同时提取各细胞系的基因组DNA和总RNA。总RNA定量后,反转录为cDNA,采用β-actin作为内参(NM_001101.3),以Real-time qPCR分别检测各细胞系的Cav-1、Cav-1α和Cav-1β的mRNA表达水平,其中Cav-1的引物检测区域包含了Cav-1α和Cav-1β两种亚型的蛋白质编码 (coding sequence,CDS)区;Cav-1α的引物检测区域仅包含Cav-1α的CDS区(NM_001753.4);Cav-1β的引物检测区域仅包含Cav-1β的CDS区(NM_001172895.1),引物序列见表1。以反应达到阈值所需的循环数(cycle threshold,CT)值,来计算每种基因mRNA的相对表达量。

表1 Real-time qPCR引物序列Tab.1 Primer sequences of Real-time qPCR
1.2.3 甲基化荧光定量PCR检测Cav-1α甲基化水平分别取MGC-803和AGS细胞基因组DNA 20ng,与一步法甲基化荧光定量PCR试剂盒内的检测缓冲液和参照缓冲液混合后,转入384孔板内,以人全甲基化和未甲基化DNA为对照,对Cav-1α启动子区甲基化水平进行检测,检测缓冲液组反应达到阈值所需的循环数为CT检测值,参照缓冲液组的循环数为CT参照值,以两者之差来计算不同胃癌细胞株该区域的甲基化水平,甲基化水平=100×2CT检测值-CT参照值,引物序列见表2。

表2 甲基化Real-time qPCR引物序列Tab.2 Primer sequences of Real-time qPCR for methylation detection
1.3 统计学分析 应用SPSS 16.0统计软件进行统计学分析。正态分布的计量资料以±s表示,两组间比较采用t检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 人Cav-1基因的表达与其亚型的关系 Real-time qPCR结果发现,MGC-803细胞系的Cav-1表达为GES1细胞的(1.782±0.489)倍,差异具有统计学意义 (P<0.05),而AGS1中Cav-1的表达是GES1的(0.017±0.002)倍,差异具有统计学意义(P<0.001)。见图1A。由此,本研究筛选到了Cav-1高表达和Cav-1低表达的胃癌细胞系,进一步分别检测了三个细胞系Cav-1α和Cav-1β的mRNA表达水平,结果发现MGC-803细胞中Cav-1α的mRNA表达水平是GES1细胞的(2.604±0.945)倍,差异具有统计学意义(P<0.01);而AGS细胞中Cav-1α的mRNA表达是GES1细胞的(0.0005±0.00003)倍,差异同样具有统计学意义(P<0.001)。见图1B。MGC-803和AGS细胞比较,Cav-1β的mRNA表达差异均无统计学意义(P>0.05)。见图1C。以上结果提示,对于人胃癌细胞系Cav-1基因mRNA的表达水平的改变主要与其α亚型的表达改变有关。

图1 GES1、MGC-803和AGS细胞中Cav-1基因及其两种亚型的mRNA表达情况比较Fig.1 Comparison of the expression of Cav-1 and its two isoform mRNA in GES1,MGC-803 and AGS cell
2.2 人Cav-1基因磷酸胞苷酰(基)鸟苷(cytidylyl phosphate guanosine,CpG)岛的预测 利用在线软件MethPrimer -Design Primers for Mehtylation PCRs(http://www.urogene.org/methprimer/indexl.html),针对Cav-1α的启动子区和第一外显子区的CpG岛区域进行预测和分析。结果发现,仅Cav-1α的启动子区存在CG位点富集的CpG岛区域,大小为174bp,包含了17个CG位点。根据甲基化限制酶的酶切位点,将该段CpG岛分为两个片段进行分析和检测,以转录起始位点(transcription start site,TSS)为+1,第1个片段在TSS的上游-250~-159的区域内,包含7个CG位点;第2个片段在TSS上游的-158~-77的区域内,包含10个CG位点。见图2。

图2 人Cav-1α基因CpG岛预测Fig.2 Analysis in the CpG island of human Cav-1α gene
2.3 不同胃癌细胞系人Cav-1基因CpG岛内的甲基化水平比较 针对上述CpG岛内的两个区域,经过甲基化qPCR检测发现,对于MGC-803(Cav-1+/+)细胞系而言,第1个区域的甲基化水平为(41.4±11.0)%,第2个区域的甲基化水平为(5.6±0.6)%;对于AGS(Cav-1-/-)细胞系而言,第1个区域的甲基化水平为(12.9±6.6)%,第2个区域的甲基化水平为(75.2±27.6)%。 见图3。 由此可见,MGC-803(Cav-1+/+)细胞系Cav-1α的高表达与其启动子区第2个区域的低甲基化水平相一致,同样AGS(Cav-1-/-)细胞系Cav-1α的低表达与其启动子区第2个区域的高甲基化水平相符合。由此推测,胃癌细胞系中Cav-1α的mRNA表达水平可能与其基因启动子区第2个区域内的10个CG位点的甲基化修饰程度密切相关。
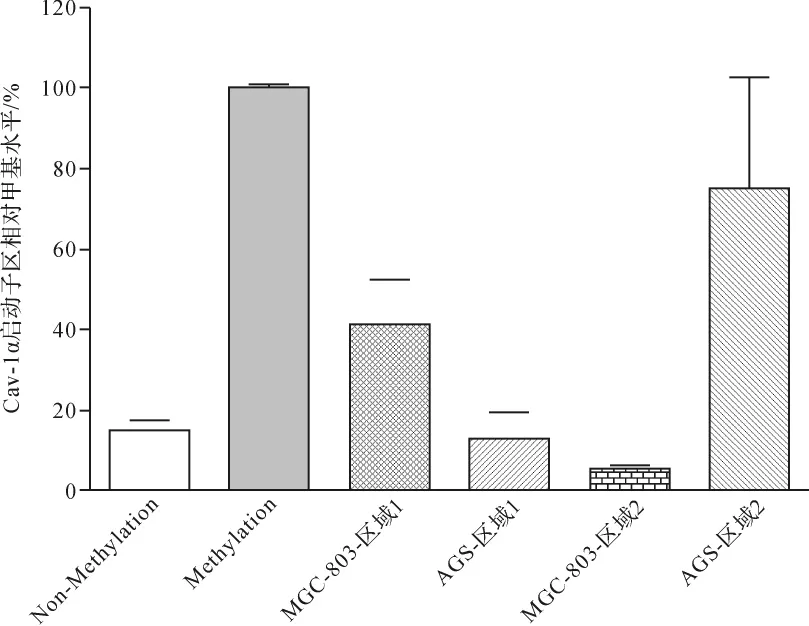
图3 MGC-803和AGS细胞Cav-1α基因启动子区的甲基化水平比较Fig.3 Comparison of methylation level of Cav-1α at the promoter region in MGC-803 and AGS cell
3 讨论
胞膜窖(Caveolae)是存在于分化的上皮和间充质细胞胞膜上的烧瓶状胞膜内陷结构[16],该结构的存在有利于多种受体和信号分子如蛋白激酶、G蛋白和黏附分子在胞膜上的富集,并为多种信号分子之间的相互作用提供场所[17]。Cav-1即窖蛋白-1,具有α和β两种亚型,是胞膜窖重要的标志性结构蛋白,其作为肿瘤抑制因子,调节细胞的信号转导、细胞增殖、分化、侵袭、黏附、细胞凋亡和代谢等多个过程[18],参与肿瘤的发生和转移[17]。
以往研究认为,Cav-1表达下调可以导致促细胞增殖的丝裂原激活蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路和促细胞存活的磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)信号通路的过度活化[19],参与肺癌、卵巢癌、结肠癌和骨肉瘤等多种肿瘤的早期转化和发展[20-23]。然而,近年来研究表明Cav-1具有抗凋亡、促进肿瘤侵袭和迁移和提高肿瘤耐药的潜力[24-27]。在卵巢癌顺铂耐药细胞株[28]、结直肠癌5-氟尿嘧啶耐药细胞株[29]、肺腺癌多药耐药细胞株[30]中,均检测到Cav-1的高表达,提示化疗耐药与Cav-1表达上调密切相关。由此可见,Cav-1在肿瘤发生发展的多个阶段存在差异性表达的特点,而其表达水平的高低与不同时期肿瘤细胞生物学行为差异密切相关。因此,阐明影响Cav-1基因表达的调控机制,有利于在肿瘤进展的不同阶段获得针对性干预靶点。研究发现,我国传统中药能够通过对靶点蛋白的表观遗传学调控,实现对胃癌的治疗作用[31]。由此可见,深入阐明Cav-1基因的甲基化修饰机制也可为中药抗肿瘤治疗提供更多实验依据。
本研究分别选择Cav-1高表达和低表达的胃癌细胞株MGC-803和AGS,试图寻找影响胃癌细胞中Cav-1基因表达变化的原因,并进一步探索不同胃癌细胞中Cav-1基因的两种亚型Cav-1α和Cav-1β的表达差异。结果发现,Cav-1基因的mRNA表达与其α亚型的mRNA水平相一致,而与β亚型的表达无明显关系。以往研究证实,DNA的甲基化往往抑制基因的活化,而DNA的去甲基化则能够诱导基因的重新活化和表达。本研究发现,在MGC-803细胞中Cav-1α TSS的上游-158~-77区域内的CG位点的甲基化修饰水平非常低,仅为5.6%;而其mRNA表达水平是正常胃上皮细胞的2.6倍;而AGS细胞的mRNA表达水平仅为正常胃上皮细胞的0.0005倍,相同启动子区的甲基化水平高达75.2%。可见,DNA甲基化的修饰程度直接关系到其mRNA表达水平的高低,并且与Cav-1α基因的转录活性呈负相关。本研究提示该区域内10个CG位点的甲基化修饰程度与Cav-1α基因的转录调控密切相关,而具体哪个位点或哪些位点的表观修饰水平影响了Cav-1基因的表达,参与了胃癌哪一特定的发生发展阶段,非常值得进一步深入研究。
综上所述,胃癌细胞Cav-1基因的表达高低主要取决于其编码的α亚型,并且其启动子区-158~-77的甲基化程度决定了Cav-1α基因的转录激活水平。该结果提示基因的甲基化修饰机制可能是影响Cav-1基因表达的关键调控途径,Cav-1α亚型的甲基化修饰的改变可能是造成其在胃癌发生不同阶段表达水平不同的主要原因,这一证据可以为胃癌早期诊断以及胃癌晚期化疗方案的制定提供一定的科学依据。

