茶皂素对临床常见致病菌的抗菌活性及作用机制研究
刘静,谢朋飞,蔡延渠
(1.郴州市第一人民医院药学部,湖南郴州 423000;2.广东药科大学新药研发中心,广东广州 510006;3.国家中医药管理局中药制剂实验室(三级),广东广州 510006;4.广东省教育厅现代中药重点实验室,广东广州 510006)
2009年国务院颁布的《全国油茶产业发展规划(2009-2020年)》中提出,到2020年,全国茶油产量将达250多万吨、年产值近千亿元[1]。据相关数据统计显示[2],2019年我国油茶籽年产量已达262万吨,以湖南、江西、广西为主产区。在选取油茶籽进行榨油后,残余的巨量油茶果壳多作为废料进行焚烧等处理,造成极大的资源浪费与环境污染。
茶皂素是五环三萜类皂苷化合物,由糖体、酸基等结合而成。茶皂素具有广泛的功能作用与生物活性[3-6],如表面活性剂(发泡、乳化等)、溶血作用、抗菌、抗氧化、抗炎、抗高血压、抗癌、降脂、杀虫驱虫等。本课题组前期在研究油茶果壳多糖的过程发现,其提取物在提取、浓缩过程中发泡现象十分明显,结合相关研究资料[7-8],推测其茶皂素含量较高,值得进一步的研究。因此,本文拟对油茶果壳中茶皂素进行抗菌活性评价及作用机制的初步分析,为油茶果壳的多元化利用和高附加值转化进行探索,并进一步明确油茶果壳茶皂素抑杀临床常见致病菌的可行性,为研发低毒有效的抗菌剂或抗菌增效剂提供基础资料和科学依据。
1 材料
1.1 菌株
ATCC 1228表皮葡萄球菌(Staphylococcus Epi‐dermidis)、ATCC 6538金黄色葡萄球菌(Staphylococ‐cus aureus)、ATCC 700603肺炎克雷伯菌(Klebsiella Pneumoniae)、ATCC 49103变形杆菌(Proteus vul‐garis)、ATCC 14028沙门氏菌(Salmonella)、ATCC 9027铜绿假单胞菌(Pseudomonas aeruginosa)、ATCC 8739大肠杆菌(Escherichia coli)、ATCC 43300福氏痢疾杆菌(Shigella flexneri),均来源于广东省微生物研究所。
1.2 试药
茶皂素(质量分数>90.0%),课题组自制;盐酸环丙沙星粉(USA);环丙沙星药敏片(10 μg/片,杭州天和微生物试剂有限公司);PBS缓冲液(北京索莱宝科技有限公司);营养肉汤培养基(批号:1094671,广东环凯微生物科技有限公司);M-H琼脂培养基(批号:20200516,青岛海博生物技术有限公司);罗丹明123(上海源叶生物科技有限公司);碱性磷酸酶(AKP)测试盒(南京建成生物工程有限公司)。
1.3 主要仪器
恒温培养箱(上海一恒科学仪器有限公司);SW-CJ-2FD型双人单面净化工作台(苏州净化科技设备有限公司);DHG-9023A型电热恒温鼓风干燥箱(上海精宏实验设备有限公司);HHS2-4型电热恒温水浴锅(上海博迅实业有限公司医疗设备厂);LX-B50L型立式自动电热压力蒸汽灭菌器(合肥华素医疗设备有限公司);iMark酶标仪、IQ5型荧光定量PCR仪(美国BIO-RAD公司);RF-5301PC型荧光分光光度计(日本岛津公司)。
2 方法
2.1 药液配制
称取一定质量的茶皂素粉末于容量瓶中,加入纯水定容,配制成质量浓度为50.0 mg/mL的贮备液,再按照对半稀释法依次稀释成25.0、12.5、6.25、3.13、1.56、0.78、0.39、0.20、0.098、0.049 mg/mL的系列浓度样品溶液;同法以水溶解环丙沙星粉末,配制成质量浓度为50.0、25.0、12.5、6.25、3.13、1.56、0.78、0.39、0.20、0.098、0.049 μg/mL的系列浓度阳性对照溶液,冰箱4℃保存备用。
2.2 菌液制备
将表皮葡萄球菌等菌株于-70℃冰箱中取出,在M-H琼脂板上划线,37℃培养20 h,挑取形态良好的单菌落于营养肉汤培养基中37℃培养18~20 h,取出后摇匀,采用比浊管进行比对,调节菌液浓度至0.5个麦氏浊度(1×108CFU/mL),再进一步稀释至1×106CFU/mL,冰箱4℃贮存备用。
2.3 茶皂素的体外抗菌活性测定
2.3.1 抑菌环直径测定 参考文献[9]进行操作。采用K-B纸片法,吸取质量浓度为10.0 mg/mL的茶皂素溶液5 μL于6.0 mm纸片上,烘箱50℃烘干,制成每片含50 μg茶皂素的药敏片。吸取浓度为1×106CFU/mL的菌液0.1 mL,于M-H琼脂板上涂布均匀,稍晾干,将茶皂素、环丙沙星药敏片贴放于菌板上,37℃倒置培养20 h,取出用游标卡尺测量抑菌环直径。每个样品平行3份。
2.3.2 MIC及MBC测定 参考文献[9]进行操作。采用微量稀释法,吸取“2.1”项下不同浓度茶皂素溶液各100 μL于96孔板中(每排的第1~11孔),再依次加入1×106CFU/mL的菌液100 μL,混匀,使得孔中茶皂素终质量浓度依次为25.0、12.5、6.25、3.13、1.56、0.78、0.39、0.20、0.098、0.049、0.024 mg/mL;第12孔加入无菌纯水和菌液各100 μL,作为阴性对照。加样后,将96孔板37℃培养20 h,取出观察孔中有无细菌生长,判定MIC;同时选择茶皂素质量浓度为MIC、2MIC、4MIC的菌悬液,分别吸取20µL于M-H琼脂板上涂匀,37℃培养18~20 h,取出观察计数,以≤5个菌落数者为MBC。同法测定环丙沙星阳性对照溶液的MIC及MBC。
2.4 茶皂素的抗菌作用机制研究
根据活性评价结果,选取革兰阳性菌——金黄色葡萄球菌、革兰阴性菌——福氏痢疾杆菌为代表进行抗菌作用机制的初步研究。实验主要参考文献[10-12]操作,并进行适当改变。
2.4.1 茶皂素对致病菌生长特性的影响 设置茶皂素不同质量浓度组(1/2MIC、MIC、2MIC)、空白对照组,茶皂素组中分别加入一定浓度药液和菌液,使其混合液终质量浓度为1/2MIC、MIC、2MIC;空白对照组中只加入同量的无菌纯水和菌液。放入恒温培养箱中37℃培养,于24 h内每隔2 h取出混合培养液,采用酶标仪测定波长600 nm处的吸光度(A600)值,以时间为横坐标,A值为纵坐标绘制生长抑制曲线,考察不同浓度茶皂素在不同时间点对不同受试菌株生长的影响。
2.4.2 茶皂素对致病菌细胞壁通透性的影响 设置茶皂素不同浓度组(1/2MIC、MIC、2MIC)、空白对照组,茶皂素组中分别加入一定浓度药液和菌液,使其混合液终质量浓度为1/2MIC、MIC、2MIC;空白对照组中只加入同量的无菌纯水和菌液。放入恒温培养箱中37℃培养12 h,每隔2 h将混合培养液取出,6 000 r/min低温离心15 min,取上清液,按照碱性磷酸酶试剂盒说明书上的操作测定AKP活性,考察不同浓度茶皂素对不同受试菌株细胞壁通透性的影响。
2.4.3 茶皂素对致病菌细胞膜电位的影响 设置茶皂素不同浓度组(1/2MIC、MIC、2MIC)、空白对照组,茶皂素组中分别加入一定浓度药液和菌液,使其混合液终质量浓度为1/2MIC、MIC、2MIC;空白对照组中只加入无菌纯水和菌液。放入恒温培养箱中37℃培养,于0、2、4、6、8 h取出混合培养液,6 000 r/min低温离心15 min,收集菌体沉淀物,用0.01 mol/L的PBS缓冲液冲洗3次,再加入终质量浓度为2 μg/mL的罗丹明123,放置阴暗处避光反应0.5 h,然后继续用0.01 mol/L的PBS缓冲液对处理后的菌液冲洗3次,采用荧光分光光度计,在激发波长为480 nm、发射波长为530 nm条件下测定样品荧光强度,考察不同浓度茶皂素对不同受试菌株细胞膜电位的影响。
2.4.4 茶皂素对致病菌细胞内溶物的影响 设置茶皂素不同浓度组(1/2MIC、MIC、2MIC)、空白对照组,茶皂素组中分别加入一定浓度药液和菌液,使其混合液终质量浓度为1/2MIC、MIC、2MIC;空白对照组中只加入无菌纯水和菌液。放入恒温培养箱中37℃培养6 h,取出混合培养液,6 000 r/min低温离心15 min,取上清液,采用酶标仪测定A260值,考察不同浓度茶皂素对不同受试菌株细胞内核酸含量的影响;同时按照BCA试剂盒说明书上的操作测定蛋白质含量,考察不同浓度茶皂素对不同受试菌株细胞内蛋白质含量的影响。
2.5 统计学分析
采用SPSS 20.0统计软件进行数据分析,实验数据以表示,采用方差分析及t检验,P<0.05为差异有统计学意义。
3 结果与分析
3.1 茶皂素的体外抗菌活性评价
茶皂素对受试菌株的抑菌环直径范围为10.86~17.31 mm,MIC值范围为0.20~1.56 mg/mL,MBC值范围为0.39~3.13 mg/mL;环丙沙星对受试菌株的抑菌环直径范围为23.88~31.56 mm,MIC值范围为0.78~3.12 μg/mL,MBC值范围为1.56~6.25 μg/mL,见表1。可知,茶皂素对表皮葡萄球菌、金黄色葡萄球菌的敏感性最强,其次为变形杆菌、沙门氏菌、铜绿假单胞菌、福氏痢疾杆菌,最弱为肺炎克雷伯菌、大肠杆菌。抑菌环直径的敏感性高低与MIC值的抑制作用强弱表现出良好的相关性。与抗生素环丙沙星相比,茶皂素对所有受试菌株的抑菌环直径、MIC、MBC差异均具有统计学意义(P<0.01),表明茶皂素的抗菌作用弱于环丙沙星。

表1 8种致病菌株的体外抑菌活性Table 1 In vitro antibacterial activity of 8 pathogenic strains(n=3)
3.2 茶皂素的抗菌作用机制评价
3.2.1 茶皂素对致病菌的生长抑制曲线 不同浓度茶皂素在不同时间点作用于金黄色葡萄球菌、福氏痢疾杆菌后的A600值,变化趋势见图1。金黄色葡萄球菌、福氏痢疾杆菌,空白组(水)分别在培养8 h、6 h后开始进入对数生长,1/2MIC、MIC茶皂素组分别在10 h、6 h和20 h、20 h开始呈现对数生长;而2MIC茶皂素组则在24 h内基本不增长。结果显示,茶皂素在1/2MIC浓度时,对金黄色葡萄球菌、福氏痢疾杆菌的正常生长繁殖稍有影响,而当浓度增加至MIC、2MIC时,能够显著地抑制其生长(P<0.01),抑制作用强弱与药物浓度及作用时间呈现正相关。
3.2.2 茶皂素对致病菌的细胞壁通透性的影响 不同浓度茶皂素在不同时间点作用于金黄色葡萄球菌、福氏痢疾杆菌后的培养液中AKP含量,变化趋势见图2。对于金黄色葡萄球菌和福氏痢疾杆菌空白组,其胞外的AKP含量均极低,当茶皂素浓度为1/2MIC时,胞外AKP含量略微增加,但差异无统计学意义(P>0.05);而随着浓度增加至MIC、2MIC时,2种受试菌株的细胞壁均受到明显的破坏,因此导致胞外AKP含量均明显增加(P<0.01)。结果亦显示,随着药物浓度的提高,细胞壁受损程度越大,细菌胞外的AKP含量越多,具正相关。
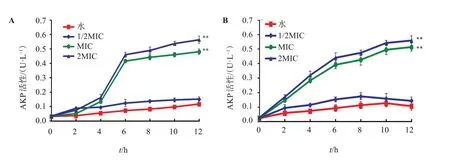
图2 不同浓度茶皂素对受试菌株细胞外AKP含量的影响Figure 2 Effects of different concentrations of tea saponin on extracellular AKP content of tested strains
3.2.3 茶皂素对致病菌的细胞膜电位的影响 不同浓度茶皂素在不同时间点作用于金黄色葡萄球菌、福氏痢疾杆菌后的菌液荧光强度,变化趋势见图3。未加入茶皂素前,两种受试菌菌液的荧光强度均基本保持平衡,随着时间变化略微上升;加入1/2MIC的茶皂素后,荧光强度稍有下降,但差异无统计学意义(P>0.05)。当增大浓度至MIC、2MIC时,金黄色葡萄球菌的菌液荧光强度在2 h内由354.52 AU、350.86 AU分别快速下降至91.92 AU与73.82 AU,福氏痢疾杆菌的菌液荧光强度在2 h内由394.84 AU、385.81 AU分别快速下降至121.54 AU与76.10 AU,与对照组相比差异均具有统计学意义(P<0.01)。主要是由于细胞膜完整性受到严重破坏,引起跨膜电位下降,细胞发生去极化,亲脂性阳离子物质罗丹明123从细胞中释放出来,导致细胞内荧光强度显著性降低。结果表明茶皂素能够有效影响菌体细胞的代谢活动,从而破坏其正常生长繁殖。
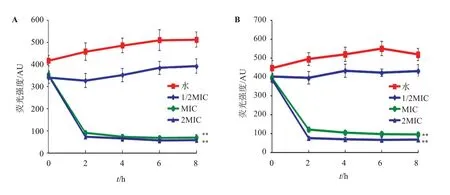
图3 不同浓度茶皂素对受试菌株细胞膜电位的影响Figure 3 Effects of different concentrations of tea saponin on cell membrane potential of tested strains
3.2.4 茶皂素对致病菌的细胞内容物的影响 不同浓度茶皂素在作用于金黄色葡萄球菌、福氏痢疾杆菌6 h后的细胞外核酸和可溶性蛋白质含量,比较结果见图4~图5。空白组(水)随着培养时间的增长,细胞正常生长繁殖,细胞内特有物质——核酸(如DNA、RNA等)、蛋白质等的含量亦随着上升;当加入茶皂素至1/2MIC时,对细胞膜未产生明显的破坏作用,因此胞外核酸、蛋白质含量无显著性提高(P>0.05);而当2MIC加入茶皂素至MIC、2MIC时,药物浓度的增加引起细菌细胞膜的破裂,内容物溢出,因此导致胞外核酸、蛋白质含量的显著性上升(P<0.01)。结果表明,茶皂素具有破坏受试菌株细胞膜完整性的作用,且表现浓度依赖性。
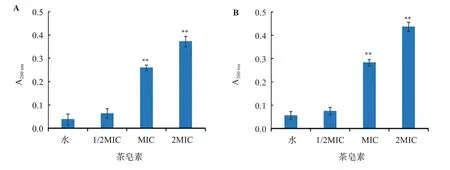
图4 不同浓度茶皂素对受试菌株细胞外核酸含量的影响Figure 4 Effects of different concentrations of tea saponin on extracellular nucleic acid content of tested strains
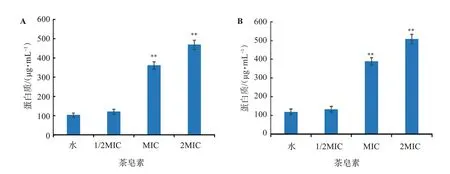
图5 不同浓度茶皂素对受试菌株细胞外可溶性蛋白含量的影响Figure 5 Effects of different concentrations of tea saponin on the content of extracellular soluble protein of tested strains
4 讨论
目前,在临床上出现越来越多的致病菌产生耐药性,导致现有的抗菌药物正逐步失效、甚至无效,迫切需要开发出新的抗菌剂或通过相关技术方法提升现有药物的抗菌活性。本文利用油茶果壳为原料制备出高纯度的茶皂素,通过体外抗菌活性评价,明确其对表皮葡萄球菌、金黄色葡萄球菌的抗菌作用最强(抑菌环直径为16.32 mm、15.63 mm,MIC均为0.39 mg/mL、MBC均为0.78 mg/mL);抗菌作用机制研究中,发现当茶皂素浓度达到MIC、2MIC时,能够破坏金黄色葡萄球菌、福氏痢疾杆菌的细胞壁与细胞膜结构和功能的完整性,引起细胞内容物AKP、核酸、蛋白质的渗出及降低细胞膜电位,影响菌体细胞的正常代谢,同时进一步诱导细胞死亡,从而发挥抑制其生长的作用,并且作用强度与药物浓度成正相关。
虽然与现有抗生素相比,茶皂素在体外的抗菌作用仍较弱,但是其原料(油茶籽、油茶果壳等)来源十分丰富,因此生产成本低廉,同时还具备无残留、无毒副作用、不易产生耐药性、抗菌谱广等优势,值得进一步开展更为系统全面的体内外抗菌活性、联合用药等评价,为其开发为天然抗菌剂或抗菌增效剂奠定基础,从而有望广泛应用于动物养殖、医药卫生、化妆品及日用品等领域,实现降抗、替抗愿景。

