海参居维氏管研究进展
吴伟东,原丽红
(广东药科大学生命科学与生物制药学院,广东广州 510006)
海参(Sea cucumbers,holothurians)属于棘皮动物门(Echinodermata)海参纲(Holothuroidea,Holothurioi‐dea)。在全世界范围内,海参约有1 400种,其中可食用的有60余种,多数为热带或亚热带种类,主要集中在刺参科(Stichopodidae)和海参科(Holothuriidae)[1]。在我国海域分布的海参有134种,可食用的有21种,仅仿刺参(Apostichopus japonicus)属于温带种,分布在黄海和渤海海域,其余20种均为热带种,分布在南海。《中国渔业统计年鉴2019》的数据显示,2018年我国海参养殖面积达2.4万hm2,产量达17.4万t,其中辽宁省和山东省分别达到1.4万hm2和8.8万hm2[2],广东、福建等东南沿海一带海参的养殖正逐步规模化。由于海参不易保存,除了直接煮食外,大多被加工成干海参、盐渍海参等。有数据表明,2018年全球干海参产量已经达到3.93万t,产值达161.26亿美元。目前海参消费市场主要在亚洲,2019年仅我国国内的干海参消费量就已达4 242 t(产量4 484 t),该数据还在持续上升[3]。
在海参加工过程中,海参的内脏被当作废料丢弃(内脏约占体质量的15%~55%)。如果能将海参内脏回收利用,可大大提高海参养殖的经济效益。海参科中部分海参有一种重要的防御器官,位于海参的泄殖腔附近,被称作居维氏管(Cuvierian tubules)。当海参受到威胁或外来刺激时,会通过神经传导信号使放射肌及体壁环肌强力收缩,在排泄腔附近产生裂缝把居维氏管从该裂缝压入排泄腔,进而从肛门排出。居维氏管在排出时会伸长,碰到物体时会有较强的黏附性,进而缠绕和驱赶捕食者[4]。此外,有研究表明,居维氏管中含有丰富的海参皂苷,具有提高免疫力、抗肿瘤、抗菌、抗癌等多种生物活性[5]。《世界重要经济海参种类》[6]和《中国动物志·棘皮动物门·海参纲》[4]记录,我国有8种海参具有居维氏管,分别是玉足海参(Holo‐thuria leucospilota)、蛇目白尼参(Bohadschia argus)、图纹白尼参(Bohadschia marmorata)、格皮氏海参(Pearsonothuria graeffei)、棘辐肛参(Actinopyga echi‐nites)、子安辐肛参(Actinopyga lecanora)、白底辐肛参(Actinopyga mauritiana)、乌皱辐肛参(Actinopyga mili‐aris)。目前,玉足海参的规模化繁育与苗种培育已获得成功,预示着热带海参养殖进入新的发展阶段[7]。随着我国热带海参规模化养殖产业的发展,为居维氏管的精深加工及在创新药物研发中的应用提供了物质保障。
为充分了解居维氏管的研究与开发现状,笔者首先在世界知识产权组织WIPO网站(https://patent‐scope2.wipo.int/search/zh/search.jsf)和中国国家知识产权局专利检索及分析系统(http://pss-system.cnipa.gov.cn/sipopublicsearch/portal/uiIndex.shtml)中通过关键词“居维氏管(Cuvierian tubule)”检索,发现仅有2个专利(102016001094595和201811098258.4),这2项专利均是关于海参内脏的应用,其中居维氏管作为海参内脏中的一部分被提到。随后,笔者在Googlescholar对居维氏管(Cuvierian tubule)分别用中、英文检索,发现关于居维氏管的相关研究文献共有43篇,最早报道见于1957年,2014年至今有13篇文献,国内暂无相关研究。这40多篇文献大部分集中于海参居维氏管的力学(37%)、提取物活性(35%)、组织结构功能(19%)的研究,关于居维氏管的再生只有1篇,可作为以后居维氏管着重研究的方向(图1)。
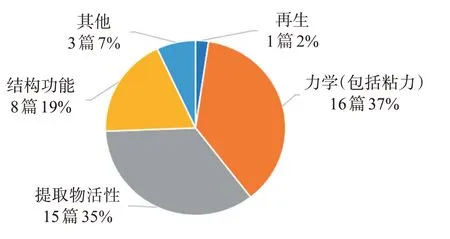
图1 海参居维氏管研究领域分布Figure 1 Research field distribution of sea cucumber cuvi‐erian tubles
1 居维氏管的组织结构和成分
居维氏管包括分支居维氏管和平滑居维氏管,分支居维氏管只出现在辐肛参属中,辐肛参的居维氏管不能排出且不具有黏性,所以不具有防御作用[8];而平滑居维氏管出现在白尼参属、海参属、皮氏海参属中,虽然其中部分种类不易或者不排出,但如果人为地将其取出后拉长,则和其他海参的居维氏管一样具有黏性,当前的研究都以平滑居维氏管为主。平滑居维氏管也可分为两种,分别是已排出的伸长小管和在海参体内未被排出的静止小管[9]。
居维氏管的组织层由外到内分为3层,包括间皮层、结缔组织层和内皮层。间皮层是伪分层,由内层的颗粒细胞和外层的腹膜细胞组成。结缔组织包含圆形和纵向肌肉纤维层,它们将结缔组织层分成一个薄的外部区域和一个厚的内部区域,内部区域中的胶原纤维形成6个平行于居维氏管长轴的环状螺旋[9]。居维氏管的胶原纤维与部分酸性多糖相关,而且研究发现,胶原纤维是主要的构成部分,其抵抗张力的能力增强了居维氏管的防御性。居维氏管的结缔组织在化学组成上与脊椎动物的结缔组织相似,居维氏管被射出时伸长与结缔组织有关[10]。在居维氏管的细胞内还能看到有大量颗粒的隔室或角体,当居维氏管伸长时,结缔组织中胶原纤维层的螺旋会被拉伸,而间皮层外层的腹膜细胞层被分解,内层的颗粒细胞则成为新的外层,且颗粒的隔室或角体会转化成无形状的颗粒物,当居维氏管接触物体时,颗粒细胞会将颗粒内的成分排出,增强了居维氏管的黏附性,进而导致粘连[11]。
2 居维氏管的力学性能
居维氏管有静止和伸长两种状态,主要区别是伸长时的管壁较薄,因为居维氏管在被排出时,管腔中被强力注入水,使腹膜细胞解体,管径扩大,管壁厚度减小[9]。居维氏管在被排出时会伸长为原来的几倍甚至十几倍,而且在伸长后会变硬。Zahn等[12]的研究表明,居维氏管承受的最大力与牵拉速度呈正比,而延展性与牵拉速度呈反比,牵引速度越快,可承受力越大,延展性越低,捕食者一旦被居维氏管缠住,挣脱速度越快则居维氏管越硬越难拉开。Demeuldre等[13]在海水中分别用牵引实验研究静态的居维氏管和伸长的居维氏管的机械性能,静态居维氏管为缓解伸长,会表现出较低的延伸阻力,但是抗拉强度较低,而伸长时的居维氏管有着较高的抗拉强度(3 300 kPa[13];6 000 kPa[12]),表现出较高的韧性而抵抗捕食者挣脱产生的牵引力[12]。居维氏管在拉伸实验中不会出现突然的破裂而是组织逐渐脱位,在水下拉伸实验中,居维氏管呈现与羊毛纤维相似的曲线[13],而且居维氏管的最大应力也大于羊毛的断裂应力[14],表明居维氏管在水下也许有着与羊毛类似的力学特性。与羊毛、蚕丝、蜘蛛丝、尼龙等相比,居维氏管的韧性、抗拉强度都明显偏弱,可能与它有较高的伸长率有关(表1)。
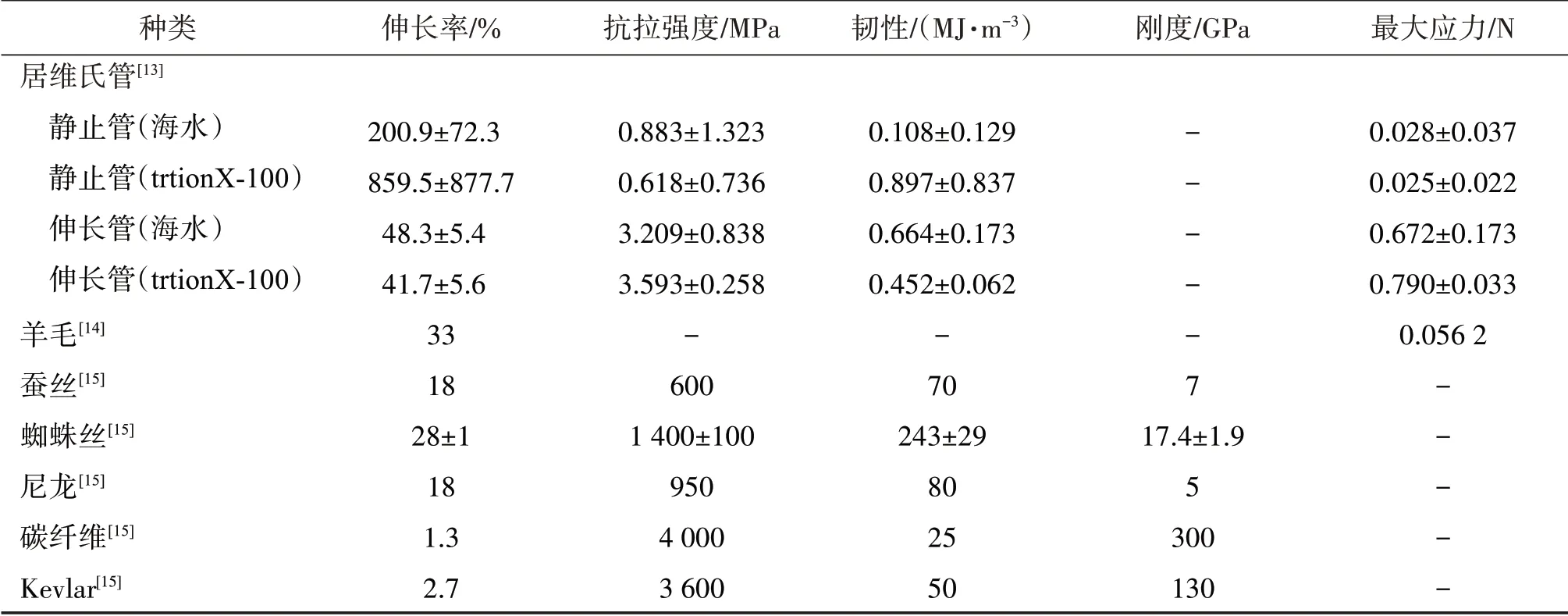
表1 居维氏管与其他纤维的力学性能对比Table 1 Mechanical property comparison of cuvierian tubles with other fibers
3 居维氏管的黏力
非辐肛参属的居维氏管在接触到物体表面时会变得十分具有黏力,在10 s内就可形成黏合,通过黏住捕食者而得以逃生[15]。Baranowska等[16]用电洗脱、免疫沉淀等方法从海参居维氏管中,提取分离出具有黏性的蛋白,发现间皮的免疫反应性最强,而组织层则与粘连有关。随后通过测量各种材料表面的黏附性发现,黏性蛋白的黏附性在钾和EDTA存在时增强,在镉存在时减弱,而添加抗体和胰蛋白酶则可以废除提取物的黏合特性。Flammang等[17]对Holothuria forskali、图纹白尼参、Bohadschia.subrubra、格皮氏海参、丑海参(H.impatiens)、玉足海参等7种海参的居维氏管生物力学测试发现,海参居维氏管的黏力与施加的压缩力呈S型关系,韧性测试中海参属的黏力最大,玉足海参为135 kPa,其他海参为30~60 kPa,而且居维氏管的韧性随着居维氏管基质、海水的温度、盐度和排出时间的变化而变化。Demeuldre等[18]通过不同的显微镜技术对居维氏管的黏附上皮细胞及产生的黏性物质进行观察发现,居维氏管在被排出前,腹膜细胞会形成外部保护性细胞层,防止在体内黏附;而居维氏管被排出后,居维氏管伸长破坏了保护层,使粒状细胞展开并在居维氏管表面暴露,此时居维氏管仍没有黏性;只有当排出的居维氏管与材料表面接触后,粒状细胞才会释放颗粒成分,膨胀、扩散,并在材料表面形成薄薄的均质层,呈现黏附性,且在形态组织上对各种材料表面表现高亲和力。此外,研究发现,并不是所有的颗粒都用于粘连,有少部分颗粒仍处于完整状态,黏力可能和颗粒与表面接触的多少有关,就像压敏黏合剂,它们的黏力与施加的预紧力相关。
居维氏管作为海参的防御器官具有瞬时粘连的特性,可在碰到敌人的瞬间黏住威胁者,这样的特性可在化工、生物医学、材料等领域中应用,为制备瞬时生物黏胶或防水胶提供新的研发方向。此外,根据居维氏管的黏附性、韧性、抗拉力等性能特点,可将其作为生产水下服饰或材料的原料。现有研究结果表明,居维氏管在生物医学领域及工业中有着很好的应用前景,然而海参居维氏管的力学性能种间差异较大,其毒性、生物亲和性、生物相容性等还需更深入的研究。
4 居维氏管提取物的药用价值
海参皂苷是海参的主要次级代谢产物,主要分布于海参的分泌物、体液和居维氏管中。居维氏管富含海参皂苷,含量为(3.76±1.62)g/kg,是体壁的2倍多[19]。海参皂苷为浅黄色或乳白色的粉末状物质,颜色与皂苷含量有关,分子量较大,不易结晶且极性较大,一般可溶于水,易溶于热水、含水稀醇、热甲醇和热乙醇中,难溶于乙醚、丙酮等极性小的有机介质。因为居维氏管在含水丁醇或戊醇中溶解度较大,提取出来后可用大孔树脂吸附、硅胶柱层析、反相硅胶柱层析等方法进行分离纯化[20]。海参皂苷具有抑菌、抗肿瘤、抗氧化、减少脂肪沉积抑制肥胖等生物学活性。赵芹等[21]从格皮氏海参中提取的海参皂苷Echinoside A对肿瘤细胞的生长有显著的抑制作用。Kitisin等[22]研究发现,玉足海参皂苷提取物可延长秀丽隐杆线虫的寿命。在Chumphoochai等[23]的研究中更是发现,玉足海参居维氏管富含皂苷的提取物可通过调节脂肪储存和代谢相关基因的信使RNA的表达来减低脂肪沉积和三酰甘油的水平。Malaiwong等[24]也发现,玉足海参居维氏管富含皂苷的提取物对秀丽隐杆线虫呈现抗帕金森效应,为研发抗帕金森药提供了新的方向。这些研究结果提示,居维氏管的提取物可能是多种疾病预防和治疗药物、保健食品、抑菌剂等的良好原料。
5 居维氏管的再生
海参具有较强的再生能力,即使身体被截断也能恢复成完整的个体;在遇到受污染的海水或机械刺激时会将内脏排出,一段时间后又长出新的内脏。居维氏管作为海参的防御器官,它的再生跟吐脏类似,居维氏管在排出后不久也会恢复。玉足海参居维氏管的再生需要15~18 d[25],黑海参的居维氏管完全再生大概需要5周[26]。Vandenspieg[26]研究发现,当海参受到轻微刺激时,仅排出少量的居维氏管,且不会立即启动再生过程,而是经过一段潜伏期后才会再生。而当受到较强的刺激时,因排出的居维氏管数较多,海参会马上分批进行居维氏管的再生。这样,海参在进行居维氏管再生时不会短时间内消耗大量的能量,利于它的可持续生长。海参居维氏管再生同样也依照着细胞分化、增殖、再分化的顺序,其中间皮层起着最重要的作用,因为间皮层中有着丰富的未分化细胞(可能由腹膜细胞产生),可分化增殖,用于再生居维氏管。海参居维氏管的再生周期较短,通过研究海参的创伤修复与再生机制及基因调控机制,或许能寻找新的生物治疗方法,来促进机体自我修复与再生及构建新的组织与器官。海参居维氏管的再生周期与其他动物器官再生相比较短,但用作生产各产品的原料时相对比其他原料产率低,若能通过人为调控海参居维氏管的再生周期或再生量,在未来居维氏管被投入使用时就可以解决原料产率低的问题。
6 展望
随着海参养殖产业的快速发展,对海参内脏的再利用无疑是进一步提高海参养殖经济效益的关键。作为海参内脏的重要组成部分,居维氏管展现出良好的水下黏附性、伸长率和药用活性,有望用于研发新型水下黏合剂及医学中的生物黏合剂、超轻防水服等军工/运动服饰,以及抗菌、抗肿瘤、抗血栓、抗帕金森等药物或保健品的研发,具有极高的应用价值。然而,目前国内外针对海参居维氏管的应用性研究较少,可作为相关领域的新研究方向。

