人脐带间充质干细胞外泌体递送外源miR-130a-3p抑制人肺癌A549细胞的研究
李锦华,陈丹亮,鲁欣,王宇恒,唐震林,袁茵
(1.广东药科大学生命科学与生物制药学院/广东省生物技术候选药物研究重点实验室,广东广州 510006;2.暨南大学附属第一医院妇产科,广东广州 510630;3.华南师范大学生命科学学院,广东广州 510631)
肺癌是临床常见恶性肿瘤之一,其发病率和死亡率近年来呈不断上升的趋势。非小细胞肺癌约占所有肺癌病例的80%[1]。手术切除、放化疗、分子靶向治疗等是目前临床上治疗非小细胞肺癌的主要手段,但都无法避免复发、转移和耐药等问题,尚需寻找高效、低毒和个性化的新型肺癌治疗方法。研究表明,特定的microRNAs(miRNAs)可作为抑癌基因调节肺癌的发展,是潜在的肺癌治疗工具。然而,miRNA易降解、体内稳定性差,因此急需开发有效的miRNA递送体系,以克服miRNA在肺癌等治疗中的应用障碍[2]。
外泌体(exosomes)是由细胞分泌并释放到胞外环境中的纳米级生物囊泡,由脂质双层膜封闭,内含蛋白质、脂类和各种核酸(miRNA、mRNA、DNA等),是细胞间通讯的重要介质[3]。由于具有天然的物质转运特性以及生物相容性好、体内半衰期长、可穿过血脑屏障等优势,外泌体已逐渐成为药物载体领域的研究热点[4]。已有研究证实外泌体可将抑癌miRNA导入癌细胞,这提供了一种基于外泌体的miRNA递送和癌症治疗策略[5-6],但该策略是否适用于肺癌细胞尚未得到证实。本研究以人非小细胞肺癌细胞株A549为研究对象,用人脐带间充质干细胞(human umbilical cord mesenchymal stem cells,hUC-MSCs)来源的外泌体将对肺癌细胞有抑制作用的外源miR-130a-3p[7]运载至A549细胞,观察A549细胞增殖、迁移和凋亡的变化。
1 材料与方法
1.1 试剂与仪器
RPMI 1640培养基、DMEM/F12培养基、胎牛血清(FBS)、胰酶、青-链霉素(Gibco公司,美国);UltraCULTURE通用型无血清培养基(LONZA公司,美国);BCA蛋白浓度测定试剂盒(增强型)、CCK-8试剂盒、Annexin V-FITC细胞凋亡检测试剂盒(碧云天生物技术有限公司,中国);CD63、CD81抗体(Abcam公司,美国);辣根过氧化物酶(HRP)标记的羊抗兔二抗(北京中杉金桥公司,中国);ECL化学发光检测试剂盒(Millipore公司,美国);Exo-Fect外泌体转染试剂(SBI公司,美国);TRIzol试剂(Thermo公司,美国);EvoM-MLV反转录试剂盒、SYBR Green Pro Taq HS预混型qPCR试剂盒(艾科瑞生物工程有限公司,中国);miR-130a-3p mimic及阴性对照、miR-130a-3p特异性逆转录茎环引物和PCR引物(锐博生物,中国);CO2培养箱(SANYO公司,日本);H-7650型透射电子显微镜(日立公司,日本);电泳仪、电转仪、化学发光成像系统(上海天能科技有限公司,中国);Nano Sight NS300纳米粒度分析仪(NanoSight公司,英国);酶标仪(BIO-RAD公司,美国);Gallios流式细胞仪(Beckman Coulter公司,美国);LightCycler 480荧光定量PCR仪(Roche公司,美国)。
1.2 细胞培养
人非小细胞肺癌细胞株A549购自中国科学院细胞库,培养于含体积分数为10%FBS的RPMI 1640培养基中,置37℃、5%(φ)CO2、饱和湿度的细胞培养箱中生长,2~3 d传代1次,取对数生长期细胞用于实验。
人脐带间充质干细胞(hUC-MSCs)由本室分离、鉴定和冻存[8-10]。复苏后先培养于含10%FBS的DMEM/F12培养基中,置于37℃、5%CO2、饱和湿度的培养箱中生长,3~4 d传代1次,取P3-P8代细胞用于实验。
1.3 外泌体分离
培养hUC-MSCs至约80%汇合,然后将培养基更换为UltraCULTURE通用型无血清培养基,继续培养48 h,收集培养上清,先进行两步低速离心(300 r/min,10 min;2 000 r/min,10 min)去除细胞碎片,保留上清液,10 000 r/min高速离心30 min,取上清,100 000 r/min超速离心70 min,弃上清,加入PBS重悬沉淀,再次以100 000 r/min超速离心70 min,弃上清后用PBS重悬外泌体沉淀,-80℃冻存。上述所有离心步骤均在4℃进行。
1.4 外泌体生物学特性鉴定
1.4.1 透射电子显微镜观察形态 取10 μL外泌体悬液滴于铜网上,室温静置10 min,待充分吸收后,用3%(w∶v)磷钨酸钠溶液室温负染2 min,用蒸馏水洗涤,白炽灯烘干,置于透射电子显微镜下观察并拍照。
1.4.2 Western blot法鉴定外泌体标志蛋白 使用
BCA试剂盒测定外泌体蛋白浓度,经常规SDSPAGE电泳、转膜、封闭后,分别与CD63、CD81一抗稀释液于4℃孵育过夜,TBST洗膜3次,将膜与HRP标记的二抗稀释液室温孵育1 h,TBST洗膜3次,滴加ECL化学发光试剂,使用Tanon4600化学发光成像系统检测条带并拍照。
1.4.3 NTA检测外泌体浓度和粒径分布 利用Nano Sight NS300纳米粒度分析仪检测外泌体样品的颗粒浓度和大小分布。将稀释后的样品缓慢注入分析仪的样品池,避免产生气泡。将样品池插入机器,以流动模式进行检测,捕捉外泌体布朗运动的视频文件,使用NTA 3.2软件分析捕获的数据。
1.5 外泌体转染及分组
用外泌体转染试剂Exo-Fect将miR-130a-3p mimic及阴性对照转染至hUC-MSCs外泌体。用上述经转染的外泌体处理A549细胞,将细胞随机分为:①NC-exo组:A549细胞与负载miRNA mimic阴性对照的外泌体(NC-exo)共孵育;②130a-exo组:A549细胞与负载miR-130a-3p mimic的外泌体(130a-exo)共孵育。每组外泌体的用量均为2 μg/1 000个细胞,作用时间为72 h。
1.6 RT-qPCR
采用茎环法RT-qPCR检测与130a-exo共孵育后A549细胞内miR-130a-3p含量的变化。先用胰酶将细胞消化下来,PBS洗涤细胞(1 000 r/min,5 min)2次,最后弃上清,保留细胞沉淀,以排除上清中未被细胞内吞的外泌体的干扰。用TRIzol试剂抽提细胞沉淀总RNA并测定纯度和浓度;取每组总RNA各500 ng,使用EvoM-MLV反转录试剂盒和miR-130a-3p特异性茎环引物反转录成cDNA;使用SYBR Green Pro Taq HS预混型qPCR试剂盒和miR-130a-3p特异性qPCR引物,以U6为内参照,进行实时荧光定量PCR检测。实验共重复3次,采用2-△△Ct法计算miR-130a-3p的相对水平。
1.7 细胞增殖能力检测
利用CCK-8比色实验测定细胞增殖能力。将A549细胞接种于96孔板,每孔2×103个细胞,置于37°C含5% CO2的培养箱中孵育24 h使细胞贴壁,用NC-exo或130a-exo处理细胞。72 h后,每孔加入10 μL CCK-8试剂,37 °C继续孵育4 h,于酶标仪450 nm波长处测各孔吸光度值。
1.8 细胞迁移能力测定
通过Transwell小室培养体系检测并比较各组A549细胞的体外迁移能力。同上加入NC-exo或130a-exo处理A549细胞,72 h后消化、离心收集各组细胞,加入无血清RPMI1640培养基重悬细胞沉淀,制成密度为1×106个/mL的单细胞悬液,取100 μL加入24孔Transwell培养板的上室,下室加入500 μL含10%FBS的RPMI1640完全培养基,放回CO2培养箱;24 h后,取出上室,先用棉签轻轻擦掉未穿过聚碳酸酯膜的细胞,再将小室放入甲醇固定15 min,干燥后用伊红染液染色5 min,PBS洗涤后风干,在显微镜下随机选取5个视野计数穿过膜的细胞。
1.9 细胞凋亡检测
取NC-exo组和130a-exo组A549细胞各1×105个转入流式检测管,用PBS洗涤1次,每管加入85 μL结合缓冲液重悬细胞沉淀,再加10 μL Annexin V-FITC和(或)5 μL PI,轻轻混匀后室温避光孵育15 min,最后向每管中加400 μL结合缓冲液,用流式细胞仪测定各组细胞的凋亡情况,使用FlowJo软件处理结果。
1.10 统计学分析
使用GraphPad Prism 8.3.0软件对实验数据进行统计分析并作图。实验数据以均数±标准差(±s)表示,两组间均数比较采用Student'st检验,P<0.05为差异有统计学意义。
2 结果
2.1 外泌体表征
透射电镜观察结果如图1A所示,从hUC-MSCs培养上清中分离的纳米颗粒呈圆盘状,直径约100 nm,具有膜结构。Western blot实验结果如图1B所示,分离自hUC-MSCs培养上清的纳米颗粒表达CD63和CD81这两种外泌体的特异性标记物。NTA检测结果如图1C所示,纳米颗粒样品的浓度为8.86×108个/mL,粒径分布范围的峰值为135.5 nm。
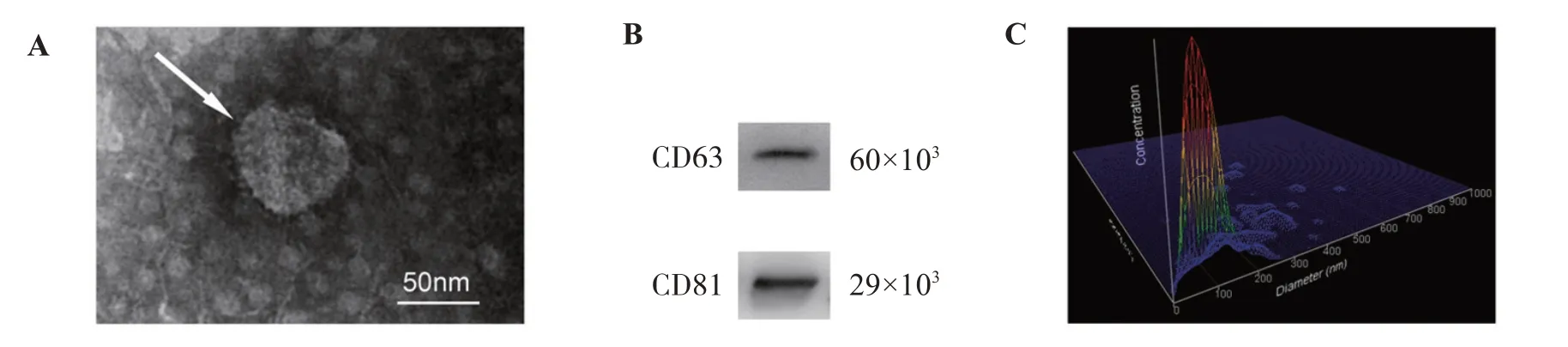
图1 hUC-MSCs来源外泌体的表征Figure 1 Characterization of exosomes derived from hUC-MSCs
2.2 hUC-MSCs外泌体介导的miR-130a-3p摄取对A549细胞增殖的影响
通过RT-qPCR评估A549细胞对外泌体内吞情况的结果如图2A所示,与NC-exo组比较,130a-exo组miR-130a-3p的含量显著升高(P<0.01)。通过CCK-8法检测各组细胞增殖能力的结果如图2B所示,与NC-exo组比较,130a-exo组A549细胞的增殖能力显著降低(P<0.01)。
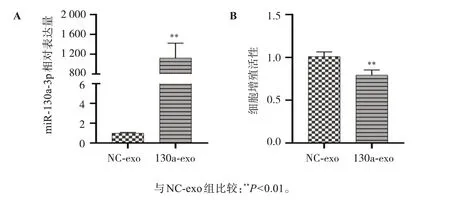
图2 负载外源miR-130a-3p的hUC-MSCs外泌体对A549细胞miR-130a-3p含量及增殖能力的影响Figure 2 Effect of hUC-MSC exosomes transfected with miR-130a-3p mimic on miR-130a-3p level and cell proliferation of A549 cells
2.3 hUC-MSCs外泌体介导的miR-130a-3p摄取对A549细胞迁移的影响
Transwell小室实验结果如图3所示,NC-exo组A549细胞的体外迁移数为54.00±6.56,130a-exo组A549细胞的体外迁移数为32.33±6.51。与NC-exo组相比,130a-exo组肺癌细胞的体外迁移能力明显下降(P<0.05)。
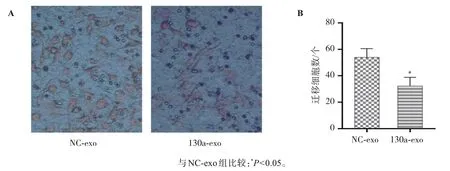
图3 负载外源miR-130a-3p的hUC-MSCs外泌体对A549细胞迁移能力的影响Figure 3 Effect of hUC-MSC exosomes transfected with miR-130a-3p mimic on the migration of A549 cells
2.4 hUC-MSCs外泌体介导的miR-130a-3p摄取对A549细胞凋亡的影响
通过流式细胞术检测的A549细胞凋亡情况如图4所示,与NC-exo组比较,130a-exo组AnnexinV-FITC+细胞的比例(即早期凋亡率)显著升高(P<0.05),同时,130a-exo组AnnexinV-FITC+PI+细胞的比例(即晚期凋亡率)亦明显增加(P<0.01)。
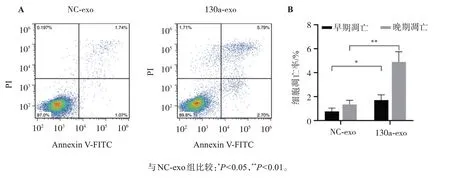
图4 负载外源miR-130a-3p的hUC-MSCs外泌体对A549细胞凋亡的影响Figure 4 Effect of hUC-MSC exosomes transfected with miR-130a-3p mimic on the apoptosis of A549 cells
3 讨论
目前,肿瘤的治疗已进入精准治疗时代。以EGFR酪氨酸激酶抑制剂为代表的分子靶向药物使肺癌晚期患者的缓解率和生存率显著提高。但与化疗相似,分子靶向治疗也存在耐药现象[11]。因此,在基因组学、表观遗传学迅猛发展的背景下,继续从分子水平寻找合适的治疗工具和靶点对肺癌的诊治至关重要。
miRNAs是一类广泛存在的单链非编码小分子RNA,通过负调控mRNA的翻译和稳定性,在基因表达的表观遗传调控中发挥着积极作用。大量研究表明,miRNAs与肺癌等肿瘤的发生发展密切相关,发挥着抑癌基因或癌基因的生物学功能,是肿瘤诊断和治疗的潜在分子工具[12-13]。miR-130a-3p是一个对肺癌有抑制作用的miRNA分子,该分子在肺癌组织和肺癌细胞株A549中的表达均显著下调,而过表达则能够显著抑制A549细胞的增殖、迁移与侵袭[7]。更多的研究显示,miR-130a-3p对其他类型的肿瘤,包括前列腺癌、乳腺癌、肝癌的增殖、侵袭和转移都有抑制作用[14-16]。这提示miR-130a-3p可能发挥着抑癌基因的作用,可被用于肺癌等的基因治疗[13]。然而,受其在体内易降解等固有属性的限制,miRNAs在癌症等疾病治疗中的应用还存在一定障碍,开发有效的miRNA递送系统是克服上述障碍并将miRNAs成功用于临床的关键[2]。
外泌体是一种天然存在的、可由机体大多数细胞分泌的膜性纳米囊泡,在尺寸和功能上类似于人工合成的纳米颗粒,优点颇多,已成为靶向药物和基因递送载体最有希望的候选物[4]。外泌体可装载的药物类型包括小分子化学药物、蛋白质和肽、核酸药物等[4,17]。
间充质干细胞(mesenchymal stem cells,MSCs)是一类来源广泛、生物学功能极为丰富的成体干细胞。MSCs旁分泌的外泌体,不仅携带大量MSCs源功能蛋白,还具有递送miRNA、抗癌药物以及抗炎等特殊功能[5-6]。已有研究表明,人脐带MSCs来源的外泌体可安全地用于动物模型,并在心脏病和肝病中表现出治疗作用[18-20]。因此,MSCs是用于输送药物的外泌体的理想来源。
前期研究显示,人脐带MSCs的培养上清对肺癌A549细胞的生长及迁移有显著抑制作用[8]。在此基础上,本研究进一步从hUC-MSCs的培养上清中分离外泌体,并观察了装载外源miR-130a-3p的hUC-MSCs外泌体对肺癌A549细胞恶性生物学行为的影响。本研究结果表明,hUC-MSCs外泌体可将外源miR-130a-3p成功递送至肺癌细胞,其介导的miR-130a-3p摄取显著抑制了肺癌A549细胞的增殖、迁移,并可诱导A549细胞凋亡。hUC-MSCs外泌体有望被用作miRNA的一种细胞导入载体,在肺癌治疗中发挥作用。

