转录因子Nrf2促进内皮细胞存活和肺稳态的机制研究
葛亮 李光才 张明华 谭伟
缺血再灌注引起的急性肺损伤导致肺上皮和内皮细胞死亡并伴有炎症[1]。急性肺损伤会促进和(或)使肺部发病机制(包括纤维化)永久化[2]。急性肺损伤会导致过度的炎性反应和氧化应激。氧化应激导致炎性细胞募集而导致炎症,而炎性细胞引起氧化应激的诱导[3]。转录因子Nrf2诱导细胞保护性基因表达并赋予抗缺血性肺损伤的保护,并且Nrf2介导的信号传导对于恢复肺损伤后的肺稳态也至关重要[4]。尽管已经报道过PI3K/AKT信号是肺上皮细胞中Nrf2激活所必需的,但是在缺血再灌注肺损伤和修复过程中PI3K/AKT-Nrf2串扰的重要性仍不清楚[5]。Nrf2是内源性抗氧化剂防御分子的关键调节剂之一[6]。Nrf2促进各种下游抗氧化剂基因的转录,包括血红素加氧酶1(heme oxygenase 1,HO-1),NAD(P) H:醌氧化还原酶1[NAD(P) H:quinone oxidoreductasel,Nqo1]和其他Ⅱ期抗氧化剂酶[7]。此外,Nrf2在保护脑细胞免受缺血性中风损伤中起重要作用[8]。Nrf2基因的敲除增加了缺血再灌注小鼠肺缺损。因此,本研究探讨转录因子Nrf2通过在复氧过程中保护线粒体功能和DNA促进内皮细胞存活和肺稳态的机制。
1 材料与方法
1.1 实验小鼠与细胞培养 研究中使用20只野生型(Nrf2 +/+)和Nrf2缺乏(Nrf2-/-)小鼠CD-1/ICR株[购自南方医科大学实验动物管理中心,合格证号:SCXK(粤)2016-0041],平均8~9周龄,雌性,25~30 g。每个笼子收容小鼠5只,期间小鼠可随意获得食物和水。使用改良方法分离小鼠肺血管内皮细胞(MLVEC)。在用氯胺酮(70 mg/kg)和甲苯噻嗪(10 mg/kg)的混合物麻醉后,向小鼠右心室(3~4周龄)灌注PBS,以清除肺部血液。将周围的胸膜下肺组织切成小块,并在含有20%胎牛血清,25 mmol/L HEPES,3.7 g/L NaHCO3、5 mg/ml肝素,1 mg/ml氢化可的松,80 mg/ml内皮细胞生长补充剂的DMEM中培养来自牛脑,5 mg/ml两性霉素,0.01%氨苄西林/链霉素,在37℃和5%CO2的条件下放置60 h。除去组织切块,在基础培养基中培养贴壁细胞。Nrf2 siRNA购自Santa Cruz。按照说明以Xfect siRNA转染试剂(Takara)进行siRNA的转染。
1.2 小鼠与细胞复氧过程模型建立 亚汇合的细胞用含1%血清的DMEM/F-12培养基替换,并置于缺氧培养箱中2 h急性缺氧。腔室中充满5%的CO2和氮气的气体混合物,以获得1%的氧气浓度,并进行连续监控。暴露后,将细胞保持在完全培养基中,在21%O2和5%CO2的气氛中孵育,进行360 min的复氧。用异氟烷麻醉大鼠并仰卧位绑扎。随后,由颈中线切口暴露颈总动脉,颈外动脉和颈内动脉。将腔内硅酮涂层灯丝插入颈总动脉内腔,然后将其轻轻推入颈内动脉,直至颈动脉分叉处约18 mm处,从而阻塞MCA。缺血2 h后,再次麻醉MCAO大鼠,并抽出细丝以恢复血流以进行再灌注。医院伦理委员会批准该研究,动物实验方案均经大学动物研究伦理委员会批准。
1.3 实验分组 根据实验要求,将实验小鼠分为Nrf2基因敲除组(Nrf2-/-)和野生型组(Nrf2 +/+),每组10只,培养的细胞为Nrf2 siRNA组。
1.4 实验方法
1.4.1 氧化应激水平检测:超氧化物歧化酶(SOD):根据需要准备空白井,标准井,测定井和对照井。将细胞在37℃下孵育20 min。用酶标仪检测每个孔在450 nm 的吸光度值。用酶标仪(1 cm的光路,用蒸馏水设定为零)检测532 nm处每个孔的吸光度值。细胞内ROS的测定,使用活性氧分析试剂盒(beyotime,中国上海)评估ROS水平。在黑暗中将样品与DCFH-DA在37℃下孵育45 min。然后,将样品用PBS洗涤3次。使用酶标仪(Bio-Rad,CA,美国)在485 nm(激发)和535 nm(发射)下分析荧光。使用商品化的ELISA试剂盒(Cell Biolabs,美国),根据制造商的说明测定谷胱甘肽过氧化物酶(GPx)活性。
1.4.2 蛋白质免疫印迹:实验结束时获得支气管肺泡灌洗液(BALF),使用核和细胞质蛋白提取试剂盒分离肺组织中的细胞核和胞质蛋白。通过10%SDS-PAGE分离30 g蛋白质,然后转移至硝酸纤维素膜(Millipore Corp,Bedford,MA)。封闭后,将免疫印迹与抗HO-1、Nqo1蛋白孵育过夜,再与辣根过氧化物酶偶联的IgG二级抗体(Santa Cruz)在室温孵育1 h。以增强的化学发光Western印迹检测系统(Millipore)可视化免疫反应蛋白。使用光密度计(Syngene,Braintree,UK)、Genesnap和Genetools软件(Syngene)测量条带的染色强度。
1.4.3 线粒体损伤测评:使用常规萤光素-萤光素酶测定法(Roche Diagnostics,曼海姆,德国)检测ATP释放。BALF进行胰蛋白酶处理,后重悬于200 μl缓冲液(100 mmol/L Tris,4 mmol/L EDTA,pH值7.7)中。收集裂解物,并使用酶标仪(Bio-Rad,CA,USA)检测ATP释放。为了评估ATP的释放,对样品中检测到的量进行总体积和时间的校正。线粒体膜电位(MMP)的测量,使用Rh123染色分析MMP。在37℃下将Rh123(10 μmol/L)加入肺泡灌洗液(BALF)30 min。使用显微镜在480 nm(激发)和530 nm(发射)下测量荧光。使用从R&D Systems(明尼阿波利斯,明尼苏达州,美国)获得的Quantikine M细胞色素C免疫测定试剂盒测量细胞质提取物的上清液和分离的线粒体悬液中的细胞质和线粒体级分中的细胞色素C水平。将裂解物以750 g离心10 min,并收集上清液。然后,将上清液在15 000 r/min离心,并将上清液用作线粒体级分。使用酶标仪在450和540 nm处测定吸光度。
1.4.4 肺组织病理学检查:将肺组织用10%甲醛林固定并包埋在石蜡中,然后用苏木精和曙红(HE)染色4 mm切片。由2名在肺部病理学方面有专长的盲目病理学家对玻片的总表面进行评分。
1.4.5 MTT检测细胞存活:使用Promega(英国南安普敦)CellTiter [3-(4,5-二甲基噻唑-2-基)-5-(3-羧基甲氧基苯基)-2-(4-磺基苯基)-2H-四唑]进行细胞生存分析。析根据制造商的说明,通过记录490 nm处的吸光度定量测定。细胞死亡百分比计算:细胞死亡= 100-(OD测试/OD对照×100),其中对照代表在整个实验期间仅在M199/20%FBS中培养的细胞。
1.5 肺部炎症评分标准 0分:正常组织;1分:最小的炎症变化;2分:轻度至中度的炎症改变(对肺部结构无明显损害);3分:中度发炎性损伤(肺泡间隔增厚);4分:中度至重度发炎性损伤(结节或肺炎区域的形成扭曲了正常结构);5分:严重的炎症损伤,视野完全消失。
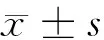
2 结果
2.1 Nrf2减轻氧化应激反应 Nrf2基因敲除组较野生型组ROS水平升高(P<0.05),SOD、GPx水平降低(P<0.05)。见表1。

表1 氧化应激水平测定
2.2 蛋白印迹分析 Nrf2基因敲除组较野生型组HO-1、Nqo1、PI3K/AKT的蛋白表达降低(P<0.05)。见表2。

表2 蛋白印迹分析
2.3 小鼠肺组织HE染色 Nrf2基因敲除组缺血灌注诱发急性肺损伤的特征是弥漫性间质性水肿,肺泡增厚,肺泡气隙明显减少,野生型组可抑制诱发的损伤。见图1。
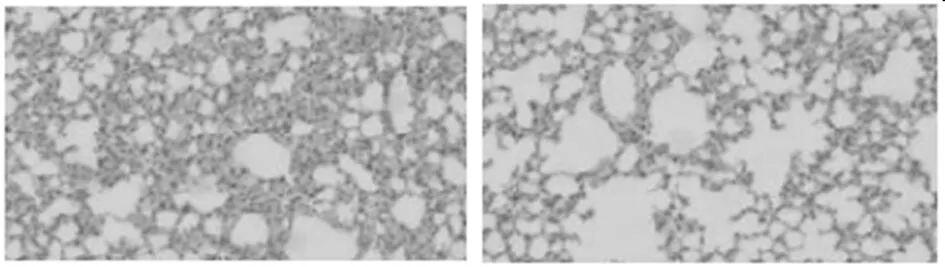
2.4 Nrf2保护复氧过程中线粒体损伤 Nrf2基因敲除组较野生型组细胞色素C水平升高(P<0.05),ATP合成量、MMP电位水平降低(P<0.05)。见表3。

表3 Nrf2对线粒体功能的影响
2.5 细胞凋亡活力水平 Nrf2 siRNA组较正常培养细胞组细胞凋亡率升高(P<0.05),细胞活力降低(P<0.05)。见表4。
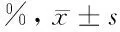
表4 细胞凋亡活力水平
3 讨论
氧化应激损伤在缺血再灌注的病理发展中起关键作用[9]。一项临床研究证实尿液中的氧化应激生物标志物可以预测心肌梗死、中风和心血管疾病的死亡率,表明氧化还原系统失衡与病因有关[10]。本研究中,我们建立了脑缺血再灌注疾病引起的急性肺损伤小鼠模型,在复氧过程中发现小鼠体内ROS的增加和SOD活性的降低,HO-1和Nqo1抗氧化剂分子的水平升高,导致缺血性中风中氧化应激损伤的增长。Nrf2基因敲除组较野生型组ROS水平升高,SOD、GPx水平降低,说明Nrf2基因的保留缓解了复氧过程中的氧化应激反应。此外,我们发现野生型(Nrf2 +/+)小鼠中可以抑制ROS产生,上调SOD活性以及HO-1和Nqo1的中的蛋白表达来抵御氧化应激。Nrf2基因敲除组较野生型组HO-1、Nqo1、PI3K/AKT的蛋白表达降低。研究证实,Nrf2的丧失会加重MCAO大鼠的脑梗死和神经功能缺损[11]。因此,Nrf2信号通路在缺血性中风损害的抑制中起至关重要的作用[12]。在正常的生理条件下,Nrf2与细胞质中的天然抑制剂Keap1结合以维持活性的稳定性。响应各种蛋白激酶对细胞的损伤和(或)磷酸化,Nrf2被激活并从Keap1释放[13]。PI3K/Akt通路参与Nrf2在ser 40的磷酸化,而PI3K或Akt的抑制会减弱Nrf2的激活。从Keap1释放后,p-Nrf2在细胞质中被激活,转入细胞核,与bZIP蛋白(如Maf蛋白)异源二聚体,并识别适当的ARE序列[14]。结果,它启动了在启动子区域包含ARE的一系列抗氧化基因的转录,包括SOD、HO-1、Nqo1和GST。这些抗氧化剂分子通过各种酶催化反应保护细胞免受氧化应激。SOD催化O2的歧化,形成O2和H2O2,然后转化为水的最终产物[15]。HO-1催化血红素氧化为游离铁,联运胆素和一氧化碳。而且,Nqo1催化参与生成ROS的醌的双电子还原[16]。本研究结果表明,野生型(Nrf2 +/+)小鼠激活PI3K/Akt蛋白激酶磷酸化,然后促进HO-1、Nqo1、SOD等蛋白的表达,从而抑制缺血再灌注的氧化应激损伤。
当内源性抗氧化因子减少时,氧化应激诱导细胞凋亡。本研究表明,Nrf2 siRNA组的细胞凋亡率升高。线粒体是ROS产生的关键来源。但是,这些细胞器极易受到氧化应激的影响,这会触发mtDNA的突变并调节膜的通透性。本研究中,Nrf2缺乏(Nrf2-/-)的小鼠MMP崩溃,细胞色素C释放和线粒体ATP生成减少。额外的线粒体生物发生增强了线粒体ATP的产生,这是线粒体功能的关键指标。线粒体的生物发生包括线粒体的生长和分裂。线粒体功能通过不断重塑线粒体的生物发生来适应各种应激条件。
综上所述,Nrf2在机体复氧过程中可降低氧化应激反应,抑制线粒体功能受损,促进内皮细胞的生存从而保护肺稳态。

