AngioJet 机械血栓清除在急性肠系膜上动脉栓塞治疗中的应用价值
王家兴, 任建庄, 韩新巍, 段旭华, 陈鹏飞, 万 里
急性肠系膜上动脉栓塞(acute superior mesenteric artery embolism,ASMAE)是一种严重且罕见的急腹症,预后极差,病死率高达60%~80%[1-2]。 传统开放性手术死亡率高达40%[3]。血管内介入治疗以微创、快速恢复肠道血供、并发症少等优势已成为主要治疗手段。 目前AngioJet 机械血栓清除治疗ASMAE尚未见系统研究,仅见个别病例报道[4-6]。 本研究回顾性分析2019年2月至2020年3月单中心7 例ASMAE 患者临床资料,旨在探讨应用AngioJet 机械血栓清除系统治疗的安全性和效果。 现将结果报道如下。
1 材料与方法
1.1 临床资料
本组7 例ASAME 患者中男3 例,女4 例;年龄47~78 岁,平均(66.1±12.0)岁;病程2~27 h,平均(15.6±9.5) h;均伴有不同基础疾病如心房颤动(房颤)、高血压、冠心病、糖尿病等;均急性起病,临床表现为剧烈腹痛、恶心呕吐、腹泻等,2 例(患者4、6)伴有肠鸣音减弱,腹部压痛、反跳痛、腹肌紧张等轻度腹膜炎症状和体征,见表1。所有患者术前均经增强CT 确诊。
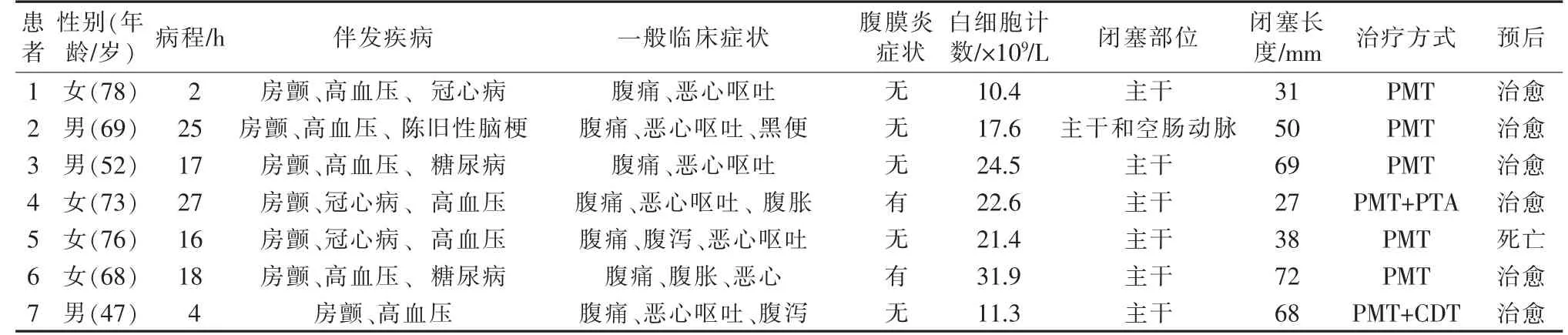
表1 7 例ASAME 患者临床资料
1.2 手术方法
患者仰卧于DSA 检查台上,给予吸氧和心电监护, 常规双侧腹股沟区消毒铺巾, 采用改良Seldinger 技术穿刺右侧股动脉,置入5 F 动脉鞘(美国Merit 医疗系统公司),经亲水膜性超滑导丝(日本Terumo 公司)引入5 F 猪尾导管(美国Cook 公司)行腹主动脉造影,显示双肾动脉和肠系膜上动脉(SMA)开口位置,交换引入5 F Cobra 导管(美国Cook 公司)超选择至SMA,造影显示血栓位置、侧支循环等情况;导管导丝进入血栓远端,再次造影显示闭塞段长度,交换引入Amplatz 加硬导丝(美国Boston 科技公司)至SMA 远端,6 F 抗折反长鞘(美国Cook 公司)插入SMA 开口2 cm 处,退去抗折反鞘内芯,引入6 F AngioJet 血栓抽吸导管(美国Boston科技公司); 经静脉予普通肝素钠800~l 000 U/h;根据血栓范围应用剂量不等尿激酶(20×104~40×104U,溶解于0.9%氯化钠溶液100 mL),启动AngioJet 系统药物喷射模式, 导管自血栓远端1 cm 由远及近喷射尿激酶溶液,待药物与血栓作用15 min 后再次引入抽栓导管并启动AngioJet 系统血栓抽吸模式,导管由远及近进行抽吸,反复2~3 次;抽吸结束后复查造影观察血管通畅情况——若管腔仍残留血栓较多,可予多次抽吸,若SMA 远端或其分支内仍残留血栓,留置5 F 直头侧孔导管(美国Cordis 公司)使其头端位于血栓内行CDT 治疗;反复抽吸后SMA 主干狭窄仍>30%,予以球囊(美国Bard 公司)扩张。
1.3 术后处理
留置溶栓导管患者经微量泵连接溶栓导管,24 h 持续序贯泵入脉冲式尿激酶(10×104U/0.5 h)、罂粟碱(30 mg/2.5 h)、肝素(1 000 U/5 h),连用3 d后造影复查。 溶栓过程中每间歇12 h 复查血凝。 排除抗凝禁忌后,每日间歇12 h 给予低分子肝素5 000 U皮下注射,3 d 后改为口服华法林,调整凝血酶原时间国际标准化比值(INR)至2.0~3.0。 复查血常规、肝肾功能。 对并发血红蛋白尿患者,给予水化、碱化尿液、利尿等处理。 对伴发房颤患者,除出院后常规抗血小板治疗至少6 个月外,继续予以控制心室率和华法林长期治疗,维持INR 在2.0~3.0。
1.4 效果评价和观察指标
技术评价:完全取栓指SMA 内完全通畅,血栓完全清除; 部分取栓指SMA 主干或其分支仍有残余栓子。 临床疗效评价[7]:治愈——腹痛症状消失,体检无阳性体征,时间>30 d;有效——腹痛症状有所缓解,腹膜刺激症状减轻或局限,仍需开放性手术;无效——症状无好转,腹痛进行性加重或出现腹膜刺激症状,需开放性手术。 观察指标:术后白细胞及肾功能变化,手术相关并发症(消化道出血、SMA 夹层形成、 血红蛋白尿及穿刺点出血), 肠切除,住院死亡率。
1.5 随访
术后3~12 个月门诊随访, 给予腹部查体、增强CT 检查,或电话问诊。
2 结果
7 例ASMAE 患者术中造影均显示SMA 主干闭塞(长度31~72 mm),其中1 例(患者2)伴发空肠动脉开口处部分栓塞;平均抽吸时间(41.14±7.56)(36~58) s,尿激酶平均用量(26.43±7.48)(20~40)万U。 抽栓后造影显示5 例完全取栓,2 例(患者2、4)部分取栓,患者2 抽栓后一支空肠动脉开口处仍存在部分血栓(约40%狭窄),留置溶栓3 d 后复查造影血栓消失(图1),患者4 反复抽栓后仍见SMA主干残留附壁血栓(>30%狭窄),球囊扩张后造影示狭窄解除。 6 例患者术后1~2 d 腹痛症状逐渐缓解,腹膜刺激症状消失,白细胞于术后2~5 d 降至正常范围, 肾功能始终维持在正常水平;1 例(患者5) 术后即刻腹痛缓解, 但术后2 d 出现腹痛加重,虽然白细胞由术前21.4×109/L 降至19.1×109/L,但肌酐由术前68 μmol/L 升至180 μmol/L, 肝功能急剧恶化,丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)分别由术前81 U/L、95 U/L 升至4 706 U/L、7 463 U/L,术后5 d 因多脏器衰竭死亡。 术后有2 例( 患 者3、6) 肉眼可见血红蛋白尿,给予水化、碱化尿液、利尿等对症处理后症状消失。 其余患者均未出现手术相关并发症。 随访3~12 个月,6 例患者治愈,均未诉腹痛等症状。 患者4 术后3 个月复查CT 提示SMA 少量陈旧性血栓,但未诉腹痛等症状,继续抗凝、抗血小板治疗,定时门诊随访。
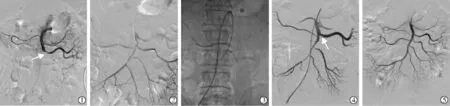
图1 AngioJet 机械血栓清除系统治疗ASMAE 患者影像
3 讨论
ASMAE 是急性肠系膜缺血(acute mesenteric ischemia,AMI)最常见原因,占AMI 40%~50%,大多源于房颤等心源性疾病[8]。 起病快、腹痛特点和症状发展与其他急腹症相似,往往导致治疗延误。 一旦急腹症伴有房颤、动脉硬化、凝血功能异常等循环系统疾病,应考虑急性肠缺血可能。 ASMAE 外科治疗主要包括动脉切开取栓、肠系膜动脉旁路移植术、肠切除术,优势在于术中可探查肠道活力,但风险大,死亡率高。ASMAE 介入治疗包括PMT 或经皮导管血栓抽吸、PTA、CDT 和支架植入等[9]。 血管内手术创伤小,可快速恢复肠道血供,避免肠坏死或缩小肠段切除范围[10]。 有研究表明AMI 开放性手术死亡率比血管内治疗高1.22 倍[11]。 有研究报道显示ASMAE 患者接受介入治疗、 开放手术1年内死亡率分别为10%、68%[12]。 以上研究提示血管内介入治疗ASMAE 可能是一种更有效的治疗方法。
AngioJet 是新一代血栓清除装置, 其根据伯努利原理,通过高速喷洒流体产生局部低压效应粉碎并抽吸血栓,术中可同时喷洒溶栓药物,尤其适用于血栓负荷重患者[13]。 本组7 例患者均为SMA 主干闭塞,平均长度(55.00+16.06) mm ,血栓负荷重,适合应用抽吸能力更强的AngioJet 血栓清除装置。 与传统CDT、 导管抽栓相比,AngioJet 系统具有优势:①通过药物- 机械耦联技术,在抽栓碎栓的同时利用高速流体将药物喷洒入血栓内部,增强术中抽栓效果; ②其机械负压较手工负压作用力更强更均匀,血栓清除率更高;③其抽吸与药物喷洒模式可自由转换,抽栓后可即刻造影复查,对效果满意者无需再喷洒尿激酶, 显著减少尿激酶用量。
临床上常将腹膜刺激症状作为开放手术的主要指标[14-15]。 本组2 例患者术前有轻度腹膜刺激症状且年龄偏大, 家属拒绝开放手术, 予以AngioJet导管抽栓后症状立即缓解。 有研究表明肠缺血耐受时间为6~12 h,超过12 h 后小肠极易发生缺血坏死[16]。Hayashi 等[17]报道 对ASMAE 肠 切 除术 后肠 道 标 本进行回顾性临床病理学分析,7 例腹膜炎患者中有6 例术后肠道标本显示存在可逆性缺血, 同时将20 例接受根治性治疗(包括血管内介入治疗和外科手术治疗)肠缺血患者分为可逆组和不可逆组,可逆组症状出现与诊断中位时间>27 h; 认为无论从影像学检查还是临床症状上均难以区分可逆性和不可逆性缺血,即使存在腹膜炎也应考虑血运重建。 本组有5 例患者病程>12 h,2 例伴有腹膜炎,除1 例死于全身多脏器衰竭外, 其余患者均恢复良好。ASMAE 早期(通常不超过8 h)虽然存在肠缺血,但尚未发展为肠坏死,此时是治疗最佳时机。 但临床上患者确诊时通常缺血时间已>8 h。此时手术方式选择应根据患者具体情况而定, AngioJet 血栓清除应用适应证需谨慎把握。 一旦有足够证据显示肠坏死或感染综合征, 无论病程长短均应及时剖腹手术;如果无肠坏死明确证据,可首先尝试血管内治疗。 由于临床上评估肠坏死较为困难,ASMAE 患者AngioJet 血栓清除应用适应证应基于:①ASMAE 早期病程不超过8 h,无明显肠坏死征象;②患者出现腹膜刺激症状而生命体征平稳时首选剖腹探查,但临床评估认为不适宜开放手术或家属拒绝开放手术时AngioJet 血栓清除则为一种治疗选择。 因此,本研究认为不能单纯将腹膜炎和病程长短作为判断是否行血管内介入治疗的标准,即使在诊断或手术延误情况下,介入治疗仍可视为一种治疗选择。
既往采用导引导管手动抽吸血栓时,通常选择7~9 F 导管。 直径较大导管虽然便于抽吸血栓,但大导管与小导管、导丝间存在缝隙,操作过程中会增加SMA 夹层风险[18]。 如何避免发生,根据本中心经验,可选用Amplatz 加硬导丝以提供足够支撑力,以防损伤血管壁;选用6 F 抗折返鞘定位于SMA 开口处,抗折返鞘头端为倒J 形,顺应SMA 走行,能牢固地卡在SMA 近端,操作过程中不易脱出;引入直径6 F AngioJet 抽栓导管, 其与6 F 抗折返鞘间缝隙极小, 抽栓导管可通过抗折返鞘反复插入SMA,既节省时间又避免SMA 夹层风险。
SMA 远端及分支血管较细, 应用直径6 F AngioJet 导管存在小直径血管破裂风险。 患者伴有远端及分支栓塞、顽固性附壁血栓、SMA 夹层,单纯机械碎栓常难以使血栓完全清除,此时应考虑结合PTA、CDT、导管抽吸、支架植入等介入术式。 本研究中病例数较少,未发生远端栓塞,但有1 例(患者2)伴发空肠动脉栓塞, 术中SMA 主干血栓清除后予以空肠动脉CDT;1 例(患者4)SMA 主干反复抽吸后仍有残留血栓,给予球囊扩张。 Freitas 等[19]报道采用PMT 术治疗20 例ASMAE 患者, 其中7 例辅以球囊扩张,4 例辅以CDT,2 例行导管抽吸,5 例植入支架。Liu 等[20]报道对8 例ASMAE 患者行导管抽吸, 其中1 例结合CDT 治疗,2 例经5 F 导管行即时团注尿激酶溶栓治疗。 这些研究报道提示AngioJet 结合其他介入治疗方式可更有效地清除残余栓子,有利于患者预后。 值得警惕的是,房颤患者尿激酶溶栓有再发血栓脱落风险,因此溶栓治疗前应给予控制心室率,并密切关注患者围术期生命体征变化,如发生栓子脱落应及时处理。
本组有2 例出现血红蛋白尿,均考虑抽栓过程中高压水流冲击破坏红细胞引起血红蛋白大量释放所致[21]。 本组所有患者常规充分水化,2 例出现血红蛋白尿患者经碳酸氢钠碱化尿液后24 h 小便颜色恢复正常。 1 例(患者5)血栓完全清除,但术后2 d突发腹痛、腹胀加重伴胸闷,进而出现意识模糊、烦躁不安、四肢湿冷;查体:心率(HR)120 次/min,血压(BP)90/70 mmHg(1 mmHg=0.133 kPa ),呼吸频率(RR)32 次/min,血氧饱和度(SpO2)91%;双侧瞳孔对光反射迟缓,心律绝对不齐,第一心音强弱不等,腹部膨隆,腹壁触诊腹肌稍紧张、感腹壁较韧,肠鸣音未闻及;急查白细胞计数19.1×109/L、中性粒细胞0.942、血小板计数88×109/L、活化部分凝血活酶时间(APTT)49.70 s、INR2.41、D- 二聚体59.61 μg/mL、肌酐180 μmol/L、ALT 4 706 U/L、AST 7 463 U/L,血气分析示重度酸中毒; 彩色超声检查提示,SMA 内径约6.5 mm,血流通畅、流速57 cm/s;呼吸困难进行性加重、肝肾功进行性恶化,给予气管插管、呼吸机辅助呼吸、连续床旁血滤、持续泵入大剂量去甲肾上腺素维持血压、 快室率房颤泵入艾司洛尔维持心室率、血浆置换改善凝血功能,并继续抗炎、抑酸、扩容、改善心功能及微循环,纠正水电解质紊乱及酸中毒;临床考虑:肠缺血- 再灌注损伤、感染性休克、房颤,肠坏死不除外;外科会诊考虑术中死亡风险极高,家属要求继续重症监护治疗,术后5 d死于多脏器衰竭。 此病例提示ASMAE 患者即使未出现腹膜刺激症状,随着缺血时间延长,血管完全再通后仍存在再灌注损伤发生可能,尽可能早地实现血管完全再通可能有利于患者预后。
综上所述,AngioJet 机械血栓清除治疗ASMAE微创、安全有效,存在分支或远端栓塞及残留附壁血栓时再考虑结合CDT、球囊扩张治疗等,可作为ASMAE 一种替代性血管内治疗方法。 本研究为回顾性分析,样本量较少,中远期疗效及并发症等有待于进一步随访观察。

