胸主动脉腔内修复术联合体外开窗技术治疗累及主动脉弓的复杂胸主动脉疾病
张 涛, 纪东华, 王 峰
Dake 等[1]1994年报道单纯血管腔内治疗胸主动脉病变以来, 胸主动脉腔内修复术(thoracic endovascular aortic repair,TEVAR)已广泛应用于临床。 TEVAR 与传统开放手术相比具有创伤小、死亡率低、并发症发生率低等优点[2-3]。 但某些累及主动脉Z0~Z3 区的复杂胸主动脉病变,仍是目前腔内治疗重点和难点。 支架体外开窗技术作为治疗方法之一, 最初于1999年报道应用于近肾腹主动脉瘤腔内修复术重建内脏分支动脉[4-5],尽管经过20 余年手术技术和器材进步,完全腔内重建弓上分支血流仍处于探索阶段。 本文回顾性总结单中心采用TEVAR 联合体外开窗技术治疗累及主动脉弓的复杂主动脉疾病患者的初步经验,探讨该手术的可行性、安全性和有效性。
1 材料与方法
1.1 一般资料
收集2017年2月至2019年11月大连医科大学附属第一医院在TEVAR 术中采用体外开窗技术治疗的15 例累及主动脉弓的复杂胸主动脉疾病患者临床资料。 其中3 例为胸主动脉瘤,2 例为胸主动脉瘤伴发腹主动脉瘤,1 例为胸主动脉瘤伴发主动脉夹层,4 例为主动脉壁间血肿伴发穿透性溃疡,4例为主动脉夹层,1 例为TEVAR 术后支架近端Ⅰ型内漏。患者基本资料见表1。所有患者术前均接受主动脉全程+股动脉近段CTA 检查, 详细评估病变形态、近远端锚定区长度、主动脉解剖特征与变异、主动脉钙化和附壁血栓等情况,以及是否有合适入路。排除标准:①近端锚定区直径>42 mm;②病变累及主动脉弓大弯侧;③无合适主体支架入路;④难以耐受全身麻醉和手术。 患者和/或家属术前均得到关于手术流程、手术相关风险和获益、支架移植物改造和超适应证应用以及目前标准治疗方案的充分解释,并签署知情同意书。

表1 患者基本资料
1.2 开窗支架制备
CTA 明确主动脉弓大弯侧中心线作为弓上分支动脉开口定位基线,以此确定开窗位置。 支架输送系统操纵柄远端明确标记点,体外部分释放主体覆膜支架,充分展开前段需开窗部分并适当向后延伸1~2 节段,期间标记点始终保持垂直向上,与此点同一直线视为主动脉弓大弯侧中心线,支架近端开窗部位可以此为定位基线。 根据术前影像学测量结果标记开窗位置,手术刀破膜并修剪适当窗口大小。 完全原位回装改制后的覆膜支架送入输送系统内,并注水充分排气。
1.3 手术方法
全身麻醉生效后,左肱动脉穿刺置入5 F 短鞘,Pigtail 导管送达升主动脉,造影明确病变范围、主动脉弓上分支开口情况;股总动脉穿刺置入6 F 短鞘,预置两把ProGlide 血管缝合器(美国Abbott 公司),通过真腔送入标记Pigtail 导管于升主动脉并沿途造影证实,根据术前影像学资料调整至主动脉弓切线位造影,精确测量各项数据,主动脉、弓上分支开口及病变轮廓于透视屏幕上用马克笔标记,交换入Lunderquist 导丝于升主动脉;全身肝素化(75 U/kg),沿Lunderquist 导丝推送开窗主体支架至计划释放区域,推送过程中助手固定操纵柄,保证标记点始终垂直向下;收缩压降至90 mmHg(1 mmHg=0.133 kPa),开窗支架精确对位并匀速释放,完全释放后打开前端后释放装置;再次造影,评估各重建分支血流情况和病变隔绝情况,视分支血流和病变隔绝情况决定是否采取主动脉支架远端覆膜支架衔接、分支支架植入等措施,或随诊观察,或二期处理;收紧缝线,穿刺点压迫止血,送回普通病房或重症监护病房。
1.4 技术成功定义、术后处理和随访
技术成功:术后即刻造影显示病变区域隔绝满意,无明显内漏;重建的弓上分支血管血流通过速度满意,分支开口无明显狭窄。 术后常规给予抗生素抗感染,针对分支支架给予低分子肝素皮下注射(1 次/12 h)并过渡至口服抗血小板药物。 术后7~30 d、3 个月、6 个月、1年及此后每年复查主动脉CTA。 门诊或电话随访内漏、分支是否通畅、支架位置等。
2 结果
15 例患者中, 主体开窗支架近端植于主动脉Z0 区5 例,Z1 区5 例,Z2 区5 例。 开窗所用主体支架15枚均选用Valiant (Captivia 输送系统, 美 国Medtronic 公司),1 例加用Endurant 髂支延长段(美国Medtronic 公司)。 覆膜支架单开窗9 例,双开窗4例,三开窗2 例。 总计重建26 条分支血管,其中无名动脉(innominate artery,IA)3 条、左颈总动脉(left common carotid artery,LCCA)8 条、 左锁骨下动脉(left subclavian artery,LSA)11 条、迷走右锁骨下动脉(aberrant right subclavian artery,ARSA )2 条及IA、LCCA 共干各1 条;人工遮盖LSA 4 条。 4 例患者8条分支血管植入分支支架。 术后所有重建分支血管即刻造影显示血流通畅,技术成功率100%。 手术相关资料见表2, 典型病例见图1。 围术期死亡2 例(13.3%):1 例胸主动脉瘤伴主动脉夹层患者术后1周于家中猝死,考虑夹层进展或肺栓塞所致;1 例胸主动脉瘤伴腹主动脉瘤患者术后2 周肺部重症感染死亡。 无缺血性脑卒中、截瘫等严重并发症。
表2 手术相关资料

图1 TEVAR 结合体外开窗技术治疗主动脉弓部动脉瘤影像
中位随访时间24 个月(2~37 个月)。 失访2 例(3 条分支血管)。 术后2 个月1 例出现LSA 开口狭窄,无左上肢缺血和脑缺血症状,予随诊观察。 2 例(13.3%)见少许内漏,均在随访中内漏减少。 2 例死亡,其中1 例TEVAR 术后支架近端再发Ⅰ型内漏,术后8 个月死亡,死因不明,1 例胸主动脉瘤术后2个月新发急性Stanford B 型夹层并接受TEVAR 术,死于多脏器衰竭。
3 讨论
传统开放手术治疗主动脉病变创伤大、 死亡率高,体外循环、低温停循环等技术相关并发症较多[2-3,6]。 复合手术作为一种新型治疗方式,有手术时间短、创伤小、再干预率低等优点,但国内可开展此类手术的高级中心较少,也面临神经系统并发症发生率高、围术期死亡率高等问题[6],需要远期研究数据支持。 随着腔内手术技术和器材不断进步,胸主动脉疾病腔内治疗适应证不断扩大。 但对于累及主动脉弓上分支血管的主动脉病变, 传统TEVAR 术面对锚定区不足需遮盖弓上分支血管等难题,无法满足治疗需要。有文献报道认为,54%内膜第一破口距离LSA 较近,使TEVAR 需要15~25 mm 近端锚定区的要求受限[7],所有接受TEVAR 患者中40%~50%需要重建弓上分支血流, 以获得足够长度的健康锚定区[8],弓上分支血管的处理则是当前的重点与难点。 综上,此类病变腔内治疗的关键,在于既要有足够的健康锚定区隔绝病变,又要良好地重建弓上血流。 体外开窗技术可以解决此类传统TEVAR 术难题,多项研究早期结果证明,该技术安全可行[9-12]。
本研究采用的体外开窗技术并非弓上血流重建的唯一微创治疗策略,分支型支架移植物、原位开窗技术、平行支架技术(“烟囱” 技术、“潜望镜” 技术等)、多层裸支架技术等也是目前腔内治疗选择[11-12]。 定制分支支架需要生产周期,术前准备时间长,价格较为昂贵,无法应用于急诊情况,国内目前难以普及;原位开窗技术需要激光等特殊器材破膜,破膜时人工封堵弓上血管及应用脑血流保护装置,可增加神经系统并发症发生率,也有脱落覆膜致远端动脉栓塞等风险;平行支架技术操作简单、学习曲线短,受到国内外研究一致好评,有文献报道其一期内漏发生率为21.6%,近期疗效较好,中远期疗效不确定[13]。 体外开窗技术与其他技术相比,优点在于:①个体化支架制备简单,现有商品覆膜支架即可满足,可应对急诊情况;②使更多累及主动脉弓甚至升主动脉、近端锚定区条件较差等复杂、高危患者,得到腔内治疗机会;③支架应用数量较少,减少患者经济负担。 体外开窗技术应用存在一定难度,成功的关键在于窗口与分支血管能否良好对位,不仅需要术前、术中精确的影像学测量,还需要合理选择支架移植物、主体支架入路等。
本组患者术前均接受主动脉全程+股动脉近段CTA 检查,扫描层厚达到1 mm,甚至0.5 mm,并通过3D 工作站精确、标准测量主动脉内径、形态,病变累及范围,入路迂曲程度等。 本研究建议图像刻录光盘备用, 有条件可通过3D 打印主动脉模型辅助评估,术中主动脉造影若与术前影像学资料存在偏差,则以造影为 “金标准”。 术后CTA 随访评估手术效果,如有无内漏及重建分支通畅率等。
术中开窗支架制备取决于精准的影像学测量,窗口选择较大口径可提高窗口对位不准的容错率,但可能会导致窗口处发生内漏,且较大部分移除覆膜会损害覆膜支架的整体结构,导致支架结构不稳定, 甚至在收回释放系统时发生金属结构相互嵌顿。 陆清声[14]研究认为,夹层病变、小弯侧病变可予开大窗,利于保持分支动脉通畅、避免分支支架植入;大弯侧病变或动脉瘤适合开小窗,利于预防内漏及避免远期移位。 本组4 例患者(8 条分支血管)接受2 支血管 “共窗”,其中1 例(患者13)胸主动脉瘤近LSA 开口,予三开窗重建IA、LCCA、LSA,开窗支架释放后造影显示IA、LCCA 经覆膜支架第1 窗口显影,LSA 经瘤体供血显影, 予以补救措施:IA、LCCA 分别植入覆膜分支支架, 近端第1 窗口进入主动脉,LSA 超选入第2 窗口植入覆膜分支支架,另植入主动脉覆膜支架隔绝瘤腔及封堵开窗支架第3 窗口,后球囊扩张各分支支架,造影示少许内漏,弓上各分支显影良好(图2)。 窗口对位不准的补救措施,应根据术者经验灵活应用。 至于双开窗还是三开窗,应根据术前、术中精确测量,第1 开窗对位精准,其余窗口皆可精准对位;建议由经验较多的医师行多开窗手术。
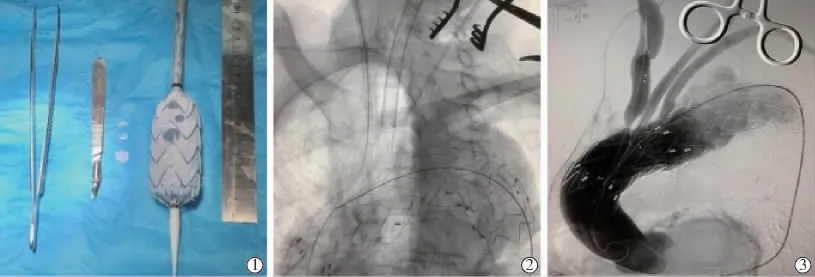
图2 术中主动脉支架定位误差及补救措施
本组1 例主动脉夹层患者(患者15)破口紧邻LCCA 开口,为避免内漏、保持分支血管通畅,制备IA 和LCCA 共干、LSA 双开窗支架, 并体外修剪Endurant 16 mm(近端)×20 mm(远端)×95 mm” 髂支呈 “两分支” 式人工血管,内衬式缝于IA 和LCCA共干窗口, 两分支前端悬于主体开窗支架内前方;术后造影显示病变隔绝良好,无内漏形成,各分支动脉血流通畅(图3)。 此为体外开窗技术的拓展应用,不失为一种个体化的合适选择。

图3 体外开窗和缝制分支支架技术
本组15 例患者中4 例(26.7%)人工遮盖LSA。Buth 等[15]研究认为TEVAR 围术期截瘫或脊髓损伤与LSA 遮盖显著相关。 Cooper 等[16]研究 认 为遮 盖LSA 可能会提高截瘫发生率,但预防性LSA 重建对脑血管意外无保护作用。 临床实践中面临的问题是,为减少Ⅰ型内漏,能否选择性覆盖LSA。 本研究经验认为, 患者病变个体化较强, 术前通过考量Willis 环完整性、 评估缺血性脑卒中风险权衡风险与获益,如病变距LSA 较近、非左椎动脉优势供血、缺血性脑卒中风险较低, 可选择性覆盖LSA。 该4例LSA 覆盖患者,术后随访均未发生截瘫和缺血性脑卒中。
本研究局限性为样本量较小、 由单中心实施,患者主动脉病变多样性, 分支血管重建方式多样性,随访时间较短,无其他技术作为对照组。 但本研究认为体外开窗技术提供了一种新的治疗策略,具有支架易得、个体化开窗支架制作相对简单、可满足急诊手术需要等优点。 替代开放手术或复合手术的单纯腔内手术治疗锚定区位于Z0 区或更近端的复杂主动脉病变,既往已有报道[17]。 但国内外对此类手术尚未达成共识。 随着手术技术和器材进步,可能逐渐放宽主动脉夹层腔内治疗适应证。 腔内治疗虽然存在再次干预风险, 但可避免开放手术,让更多累及主动脉弓部,甚至升主动脉的复杂型胸主动脉疾病患者受益。
本研究采用的弓上血流重建技术,均为现有腔内器材超适应证应用,尚需要进一步器材革新和更大规模研究加以证实和评估。 由于胸主动脉疾病患者个体化较强,应灵活选择或联合各种技术,完全攻克主动脉弓部病变仍需进一步研究。
本研究结论认为,TEVAR 体外开窗技术治疗累及主动脉弓的复杂主动脉疾病可行、 安全有效,近期效果满意。 但缺乏大样本远期研究及与其他技术,或联合其他技术随机对照研究。

