采用专用覆膜支架行经颈静脉肝内门体分流术2年随访观察
刘 芳, 赵剑波, 王江云, 谭 卿, 彭崎峰, 苏时钦, 郭 备
经颈静脉肝内门体分流术(transjugular intrahepatic portosystemic shunt,TIPS)目前已广泛应用于治疗门静脉高压并发症,多项指南明确推荐其为门静脉高压食管胃底静脉曲张破裂急性大出血高危患者一线治疗方案[1-2]。 TIPS 专用Viatorr 覆膜支架2004年12月获美国FDA 批准[3]临床应用后于2016年进入我国临床。 本研究回顾性分析采用Viatorr 支架行TIPS 术治疗117 例患者的效果, 旨在为Viatorr 支架在国内应用积累经验。
1 材料与方法
1.1 临床资料
收集2017年4月至2018年12月在南方医科大学南方医院接受Viatorr 支架行TIPS 术治疗的连续145 例肝硬化患者临床资料。 纳入标准: ①年龄≥18 周岁;②无重度心、肺、肾功能不全;③无严重门静脉血栓(门静脉阻塞>50%)和严重海绵样变;④术前诊断无肝癌或其他恶性肿瘤;⑤肝硬化所致顽固性腹水; ⑥急诊食管胃底静脉曲张破裂出血;⑦早期TIPS 或二级预防。 最终纳入117 例患者。
1.2 手术方法
根据《经颈静脉肝内门体静脉分流术临床技术指南》[4]进行手术操作。 患者取仰卧位,常规予心电、血压及血氧饱和度监测;消毒铺巾,局部浸润麻醉,穿刺右股动脉,Cobra 导管(日本Terumo 公司)插管至肠系膜上动脉行间接门静脉造影,观察门静脉大小和位置; 穿刺右颈内静脉, 置入10 F 血管鞘(RUPS 穿刺套装, 美国Cook 公司),测量记录右心房压力; 血管鞘置于肝右静脉, 透视监测下引入TIPS 穿刺针对准门静脉左右分支或分叉部穿刺,成功后引入金标猪尾导管至门静脉,头端置于脾静脉远端造影(对脾切除术后患者,导管置于肠系膜上静脉造影),测量记录术前门静脉主干压力;采用相应直径Interlock 弹簧圈(美国Boston 公司)和/或组织胶(北京康派特医药科技公司)对曲张静脉进行栓塞;更换导丝,先用6 mm 球囊(美国强生公司)行分流道预扩张,再植入合适长度Viatorr 支架(直径8 mm,覆膜段长度5~8 cm,美国Gore 公司),建立肝静脉- 门静脉分流道; 造影复查分流道情况,测量术后门静脉主干和右心房压力, 门静脉压力梯度(portal pressure gradient, PPG)下降至<12 mmHg(1 mmHg=0.133 kPa) 或较术前下降>50%时结束手术(否则继续用7 mm 球囊扩张分流道,测量压力如不达标则继续扩张至8 mm, 再次测量并记录压力后结束手术); 右腹股沟和右颈内静脉穿刺点压迫止血。
1.3 术后处理与随访
术后常规心电监护24 h,术后1 个月内严格控制动物蛋白口服摄入量,常规服用乳果糖和利福昔明预防肝性脑病。 所有患者术后均未应用口服抗凝药物。 术后l、3、6 个月随访复查彩色多普勒超声和实验室指标,然后每6 个月随访1 次。 随访期出现术前症状(出血或腹水)复发或超声检查提示分流道血流信号异常,对出血患者需进一步行胃镜检查确定食管胃底静脉曲张情况, 通过CT 检查为介入修正(选择原位或平行TIPS)做准备,DSA 导引下行支架修正。 随访截至点为2020年4月,记录相应随访时间、终点事件类型及有关症状。
1.4 统计学处理
采用SPSS 23.0 软件进行统计学分析。 计量资料以均数±标准差(±s)表示,术前术后PPG 比较用t 检验,P<0.05 表示差异有统计学意义; 采用GraphPad Prism 8.0 软件分析术后分流道累计通畅率、累计生存率、肝性脑病累计发生率和肝癌累计发生率。
2 结果
117 例患者接受TIPS 术, 支架植入成功率为100%。 术后患者PPG 由术前平均(23.19±5.92) mmHg降低至平均(10.19±3.81) mmHg(P<0.05)。 围手术期死亡率为3.4%(4/117),3 例为急诊TIPS,死因分别为肾衰竭高钾血症所致心脏骤停、术中穿刺损伤肝动脉腹腔大出血、术后并发脑出血;另1 例因术后颈部穿刺部位出血压迫气管致死。
113 例患者随访3~36 个月,平均(23.16±7.65)个月;基线资料见表1。 截至2020年月4月,Child-Pugh 评分为平均(7.74±1.84)分。 有6 例患者症状复发(再出血5 例,腹水1 例),其中3 例支架分流道造影和测压显示正常,3 例造影显示分流道狭窄,总体一期分流道狭窄2.7%。 术后6、12、24、36 个月支架分流道一期累计通畅率分别为99.1%、98.2%、97.4%、97.4%(图1)。 肝性脑病发生率为15.9%(18/113)(图2),其中10.6%为隐匿性肝性脑病,5.3%为显性肝性脑病。 死亡9 例,其中7 例死于肝衰竭及相关并发症,2 例死于肝性脑病,病死率为8.0%。 术后6、12、24、36 个月累计生存率分别为96.6%、93.2%、92.3%,92.0%(图3)。 确诊为原发性肝癌7 例(6.2%),术后6、12、24、36 个月肝癌累计发生率分别为0%、3.5%、6.2%, 6.2%(图4)。 2 例患者分别于术后9 个月、16个月接受肝移植术。
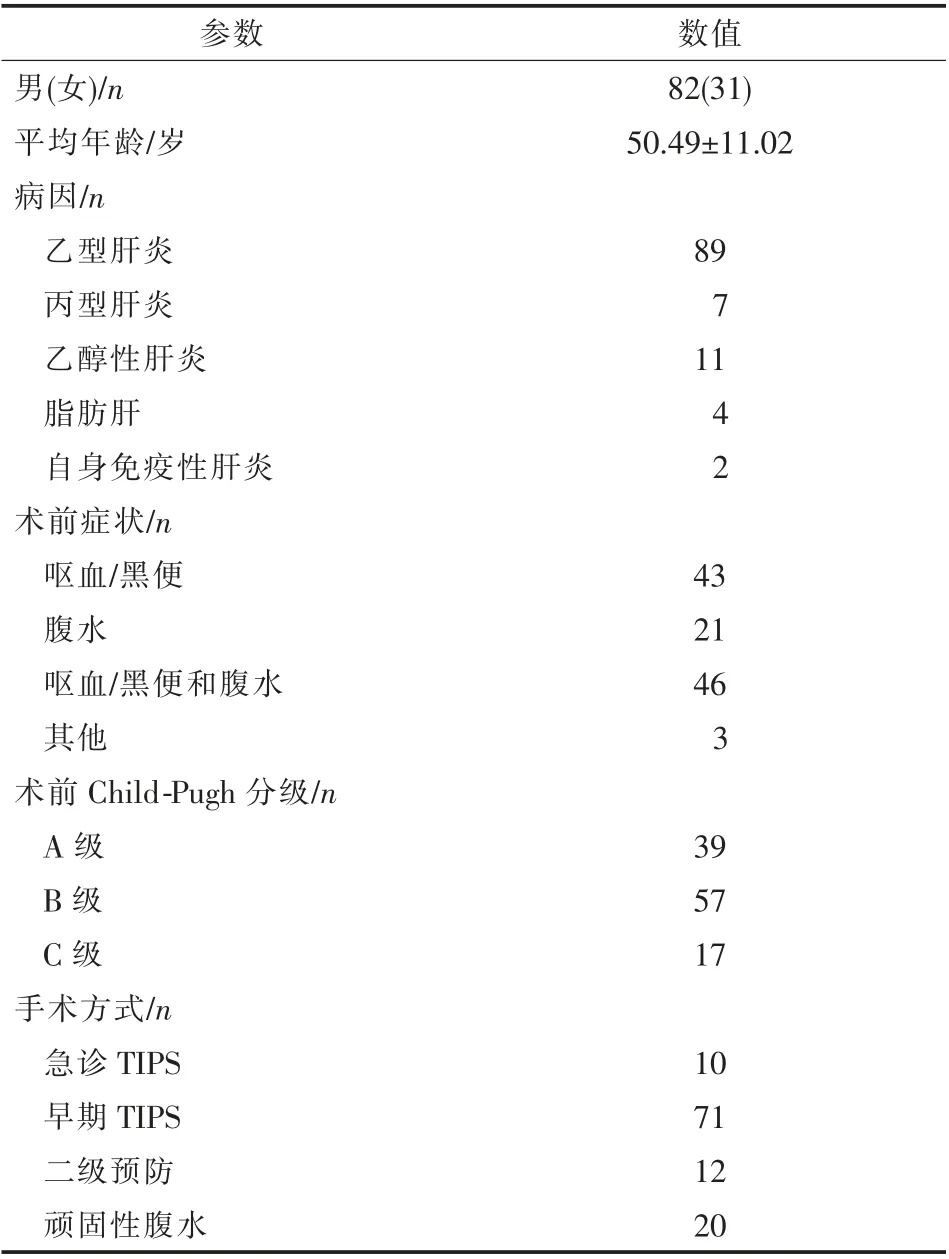
表1 113 例随访患者基线资料

图1 术后分流道累计通畅率

图2 术后肝性脑病累计发生率

图3 术后累计生存率

图4 术后肝癌累计发生率
3 讨论
TIPS 术由Richter 等首次报道, 作为一种非选择性门静脉分流术, 经过30 余年已发展为治疗顽固性腹水的有效方法之一, 同样也可缓解60%~70%难治型肝性胸腔积液患者症状[5]。 对于食管胃底静脉曲张和存在高风险的治疗失败患者, 如Child- Pugh C 级(<14 分)或B 级伴活动性出血患者,TIPS 已成为一线治疗方案[6]。 初期应用TIPS 术后金属裸支架狭窄率高达50%[7]。因此,分流道狭窄一直是TIPS 治疗关键问题,而支架研制是提高分流道通畅率至关重要的一步。 国外相关文献报道表明,采用专用覆膜支架(Viatorr 支架)行TIPS 术有更高的分流道通畅率[8]。
Viatorr 支架在国内应用前,临床上较多采用单纯Fluency 覆膜支架或Fluency 覆膜支架联合裸支架行TIPS 术。 单纯Fluency 覆膜支架行TIPS 术后1年、2年通畅率分别为81.3%、71.5%[9]。Fluency 覆膜支架联合裸支架行TIPS 术后1、2、3年通畅率分别为87%、72%、61%[10]。 鲍应军等[11]回顾性分析Viatorr支架行TIPS 治疗34 例门静脉高压患者,术后随访1~14 个月,分流道通畅率为100%(34/34),肝性脑病发病率为5.88%(2/34)。 孙旻煌等[12]回顾性分析46 例肝硬化行TIPS 患者,随访1 周~12 个月显示Viatorr 支架通畅率为100%。 本组113 例患者平均随访(23.16±7.65)个月,仅3 例发生分流道狭窄,1年、2年通畅率分别为98.2%、97.4%。 此外,本研究剔除了门静脉严重血栓和海绵样变患者, 旨在去除术后抗凝对支架通畅率的影响。 目前文献报道认为门静脉血栓不超过50%患者,TIPS 术后血流冲刷作用已 足 够 消 除 血 栓[1,13]。 但 对于 门静 脉严重血栓和海绵样变患者,TIPS 术后仍建议抗凝治疗。
本组患者围手术期4 例死亡,其中3 例为急诊手术, 占急诊TIPS 术25%, 死因分别为术后肾衰竭、术中穿刺损伤肝动脉腹腔大出血、术后并发脑出血;提示急诊TIPS 围手术期仍有相当死亡率,应谨慎施行。 相关文献报道,对食管胃底静脉破裂出血患者行急诊TIPS 死亡率和并发症较多,6 周死亡率达48%[14],1 个月死亡率为28%[15]。
本组有18 例出现肝性脑病,发生率15.9%。 本组肝性脑病发生率低于其他研究[10,12]的可能原因:①大部分为病毒性肝炎肝硬化,病因学控制相对良好,且Child- Pugh 评分为平均(7.74±1.84)分;②建立完善的专门微信随访团队,指导患者术后严格饮食,常规应用乳果糖联合利福昔明12 个月;③术中采取逐级扩张支架分流道,在保证达到目标压力的同时保持最小支架分流道直径, 使患者逐渐适应。但有研究表明第一代Viatorr 支架即使是术中亚扩张,术后3 个月支架基本上也会扩张至额定的8 mm直径[16]。 本研究未对本组亚扩张患者进行相应测量,亚扩张的目的是在确定压力达标的前提下让患者有一逐渐适应过程,从而尽可能降低术后肝性脑病发生和肝功能受损。
本组患者随访期原发性肝癌发生率为6.2%。肝硬化患者发展为肝癌有确定的危险因素, 如年龄、男性和潜在的病毒性肝炎[17]等。 研究表明肝静脉压力梯度(HVPG)越高,肝癌发生率越高,HVPG>10 mmHg时肝癌发生风险增加6 倍[18]。 近期文献报道显示,TIPS 术后肝癌发生率与内科治疗相比下降,其可能机制在于TIPS 降低门静脉高压对肠道屏障的影响,减小肠道菌群失调导致的炎性反应,从而降低肝癌发生率[19]。 但具体机制仍有待进一步研究。
本研究为单中心回顾性研究, 随访时间不够,病例数仍相对不足,远期疗效还有待观察分析。
综上所述, 采用Viatorr 支架行TIPS 术治疗肝硬化门静脉高压并发症安全有效, 中期疗效确切,分流道通畅率较高,配合良好的相关药物及饮食控制,肝性脑病发生率较低。

