经肠系膜上静脉肝外门体分流术治疗门静脉海绵样变性1 例
李卫校, 崔明哲, 李 强, 宋德洋, 陈江波, 逯党辉, 张东宾, 翟水亭
Balfour 和Stewart 于1869年首次报道了门静脉海绵样变(cavernous transformation of the portal vein,CTPV)[1]。 门静脉高压患者CTPV 的发生率约为5%~10%[2]。 CTPV 患者常合并消化道出血、顽固性腹水等门脉高压症状。 经颈静脉肝内门体分流术(transjugular intrahepatic portosystemic shunt,TIPS)是治疗肝硬化门脉高压引起的顽固性腹水及消化道出血的有效治疗方法[3-5]。 在实施常规TIPS 术的过程中,最关键的步骤是成功穿刺到门静脉左、右干或主干,然而CTPV患者的门静脉左、右干及门静脉主干闭塞,手术难度较大。为了提高CTPV 患者实施介入门体分流术的手术成功率,2020年12月河南省人民医院血管外科对1 例CTPV 患者成功实施了经肠系膜上静脉肝外门体分流术(transmesenteric vein extrahepatic portosystemic shunt, TEPS), 即通过腹部脐下正中纵形小切口暴露并穿刺肠系膜上静脉属支,经肠系膜上静脉穿刺下腔静脉, 并在二者之间采用覆膜支架建立起门-体分流通道。 现将治疗经过报道如下。
1 临床资料
患者男,57 岁。 发现乙肝肝硬化病史10 余年,近20 余天出现反复呕血黑便,无黄疸、无肝性脑病发作。术前胃镜检查示:①食管静脉曲张(Ⅲ度、红色征阳性);②门静脉高压性胃炎。 术前CT 检查示肝硬化,腹水,门静脉主干和左右干闭塞伴海绵样变血管形成,肠系膜上静脉和脾静脉通畅,粗大的曲张食管静脉(图1①②③)。Child-Pugh 分级:B 级(7 分)。术前诊断:①上消化道出血;②食管胃底静脉曲张;③门静脉高压;④门静脉海绵样变性;⑤乙肝肝硬化失代偿期。 术前向患者及家属讲明手术的可能疗效及风险,并签署知情同意书。
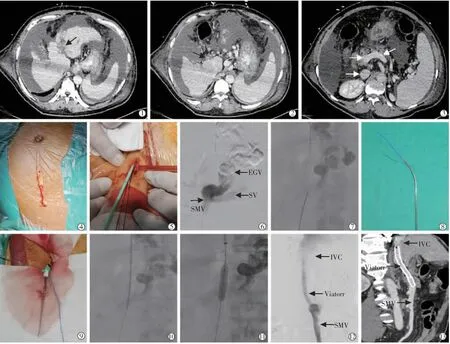
图1 TEPS 术的围手术期影像
手术过程:穿刺患者右侧颈内静脉,置入RUPS-100 穿刺套针(Cook 公司,美国)的10 F 抗折长鞘至下腔静脉。 于腹部脐下做长约8 cm 正中纵行切口(图1④); 牵出长约15 cm回肠,分离暴露肠系膜上静脉的属支;穿刺并置入6 F 导管鞘至肠系膜上静脉主干(图1⑤),造影示门静脉主干及左右干闭塞,肠系膜上静脉和脾静脉通畅、粗大食管胃底曲张静脉形成,肠系膜上静脉压力28.5 mmHg(1 mmHg=0.133 kPa)。超选食管胃底静脉曲张血管团,注入栓塞胶(北京康派特医疗器械有限公司,中国)和碘油混合剂(江苏恒瑞医药股份有限公司)(栓塞胶与碘油混合比例为1∶2)12 mL 栓塞曲张静脉(图1⑥)。 将自制导丝抓捕器经右侧颈内静脉10 F 鞘管引入至下腔静脉拟穿刺水平(图1⑦);经肠系膜上静脉6 F导管鞘沿加硬泥鳅导丝引入RUPS-100 穿刺套针的14 G 金属管及其内的蓝色导管至肠系膜上静脉拟穿刺切入点(图1⑧⑨);透视下采用类 “瞄准镜技术[6]”,调整金属管的前端垂直指向下腔静脉内的自制导丝抓捕器,并穿刺(图1⑦);通过回撤自制导丝抓捕器将加硬泥鳅导丝经右侧颈静脉的鞘管牵拉引出体外建立“右侧颈内静脉-肠系膜上静脉通路”,并采用止血钳在体外固定导丝的两端。经右侧颈内静脉鞘管沿加硬泥鳅导丝推进RUPS-100 穿刺套针穿透下腔静脉前壁及肠系膜上静脉主干后壁进入肠系膜上静脉主干管腔内,并将10F 长鞘的前端留置在肠系膜上静脉主干管腔内(图1⑩); 经10F 抗折长鞘引入8~80 mm Viatorr 覆膜支架(Gore 公司,美国)至肠系膜上静脉,透视下定位释放支架,并采用直径8 mm 球囊(Rival,BD 公司,美国)后扩张覆膜支架(图1);肠系膜上静脉压力下降至18.4 mmHg,造影显示覆膜支架管腔通畅,无对比剂外溢(图1)。 结扎穿刺处肠系膜上静脉属支,留置腹腔引流管并关闭腹腔。 术后给予患者低蛋白饮食,并保持大便通畅,口服天冬氨酸鸟氨酸颗粒和乳果糖口服液预防肝性脑病等[7]。 术后3 个月随访期内, 患者无肝性脑病发作, 未再发消化道出血症状、腹水等症状。 复查增强CT 显示肠系膜上静脉及覆膜支架管腔通畅(图1)。
2 讨论
TIPS 术是治疗肝硬化门脉高压引起的顽固性腹水及消化道出血的有效方法[3-5],而Viatorr 覆膜支架的临床应用进一步提高了TIPS 术的疗效[8]。 在实施TIPS 术的过程中,最关键的步骤是成功穿刺到门静脉左、右干或主干。 CTPV 患者的门静脉主干和门静脉左、右干闭塞,管腔内容物质地坚硬,海绵样变的侧支血管迂曲纤细,采用经颈静脉途径建立TIPS 通路技术难度较大。 为了提高CTPV 患者TIPS 术的技术成功率,国内外学者做了诸多尝试。 单纯经颈静脉途径实施TIPS 术采用RUPS-100 穿刺套针盲穿门静脉海绵样性血管的精准性较差、创伤较大。 Li 等[9]和Qi 等[10]分别报道了采用单纯颈静脉途径实施TIPS 的成功率仅5%~16%[9-10]。 联合采用经颈静脉和经皮穿肝途径实施TIPS 术可将手术成功率提高至28%~89%[9-11]。 该途径采用21 G 穿刺针穿刺门静脉海绵样变血管,并开通门静脉主干,后续再联合常规TIPS术建立门体分流通道。 该技术采用21 G 穿刺针穿刺门静脉海绵样变血管,减小了手术创伤,同时开通门静脉后再实施常规TIPS 术,手术的精准率有了一定程度的提高。 然而穿刺和开通海绵样变性的门静脉仍然极其复杂耗时。联合采用经颈静脉和经皮经脾途径实施TIPS 术的手术成功率相对较高,为40%~100%[9-10,12-13]。 对于脾静脉通畅的患者,采用该种联合途径可以提高手术成功率。 在我国,脾切除术是导致门静脉栓塞(PVT)和CTPV 的最常见原因[14],而该部分患者无法采用该联合途径进行手术治疗。 绝大多数CTPV 患者肠系膜上静脉的远端分支静脉通畅,且直径增粗。 因此理论上采用经肠系膜分支静脉途径开通门静脉技术难度相对较小。诸多学者分别报道了联合采用经肠系膜静脉和经颈静脉途径对CTPV 患者成功实施TIPS 术的个案报道[15-19]。 然而目前该技术的相关报道均局限于1、2 例的个案报道。影响该技术广泛使用的主要原因有:①开通海绵样变的肠系膜静脉和门静脉的过程仍较为复杂耗时;②该技术最终仍需联合实施常规TIPS 术。 因此需要更加精准、更容易实施的手术方式治疗CTPV。
课题组对本病例创新性地采用经腹部脐下正中纵行小切口入路,从肠系膜上静脉直接穿刺下腔静脉,并在二者之间建立起门体分流通道。 该术式有如下优点:①TEPS 术创伤较小。手术仅需在腹部脐下做长约8 cm 正中纵行小切口,其余操作均为介入微创操作。②TEPS 术精准性较高。首先穿刺肠系膜上静脉属支的过程在直视下进行;其次下腔静脉直径较为粗大,且位置相对固定,另外从肠系膜上静脉穿刺下腔静脉的过程中采用自制导丝抓捕器标记下腔静脉的位置,并采用类 “瞄准镜技术” 引导,因此从肠系膜上静脉穿刺下腔静脉过程的精准性较高。 然而采用单纯颈静脉途径、联合经颈静脉和经皮穿肝途径、 联合经颈静脉和经皮穿脾途径实施TIPS 术均需穿刺海绵样变性的细小侧枝血管, 因此手术的难度较高、精准性较差。 ③TEPS 术安全性较高。 首先从肠系膜上静脉穿刺下腔静脉成功后, 采用加硬泥鳅导丝建立起“右侧颈内静脉-肠系膜上静脉通路”, 并采用止血钳固定露出体表的导丝两端, 防止手术过程中导丝的意外脱出;其次下腔静脉和肠系膜上静脉壁的穿刺点呈逐渐扩大的过程(0.035 英寸-10 F-8 mm),最终静脉壁严密包裹覆膜支架,避免穿刺点渗血。 出院前及术后3 个月复查CT 显示支架管腔通畅、腹膜后无血肿。④TEPS 术简单易行。与其他手术方式相比,TEPS 术无需开通海绵样变性的门静脉主干及左右干, 亦无需最终联合常规TIPS 术。 因此TEPS 术将手术过程极大简化。
本例的不足之处:①从肠系膜上静脉穿刺下腔静脉的过程中,穿刺针损伤下腔静脉后壁。 出现此情况的原因可能是患者处于仰卧位时,腹水及内脏器官压迫导致下腔静脉前后径变窄,因此穿刺过程中容易同时穿透下腔静脉前后壁。 在后续的手术过程中,计划采用直径粗大的球囊标记下腔静脉的位;充盈的球囊可使下腔静脉位置显示的更加准确,同时能使下腔静脉前后径增大,避免穿刺过程中损伤下腔静脉后壁。②对于肠系膜上静脉主干闭塞的门静脉海绵样变性患者和门静脉血栓的患者能否实施TEPS 术尚有待进一步探索证明。 ③本报道仅有个案患者,尚需纳入更多的患者进一步证明该术式的疗效。
总之,TEPS 术有望为治疗门静脉海绵样变性提供一种新的手术方案, 但TEPS 术的手术适应症有待进一步探索,其可行性、安全性及有效性亦尚待进一步证明。

