危重肺动脉瓣狭窄介入治疗临床研究
王思宝, 泮思林, 罗 刚, 纪志娴, 刘 娜
危重肺动脉瓣狭窄(critical pulmonary stenosis,CPS)属动脉导管依赖型先天性心脏病,其狭窄程度近似闭锁,部分患儿可伴有右心室发育不良。 由于右心室搏出严重受阻致使心房水平右向左分流,CPS 患儿早期可出现严重低氧血症,伴不同程度右心功能不全,需生后早期进行治疗。 经皮球囊肺动脉瓣成形术(percutaneous balloon pulmonary valvuloplasty,PBPV)自1982年Kan 等[1]首次应用以来,已逐渐成为CPS 首选治疗方法[2]。然而由于CPS患儿脏器发育不成熟、手术耐受性差、病情危重等,目前国内外CPS 介入治疗仍面临诸多挑战[3]。 本文回顾性分析单中心CPS 患儿介入治疗相关资料,评价治疗效果并总结临床经验。 现将结果报道如下。
1 材料与方法
1.1 临床资料
回顾性分析2015年10月至2019年10月在青岛大学附属妇女儿童医院接受PBPV 治疗的36例CPS 患儿临床资料。 其中男23 例,女13 例,中位年龄12(3.00,27.00) d,中位体重3.45(3.03,3.77)kg。经超声心动图或心血管造影诊断为CPS,即肺动脉瓣口重度狭窄,右心室收缩压大于左心室,伴有动脉导管未闭、卵圆孔(房间隔缺损)双向分流或右向左分流和三尖瓣中度至重度反流[4]。 排除右心室依赖冠状动脉循环及需外科手术治疗的先天性心脏病。 36 例患儿均存在不同程度气促、发绀,未吸氧下经皮血氧饱和度(SpO2)波动在60%~91%,平均(81.28±7.91)%;诊断明确后,术前均接受前列腺素E1(5 ng·kg-1·min-1)泵入,维持动脉导管开放。 本研究已获医院伦理委员会批准(QFELL-KY-2019-64),入组患儿监护人均签署手术知情同意书。
1.2 手术方法
手术前2 h 停止输注前列腺素E1。 手术常规取仰卧位, 采用Bair Hugger 升温系统预热手术床,设置温度为38℃;静脉全身麻醉下行气管插管呼吸机辅助通气,右股静脉穿刺,选用4 F 右心导管行右心室造影(图1①),明确肺动脉瓣开口位置和瓣口大小, 评估右心室发育情况, 测量肺动脉瓣环(pulmonary valve annulus,PVA)直径、右心室收缩压及主肺动脉压力; 先选用单根0.014 英寸冠状动脉导丝通过狭窄的肺动脉瓣口, 建立球囊输送轨道(CPS 患儿肺动脉瓣口极度狭窄,常规泥鳅导丝建立轨道难度大),选择冠状动脉球囊预扩张肺动脉瓣,然后送入第2 根冠状动脉导丝建立与第1 根导丝并行轨道(图1②),根据PVA 直径选择合适球囊逐级扩张。 术中监测心率、心律、SpO2、无创血压等生命体征。
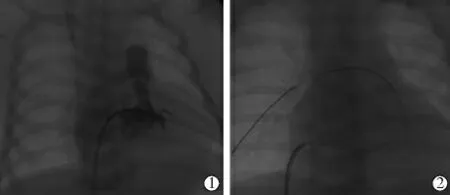
图1 PBPV 术相关影像
1.3 随访
查阅患儿住院和门诊病案资料,获取术前和术中相关资料, 常规术后第1、3、6、12 个月及以后每年定期门诊随访复查,获取超声心动图资料。 参照美国超声心动图学会小儿心脏测量指南[5],测量右心室内径(right ventricular diameter,RVD)、左心室内径(left ventricular diameter,LVD)、 跨肺动脉瓣压差(transpulmonary valve pressure gradient,TVPG)、PVA直径, 估测瓣膜反流程度。 术后6 个月及以上复查TPG≥36 mmHg(1 mmHg=0.133 kPa)定义为再狭窄[6]。
1.4 统计学分析
采用SPSS 21.0 软件进行统计学分析。 正态分布计量资料以均数±标准差(±s)表示,两样本均数间比较用配对t 检验,不同随访时间数值比较用单因素方差分析;偏态分布计量资料以中位数(4 分位数间距)M(Q25,Q75)表示。 P<0.05 为差异有统计学意义。
2 结果
36 例CPS 患儿PBPV 手术均获成功。 3 例因中度右心室发育不良,同期行动脉导管支架植入术;3 例术后出现右心室流出道痉挛,1 个月后平均TVPG 下降至(29.67±4.73) mmHg。 所有患儿术后即刻平均TVPG 由术前(88.14±15.81) mmHg 降至(35.53±9.51) mmHg(P<0.05),平均右心室收缩 压 由术前(90.08±18.18) mmHg 降至(52.69±17.32) mmHg(P<0.01),平均SpO2由术前(81.28±7.91)%升至(92.89±3.9)%(P<0.05)。 除术中导管或球囊进肺动脉瓣及球囊充盈扩张时出现短暂性心动过缓和低氧血症外,无严重心律失常、瓣膜损伤、心脏压塞等并发症。
术后失随访1 例,35 例患儿规律随访,平均26.5个月(6 个月至4年)。 术后3 个月平均TVPG 进一步下降,术后1年趋于稳定(图2)。 5 例随访过程中平均TVPG 逐渐升高至(67.80±6.41) mmHg,于术后平均6.2(5~7)个月行二次PBPV 术,平均TVPG 降至(27.80±2.16) mmHg(P<0.05),其中1 例二次PBPV术后5 个月TPG 再次升高至117 mmHg,考虑有肺动脉瓣发育不良,6 个月龄时行外科肺动脉瓣膜切开术,术中发现肺动脉瓣二叶瓣畸形, 术后随访情况良好。肺动脉瓣再狭窄率为14.3%(5/35), 近中期随访成功率为97.1%(34/35)。 随访期间,3 例三尖瓣反流为中度,其余仅为轻微反流,所有患儿无中-重度肺动脉瓣反流。与术前相比,患儿术后右心室结构逐渐增长。随访6 个月,PVA 直径均值由术前(7.79±0.96) mm 增至(8.96±0.68) mm(P<0.05)。 随访1年,右心室前壁厚度(right ventricle anterior wall,RVAW) 均 值 由 术 前(4.35±0.64) mm 降至(3.24±0.43) mm(P<0.05);右心室内径(RVD)/左心室内径(LVD)比值由术前0.61±0.16 下降至0.51±0.08(P<0.05)(表1)。

图2 PBPV 术前后平均TVPG 变化

表1 PBPV 术前后右心室结构参数变化
3 讨论
肺动脉瓣狭窄占所有先天性心脏病10%。 目前PBPV 术已成为CPS 首选治疗方法。 CPS 患儿肺动脉瓣口极度狭窄,多伴有右心室腔狭小、右心室流出道狭窄变形,PBPV 操作最大困难在于建立球囊输送轨道;同时患儿脏器发育不成熟、对手术耐受性差,也对手术构成极大挑战。 研究显示,有经验的心脏中心新生儿CPS 介入治疗成功率可达90%, 再狭窄发生率约为30%, 严重并发症发生率约为0.4%[7]。本组患儿PBPV 术治疗后再狭窄发生率为14.3%,无严重并发症及死亡。
TVPG 是评价PBPV 疗效的主要指标之一。 术后即刻TVPG 降至术前60%以下被认为扩张有效。由于CPS 患儿右心室压力负荷升高,右心室心肌向心性肥厚、 顺应性下降及术后右心室流出道痉挛等,PBPV 术后残余TVPG 在漏斗部水平持续存在[8-9]。本组PBPV 术后6 个月仍可见TVPG 降低,提示不可将即刻TVPG 作为手术成败的标准。 球囊直径是影响PBPV 效果的主要因素。目前临床上多选择1.2~1.4倍于PVA 的球囊扩张肺动脉瓣,远期随访显示患儿存在肺功能不全和大量肺动脉瓣反流风险, 部分患儿甚至需要置换瓣膜[10]。 本组球囊/瓣膜比值为0.9~1.3,对患儿多采用球囊逐级扩张,术后TVPG 下降满意,手术过程更为顺利。 本组患者再狭窄发生率为14.3%,二次PBPV 术后效果满意,无严重肺动脉瓣反流发生。
部分伴有右心室发育不良CPS 患儿PBPV 术后右心室功能评估,一直是研究热点[11]。 研究表明肺动脉瓣狭窄患儿长时间右心室高负荷和低氧暴露,对右心室发育会产生负面影响[12]。 尽早解除肺动脉瓣狭窄对于右心形态学转归具有重要意义。Gildein 等[13]研究表明解除CPS 患儿肺动脉瓣梗阻,可降低右心室压力负荷, 利于肺动脉瓣追赶性生长[14]。 瓣膜狭窄越严重,右心室心肌越容易纤维化,几何形态重构更需要一定时间,因此术后心脏形态恢复速度相对迟缓。 本组患者PBPV 术后PVA 平均直径与术前相比显著增大,术后6 个月右心室结构开始显著生长,术后1年逐渐恢复正常,这与国外学者研究结果一致[15-16]。
总结本研究有如下体会: ①重视围术期管理,术前应用前列腺素E1 保持动脉导管开放, 维持肺血灌注,改善缺氧状态和维持内环境稳定,术中维持体温和循环稳定,术者操作规范、细致。 本组患儿通过单(双)冠状动脉导丝技术建立球囊输送轨道,既提高轨道建立成功率,也可避免发生严重心律失常、右心室流出道痉挛等并发症[17]。 ②虽然对少数患儿应用较小尺寸球囊可能需再次行PBPV 术,但切勿因盲目追求 “理想” TVPG 选用较大球囊,这可能会导致严重肺动脉瓣反流,甚至右心室流出道损伤等严重并发症。 ③既往研究显示,肺动脉瓣发育异常CPS 患儿PBPV 成功率仅为25%[18],外科手术是其治疗首选,因此要严格把控手术适应证。 术前应对肺动脉瓣狭窄类型、右心室发育、冠状动脉循环做 出准 确判断[19]。 本组1 例 患儿 二次PBPV 术后TVPG 不降反升,三尖瓣反流加重,伴随SpO2下降,行外科手术提示肺动脉瓣二叶瓣畸形。
综上所述,CPS 患儿病情危重,早期识别并积极干预治疗十分重要。 CPS 介入治疗需重视围手术期管理,严格把控手术适应证,术者应操作精细,熟悉手术器械特性等。CPS 患儿PBPV 术后疗效确切,可实现早期心脏形态学转归, 具有良好的安全性。PBPV 可作为治疗CPS 首选方案,但手术难度大,具有一定的技术依赖性。 本研究存在一定局限性,今后需进行多中心大样本远期随访研究。

