多靶动脉减量灌注化疗联合125I 放射性粒子植入治疗ⅢB 期非小细胞肺癌的临床意义
李虎子, 赵 成, 方文岩, 张 洪, 贺 斌, 段振东
Ⅲ期非小细胞肺癌(non-small cell lung cancer,NSCLC)患者预后较差[1-2],中位生存期8~10 个月,5年生存率仅2.0%~7.0%, 尤其是伴有N3 期淋巴结转移的患者预后更差[3]。 治疗失败的主要原因为原发灶未控和远处转移[4]。 同步放化疗可以作为局部进展期NSCLC 的标准治疗, 但是其不良反应也更加严重[5-6],很多患者因不能耐受并发症而导致治疗失败。 如何保持疗效而又不增加不良反应,成为临床亟需解决的问题。 近年来,有些学者提出以125I放射性粒子植入作为精准适形放疗手段代替传统放疗以降低放疗导致的不良反应,以局部区域动脉灌注化疗代替全身静脉化疗以降低化疗导致的不良反应,但是尚未形成广泛共识,其安全性和有效性尚需进一步验证。 本研究针对ⅢB 期NSCLC 患者,在局部125I 粒子植入治疗的基础上, 分析多靶动脉减量灌注化疗与全身静脉化疗的预后差异,报道如下。
1 材料与方法
1.1 一般资料
选取在2013年7月至2018年12月在我院肿瘤科接受局部125I 放射性植入治疗联合化疗的ⅢB期NSCLC 患者作为研究对象, 并收集患者各项临床特征资料,包括性别、年龄、体力状况、吸烟指数、肿瘤位置、病理类型、分化程度、化疗方式、术前与术后内放疗计划、影像学资料等。 依据患者接受化疗的方式分为两组,多靶动脉灌注化疗(multi-target arterial infusion chemotherapy,MAC)组患者接受MAC联合125I 放射性粒子植入(MAC-125I)治疗,全身静脉化疗(systemic venous chemotherapy,SVC) 组患者接受AVC 联合125I 放射性粒子植入(SVC-125I)治疗。年龄以60 岁作为界限, 分为<60 岁组和≥60 岁组;体力状态评分采用美国东部肿瘤协作组织(eastern cooperative oncology group,ECOG)制定的体力状态(performance status,PS)5 分法; 吸烟指数以100 为界,分为<100 和≥100;病理类型依据组织学或细胞学病理诊断分为腺癌、 鳞癌和其他NSCLC 病理类型;肿瘤体积(gross tumor volume,GTV)和100%靶区所受剂量(D100)来自三维治疗计划系统(TPS)报告。
1.1.1 纳入标准 ①经组织学或细胞学病理证实为NSCLC;②经CT、MRI 或PET- CT 证实临床分期为ⅢB 期(UICC 第7 版);③根 据改 良RECIST 标准(mRECIST 标准)至少具有一个可测量的肿瘤病灶;④无放、化疗禁忌证;⑤临床资料完整。
1.1.2 排除标准 ①病理组织中含有小细胞肺癌患者;②合并第二原发肿瘤患者;③原发灶不明确,不能除外肺转移瘤患者;④因各种原因未能完成治疗,或化疗周期少于2 个周期的患者;⑤接受EGFR酪氨酸激酶抑制剂、单克隆抗体或者抗肿瘤血管生成药物治疗的患者;⑥患者或家属提供的随访资料不正确或不可信者,或不能配合随访患者;⑦临床资料不完整的患者。
1.2 方法
1.2.1125I 放射性粒子植入治疗 将患者的CT 扫描图像传输至TPS 计划系统,并勾画靶区,设定处方剂量90~110 Gy, 设定粒子活度为0.5~0.8 mCi,粒子间距为0.5~1.0 cm,针道间距约为1 cm,设计针道、三维布源,制定出最佳治疗方案。 CT 扫描定位选取穿刺点,依照治疗计划布针、布源,手术完成后按压穿刺点10~20 min。术后即刻行CT 扫描进行剂量验证。 靶病灶包括原发病灶和淋巴结转移病灶。
1.2.2 化疗 ①SVC:根据患者的病理诊断,采用以铂类为基础的一线化疗方案, 以患者的体表面积为依据计算用药剂量,21 d 为1 个周期,至少用药2 个周期。 ②MAC:采用改良Seldinger 方法穿刺股动脉成功后,在DSA 监视下引入4 F 或5 F 猪尾造影导管行胸主动脉造影, 了解肿瘤的供血动脉来源;再引入造影导管,行支气管动脉造影,观察是否有肋间动脉共干以及有无脊髓动脉分支,观察原发病灶及肺门、 纵隔病灶肿瘤染色及血管分布情况,必要时行胸廓内动脉、锁骨下动脉、膈下动脉、甲状颈干动脉及其他潜在供血动脉造影明确有无非支气管动脉参与肿瘤供血,若可见动脉或其分支进入瘤灶内并可观察到对应的肿瘤染色即确定为肿瘤供血动脉。 微导管进一步超选择肿瘤的供血动脉后,予以多靶动脉灌注化疗,用药方案参照SVC 用药方案, 剂量为SVC 用药剂量的50%~100%[7-8],术后穿刺点加压包扎,患者制动12 h,并对症止吐治疗,21~28 d 为1 个周期,至少2 个周期。 ③第一周期化疗用药时间为125I 放射性粒子植入治疗的前后1 个月内。
1.2.3 近期疗效评价 参照改良实体瘤疗效评价标准(mRECIST),以增强CT 扫描图像作为依据进行近期疗效评价:完全缓解(CR)、部分缓解(PR)、病灶稳定(SD)、病灶进展(PD);临床有效率(OR)为CR+PR 的患者占所有患者的比例。
1.2.4 生存期 总生存期(overall survival,OS)以治疗日期为起始点计算,以死亡日期、失访日期或随访截止时间作为终点。 随访方式包括查阅住院及门诊病历资料,电话、短信或邮件的方式。
1.3 统计学方法
采用SPSS 19.0 统计软件对数据进行分析;计数资料采用百分比表示,采用Kaplan-Meier 法进行单因素分析,采用Log-rank 非参数检验方法进行差异检验,采用Cox 回归模型进行多因素分析。 按照α=0.05 标准,以P<0. 05 为差异有统计学意义。
2 结果
2.1 一般资料
经过纳入标准和排除标准筛选, 共有76 例患者纳入研究,其中SVC 组57 例,MAC 组19 例。 收集所有患者的一般临床特征(见表1),两组患者在性别、年龄、吸烟指数、病理类型、ECOG PS 评分等方面差异无统计学意义;来自TPS 系统的125I放射性粒子植入计划显示两组在GTV、D100 方面的差异也不具有统计学意义,提示两组患者具有可比性。

表1 两组患者的一般临床特征 n(%)
2.2 近期疗效评价
以mRECIST 为依据对所有患者进行近期疗效评价(见表2),显示SVC 组CR、PR、SD 和PR 患者分别占1.8%(1/57)、47.4%(27/57)、45.6%(26/57)和5.3%(3/57),OR 为49.1%;MAC 组患者CR、PR、SD和PR 分别占比15.8%(3/19)、52.6%(10/19)、21.1%(4/19)和10.5%(2/19),OR 为68.4%;两组差异显著,具有统计学意义(χ2=8.192,P=0.042),这说明MAC-125I 联合治疗较SVC-125I 联合治疗在缩小NSCLC 瘤灶体积、局部病灶控制方面更有优势。

表2 两组患者近期疗效评价 n(%)
2.3 生存时间
患者的生存分析显示:1、2 和3年生存率分别为76.3%、30.3%和10.5%, 中位总生存时间(mOS)为17.2 个月(95%CI:16.0~18.4)。 其中,SVC 组患者1、2 和3年生存率分别为73.7%、26.3%和8.8%,mOS 为16.3 个月(95%CI:14.6~18.0);MAC 组患者1、2 和3年生存率为84.2%、42.1%和15.8%,mOS为20.0 个月(95%CI:14.9~25.1);两组差异有统计学意义(χ2=3.916,P=0.048)( 见图1)。 这提示MAC-125I 联合治疗较SVC-125I 联合治疗在延长生存时间方面更有优势。
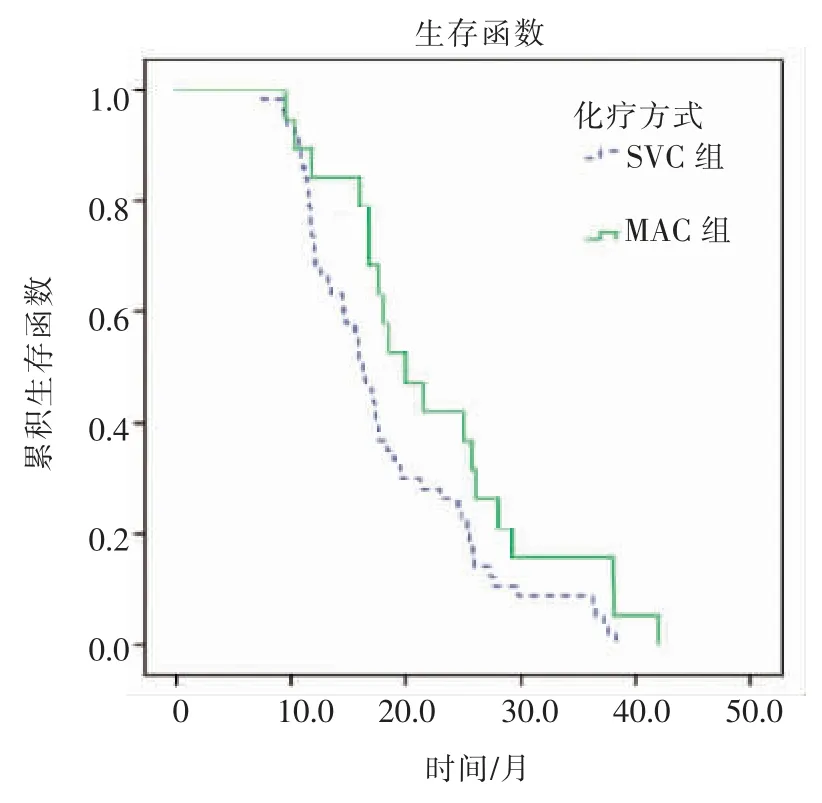
图1 不同化疗方式与生存时间的关系
2.4 亚组分析
本研究对接受MAC-125I 联合治疗的19 例患者进行亚组分析。 以DSA 造影为依据,以供血动脉或其分支进入肿瘤病灶内并出现肿瘤染色为标准, 17例患者可见支气管动脉参与供血,2 例由非支气管动脉供血;10 例仅有支气管动脉供血(包含与支气管动脉共干的肋间动脉), 另9 例患者均为多支动脉参与供血,包括相邻肋间动脉、胸廓内动脉、锁骨下动脉等非支气管动脉参与供血。 单一支气管动脉供血的患者mOS 为25.0 个月(95%CI:13.8~36.2),多支动脉供血患者mOS 为16.8 个月(95%CI:15.6~18.0),两组患者OS 差异有统计学意义(χ2=3.944,P=0.047)(见图2), 这说明有多靶动脉参与供血的NSCLC 患者预后较差。

图2 单一支气管动脉供血与多靶动脉供血患者生存时间的差异
进一步应用Cox 模型单因素分析显示:GTV(HR =3.090,95% CI:1.057 ~8.884,P =0.036)、D100(HR=4.463,95%CI:1.261~15.798,P=0.020)、 供血动脉(HR=5.885,95%CI:1.877~18.449,P=0.002)与OS 显著相关,多因素分析显示:多支动脉供血是影响OS 的独立危险因素(HR=4.776,95%CI:1.265~18.039,P=0.021)。 (见表3)

表3 MAC-125I 联合治疗组患者的Cox 模型单因素及多因素分析
3 讨论
支气管动脉灌注化疗(bronchial arterial infusion chemotherapy,BAI)治疗肺癌已经有40 多年的历史[1-3],BAI 是以影像诊断学为基础,通过对比剂显影以明确肿瘤的供血动脉,通过肿瘤的染色以明确肿瘤的累及范围,然后能有效地集中高浓度抗癌药物,直接、大量注入肿瘤靶血管内,因化疗药物直接灌注进入瘤灶内,避免了肝脏的首过效应,瘤灶内药物浓度显著升高。 有研究表明,局部灌注药物浓度是静脉给药的2~6 倍,而药物浓度每增加1 倍,其杀灭的肿瘤细胞数量将增加10 倍[3]。 另一方面,将药物直接注入肿瘤组织还可减少其与血浆蛋白结合,增加游离药物的浓度,进一步提高化疗药物对肿瘤组织细胞的作用。 随着血液循环,瘤体内的部分药物还可逐渐进入全身血液循环,对体内尚未发现的微小病灶也起到化疗作用,而且经血液循环的抗肿瘤药物二次进入瘤灶内, 发挥二次杀伤作用。 除此之外,化疗药物不仅作用于肿瘤局部,还可进入肺门及纵隔的淋巴结转移灶,消除近处转移并抑制肿瘤的进一步扩散。 外周静脉内药物的浓度较低,将减少对机体的不良作用,保护了患者的生活质量。动物实验也证实[9]:与较静脉化疗相比,动脉灌注化疗时瘤体内Caspase-3 蛋白表达量更高,Bcl-2蛋白表达量更低,Ki-67 的增殖系数也更低,导致细胞凋亡比例增高。 因此,BAI 治疗NSCLC 能有效的减小肿瘤体积,缓解临床症状,并降低抗肿瘤药物的不良反应[10],于临床工作中应用越来越广泛[11-14]。
影响BAI 临床效果的因素是多方面的,能否精确区分肿瘤的供血动脉是影响BAI 疗效的最直接因素,若不能精确肿瘤的供血动脉,BAI 的治疗效果并不理想[13]。 原发性肺癌由以支气管动脉为主的体循环供血[15],这是BAI 的重要理论依据。 但是,一方面支气管动脉解剖复杂,个体差异较大[16],虽然双侧支气管动脉主要起源自胸主动脉,也可变异起源自胸廓内动脉、肋间动脉、甲状颈干及其他动脉。 另一方面,肺癌的供血动脉是复杂多变的,除了支气管动脉,包括肋间动脉、锁骨下动脉、胸廓内动脉、膈下动脉、心包动脉等在内的非支气管动脉均可参与肺癌的供血,尤其是富血供的肿瘤,更可能是由多支动脉共同参与供血,而不仅仅来自支气管动脉[13],因此需要多支动脉共同灌注化疗用药才能保证临床疗效。 本研究中发现47.4%患者肿瘤病灶由包括支气管动脉和非支气管动脉组成的多靶动脉共同参与供血,这与Fu 等[17]报道一致。 而且亚组分析显示多靶动脉血管肿瘤患者具有更短的OS,这可能是因为肿瘤细胞必须通过诱导新生血管来获得必需的营养[18],多靶动脉可能提示肿瘤具有更强的血管生成能力,更强的侵袭能力[17]。 有研究表明,术前的CTA 成像[16,19-20]可有效提供支气管动脉的分支类型、解剖分型及开口部位,能较好地观察NSCLC 的非支气管动脉的供需动脉, 为患者的治疗提供参考。
BAI 的临床疗效还与不良反应有关。 当大剂量化疗药物灌注在单一血管内,不良反应发生率明显升高[13]。 减量至50%~100%系统静脉化疗的用量在动脉化疗治疗肺癌,已见诸报道[7-8]。 蒲德利等[21]研究了125I 放射性粒子植入联合BAI 治疗晚期肺癌,该研究同样关注了非支气管动脉起源的肿瘤供血动脉,动脉灌注药物剂量为静脉化疗剂量的67%~80%,结果显示联合BAI 较联合静脉化疗更具生存优势,这与本研究的结论一致。 但是该研究显示两组mOS 分别为16 个月和12 个月,较差于本研究中的20.0 个月和16.3 个月, 这是因为该研究中75%的患者为Ⅳ期,而本研究中仅纳入ⅢB 期患者。 孙振友等[22]对BAI 联合放疗治疗中晚期NSCLC 患者的疗效进行meta 分析,发现BAI 联合放疗有效率明显高于静脉化疗联合放疗,这也与本研究的结论一致。
Ⅲ期NSCLC 治疗的主要挑战是复发和转移,单一治疗方案在这一方面具有局限性[23]。 单一BAI治疗当瘤灶缩小到一定程度, 肿瘤血管相应减少,对化疗药敏感性降低,疗效也随之下降,甚至一些病例在停止BAI 治疗后会出现复发,病情加重。 众多学者也认为,多种方案联合治疗方能够提高晚期肺癌的生存时间[24]。 唐涛等[25]报道BAI 联合三维适形放疗治疗Ⅲ期NSCLC 优于单纯放疗,胡爱平等[26]也报道小剂量BAI 联合局部放疗高龄NSCLC 也优于单纯放疗。 随着技术的发展,125I 放射性粒子治疗肺癌的现在临床应用越来越多,能够弥补传统外放疗和化疗的不足[27]。 本研究显示125I 放射性粒子联合化疗能够缩小肿瘤体积、延长生存时间,具有良好的临床效果,与其他学者同类研究结论相一致[28-30]。
本研究的不足之处,一是本研究所纳入的研究对象来自单个研究中心,样本量较少,很容易产生选择偏倚;二是本研究未对化疗方案、化疗周期进行更严格筛选,也很容易产生信息偏倚。 总之,我们还需要前瞻性、大样本的随机对照研究来进一步明确125I 放射性粒子植入联合化疗治疗ⅢB 期NSCLC的临床疗效及影响因素。
125I 放射性粒子植入治疗联合多靶动脉减量灌注化疗治疗ⅢB 期NSCLC 的OR、OS 均优于联合静脉化疗,可作为治疗手段之一进行临床推广。

