来源于Mangifera indica L.C-糖基转移酶MiCGTb的大肠杆菌原核表达、纯化、结晶化以及晶体学研究
樊帅,吕广新,刘凡,金媛媛,杨兆勇
作者单位:100050 北京,中国医学科学院北京协和医学院医药生物技术研究所微生物代谢工程研究室
糖苷是一类具有生物活性的天然产物[1]。与常见的O-糖苷相比,C-糖苷是自然界中极其少见的一类。不同于O-糖苷键在体内易被水解,C-糖苷键稳定性高,一些天然药物C-糖基化修饰后提高了生物利用度和改善了药理活性[2]。这些C-糖苷广泛分布于植物中,具有抗炎[3]、抗肿瘤[4]、降血糖[5-6]和保健[7]等功效。在C-糖苷的生物合成途径中,C-糖基转移酶可催化C-糖苷类化合物的 C-C键的形成,进而合成具有重要生物学功能的各类次级代谢产物。另外通过酶催化制备C-糖苷类化合物不仅能够克服化学合成环境污染、产率低和苛刻反应条件等不利因素,还具有催化立体选择性和区域选择性等特点。
现阶段,C-糖基转移酶主要来源于微生物和植物,其中微生物来源的 C-糖基转移酶主要为来源于Escherichia coliCFT073 的 IroB[8]、来源于Streptomyces griseoflavus的 gilGT[9]和来源于Streptomyces fradiae的 UrdGT2[10]。已知植物来源的C-糖基转移酶存在于Oryza sativa[11]、Zea mays[12]、Fagopyrum esculentum[13]、Glycine max[14]、Gentianatrifloral[15]。糖基转移酶的三维结构分为GT-A 和 GT-B 两种类型,目前大部分糖基转移酶的结构生物学研究主要集中在O-糖基转移酶,对于C-糖基转移酶,尤其植物来源的C-糖基转移酶报道较少,目前仅有来源于Glycyrrhiza glabra的GgCGT[16]和Fagopyrum esculentum的 UGT708C1[17]等少数几个C-糖基转移酶有结构报道。
来源于Mangifera indicaL.的C-glycosyltransferase MiCGTb(EC:2.4.1.-)[18]能够位置选择性地将酰基间苯三酚 2-O-糖苷转化为3-C-糖苷[18-19],还能催化 di-C-糖基化反应[20]。其催化机制的解析需要 MiCGTb 的空间结构作为基础,因此,本研究主要对 MiCGTb 的空间结构进行研究,构建 MiCGTb 截短蛋白 MiCGTb1(Asn8-Lys465)原核表达载体,利用大肠杆菌表达系统进行 MiCGTb1 蛋白的异源表达,经 Co2+亲和层析、离子交换层析和分子排阻色谱纯化后,对MiCGTb1 进行晶体培养获得晶体,应用生物大分子 X 射线衍射技术获得 MiCGTb1 晶体结构数据并进行解析,为今后阐述C-糖基转移酶的催化机制奠定了基础。
1 材料与方法
1.1 材料
MiCGTb 表达菌株 BL21-CodonPlus(DE3)-RIPL购自美国 Agilent Technologies 公司;表达质粒pET-28a(+) 购自美国 Novagen 公司;Co2+-NTA 填料购自 Takara 中国公司;30 K 超滤浓缩管购自美国 Millipore 公司;HiTrapDEAE HP 和 Superose12 10/300GL 购自美国 Cytiva 公司;结晶初筛试剂盒Crystal ScreenTM-HR2-110 Scoring Sheet 和 Crystal ScreenTM-HR2-112 Scoring Sheet 购自美国 Hampton Research 公司;Wizard CRYO 1 Tubes 和 Wizard CRYO 2 Tube 购自美国 Rigaku Reagents 公司;其余试剂均为国产分析纯。
1.2 方法
1.2.1 表达质粒构建 MiCGTb 表达质粒由中国医学科学院药物研究所戴均贵课题组馈赠,截短MiCGTb ( MiCGTb1 , Asn8-Lys465 ) 由引物MiCGTb1-F : CGGGATCCAACTCCTATCCACAT(下划线部分为BamH I 酶切位点),MiCGTb1-R:CCCAAGCTTCTTCTTCCAATTCTCTATG(下划线部分为Hind III 酶切位点),经 PCR 扩增和BamH I/HindIII 双酶切处理后,连入已被BamH I/HindIII 双酶切 pET-28a(+) 构建表达质粒pET-28MiCGTb1,利用基因测序确认 MiCGTb1 序列准确无误。
1.2.2 MiCGTb/MiCGTb1 表达与纯化 将pET-28MiCGTb/MiCGTb1 质粒转化至 BL21-CodonPlus(DE3)-RIPL 表达菌株并接种于 3 L 含50 μg/ml 卡那霉素,30 μg/ml 四环素和氯霉素的LB 培养基中。37 ℃、200 r/min 培养至OD6000.8~1.0,加入 1 mol/L IPTG 至终浓度为 0.5 mmol/L,在 18 ℃、200 r/min 继续振荡培养 12 h。用缓冲液lysis buffer(20 mmol/L 磷酸缓冲液,150 mmol/L NaCl,10 mmol/L 咪唑,pH 7.4)重悬菌体,利用高压均质机破碎,18 000 r/min、4 ℃ 离心 30 min,收集上清后匀速缓慢地加入已平衡好的 Co2+-NTA柱,再用 washing buffer(20 mmol/L 磷酸缓冲液,150 mmol/L NaCl,20 mmol/L 咪唑,pH 7.4)5 倍柱体积冲洗,最后用 elution buffer(20 mmol/L 磷酸缓冲液,500 mmol/L NaCl,500 mmol/L 咪唑,pH 7.4)洗脱目的蛋白,目的蛋白除盐后,上样于弱阴离子交换柱 HiTrapDEAE HP 进行离子交换层析纯化,利用洗脱液(20 mmol/L Tris,pH 8.0,2 mol/L NaCl)进行梯度洗脱,收集出峰样品经SDS-PAGE 检测后将目的蛋白用 30 K 超滤浓缩管进行脱盐浓缩后备用。
1.2.3 MiCGTb/MiCGTb1 结晶初筛与优化 将MiCGTb/MiCGTb1 浓度调至 8 mg/ml,使用商业化筛选矩阵 Crystal ScreenTM-HR2-110 Scoring Sheet、Crystal ScreenTM-HR2-112 Scoring Sheet、Wizard CRYO 1 Tubes 和 Wizard CRYO 2 Tube,采用悬滴蒸汽扩散法在 23℃ 培养晶体,在 24 孔板中将 MiCGTb1 与池液 1:1 混合悬滴。对有晶体出现的池液 pH、沉淀剂浓度和蛋白浓度、结晶温度进行优化,最终获得可用于 X-射线衍射分析的蛋白质晶体。
1.2.4 X-射线数据收集 由于蛋白沉淀剂为 40%MPD,可将优化好的晶体直接用 loop 环捞取后直接冻存于液氮中,经冻存的晶体在上海同步辐射光源 BL18U1 线站经检测器 Pilatus3 6M 收集衍射数据,衍射数据通过 HKL3000 软件包进行数据还原。
2 结果
2.1 MiCGTb 异源表达
MiCGTb 来源于Mangifera indicaL.,所以异源表达的菌株采用含有稀有密码子可提高真核基因在原核表达水平的宿主 BL21-CodonPlus(DE3)-RIPL,采用 Co2+亲和层析纯化后发现 MiCGTb在室温下不稳定,容易降解(图 1),这不利于后续结晶实验。通过 Protein DisOrder prediction System( http://prdos.hgc.jp/cgi-bin/top.cgi ) 分析MiCGTb 氨基酸序列发现,MiCGTb 序列两端的混乱度较高(图 2),在三维结构上柔性较高,有可能造成蛋白质的不稳定,且不利于结晶。因此,通过将其氨基端的 7 个氨基酸和羧基端的 5 个氨基酸去掉,重新克隆构建 MiCGTb 的截短序列MiCGTb1 来进行后期的纯化和结晶。

图1 Co2+ 亲和层析纯化 MiCGTb 的 SDS-PAGE 分析Figure 1 SDS-PAGE analysis of MiCGTb purified by Co2+affinity chromatography

图2 MiCGTb 蛋白混乱度预测结果Figure 2 The prediction result of protein disorder
2.2 MiCGTb1 表达载体构建及表达纯化
以 MiCGTb 表达质粒为模板,MiCGTb1-F 和MiCGTb1-R 为引物扩增得到micgtb1基因。经琼脂糖凝胶电泳检测,micgtb1 基因序列的理论长度为 1374 bp,克隆得到目的片段大小约为 1400 bp(图 3),克隆结果与预期值相符。BamH I 和Hind III 双酶切后,连入同样BamH I 和Hind III双酶切的 pET-28a(+) 质粒构建 MiCGTb1 表达质粒 pET-28MiCGTb1,通过测序验证序列的准确性。
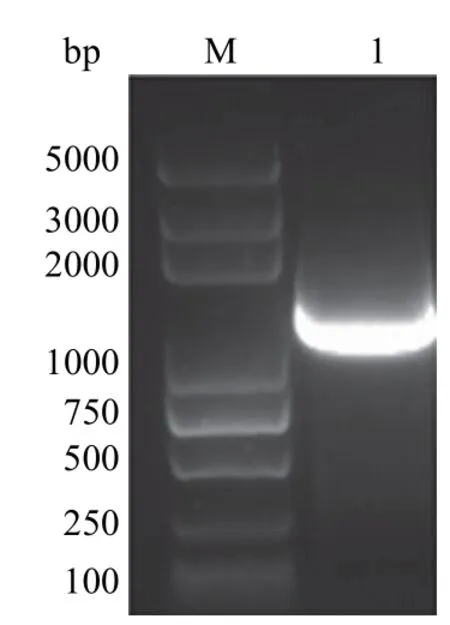
图3 micgtb1 基因 PCR 扩增结果Figure 3 PCR amplification results of micgtb1 gene
通过重组质粒转化,成功表达截短的 MiCGTb1重组蛋白。经低温 IPTG 诱导发酵、破碎和 Co2+亲和层析,成功获得可溶性 MiCGTb1。目的蛋白上样至 HiTrapDEAE HP 弱阴离子交换柱,经洗脱液(20 mmol/L Tris,2 mol/L NaCl,pH 8.0)梯度洗脱,收集出峰样品进行 SDS-PAGE 分析,结果如图 4所示,收集纯度较好的峰尖管(2 和 3 管),浓缩后备用。

图4 弱离子交换纯化 MiCGTb1 的 SDS-PAGE 分析Figure 4 SDS-PAGE analysis of MiCGTb1 purified by DEAE ion-exchange chromatography
2.3 MiCGTb1 结晶初筛
将 MiCGTb 浓度调至 7 mg/ml,使用蒸气扩散法,将 MiCGTb 与池液 1:1 混合,蛋白溶液和池液体积均为 1 μl,池液分别使用 Crystal ScreenTM-HR2-110 Scoring Sheet、Crystal ScreenTMHR2-112 Scoring Sheet、Wizard CRYO 1 Tubes 和Wizard CRYO 2 Tube 等试剂盒内的每种溶液进行结晶条件的初筛,初筛结果如图 5所示。对于条件 1(0.2 mol/L ZnAc2,0.1 mol/L 二甲胂酸钠 pH 6.5,18% w/v PEG 8000)长出的晶体呈堆叠的片状;条件 2(0.2 mol/L MgCl2,0.1 mol/L Tris pH 8.5,3.4 mol/L 1,6-己二醇)长出的晶体呈麦芒状;条件 3(0.2 mol/L MgCl2,0.1 mol/L 咪唑 pH 8.0,40%MPD)长出的晶体呈片状。

图5 MiCGTb1 结晶条件初筛结果(A:池液条件 0.2 mol/L ZnAc2,0.1 mol/L 二甲胂酸钠 pH 6.5,18% w/v PEG 8000;B:池液条件 0.2 mol/L MgCl2,0.1 mol/L Tris pH 8.5,3.4 mol/L 1,6-己二醇;C:池液条件 0.2 mol/L MgCl2,0.1 mol/L 咪唑pH 8.0,40% MPD)Figure 5 Crystallization-condition screening of MiCGTb1 (A:Reservoir condition 0.2 mol/L ZnAc2,0.1 mol/L sodium cacodylate pH 6.5,18% PEG 8000;B:Reservoircondition 0.2 mol/L MgCl2,0.1 mol/L Tris pH 8.5,3.4 mol/L 1,6-hexanediol;C:Reservoir condition 0.2 mol/L MgCl2,0.1 mol/L imidazole pH 8.0,40% MPD)
对初筛条件中的 pH、蛋白浓度、沉淀剂浓度、结晶温度和添加剂进行优化,最终在蛋白浓度为8 mg/ml,池液条件为 0.2 mol/L MgCl2,0.1 mol/L Tris pH 8.0,40% MPD,结晶温度为 23 ℃,添加剂为乙二醇(0.75%v/v),结晶条件最优,晶体如图 6所示。

图6 优化后 MiCGTb1 晶体Figure 6 The optimized MiCGTb1 crystals
将优化后的晶体液氮冻存,用 X 射线衍射仪筛选衍射分辨率高的晶体,得到一批衍射分辨率较高的晶体送至上海光源(SSRF)BL18U1 线站采集数据,衍射具体参数为:波长 0.97915 Å,扫描步长为 1°,曝光时间 0.5 s,检测器距离 350 mm,收集 180 张衍射图(图 7),并使用 HKL3000进行数据处理,MiCGTb1 晶体结构空间群为P21,晶胞参数为:a=285.158 Å,b=135.918 Å,c=286.924 Å,α=90.000°,β=117.216°,γ=90.000°。衍射数据的统计结果见表 1。衍射数据的分辨率为 3.30 Å。

图7 自我回转函数计算结果Figure 7 The result of self rotation function
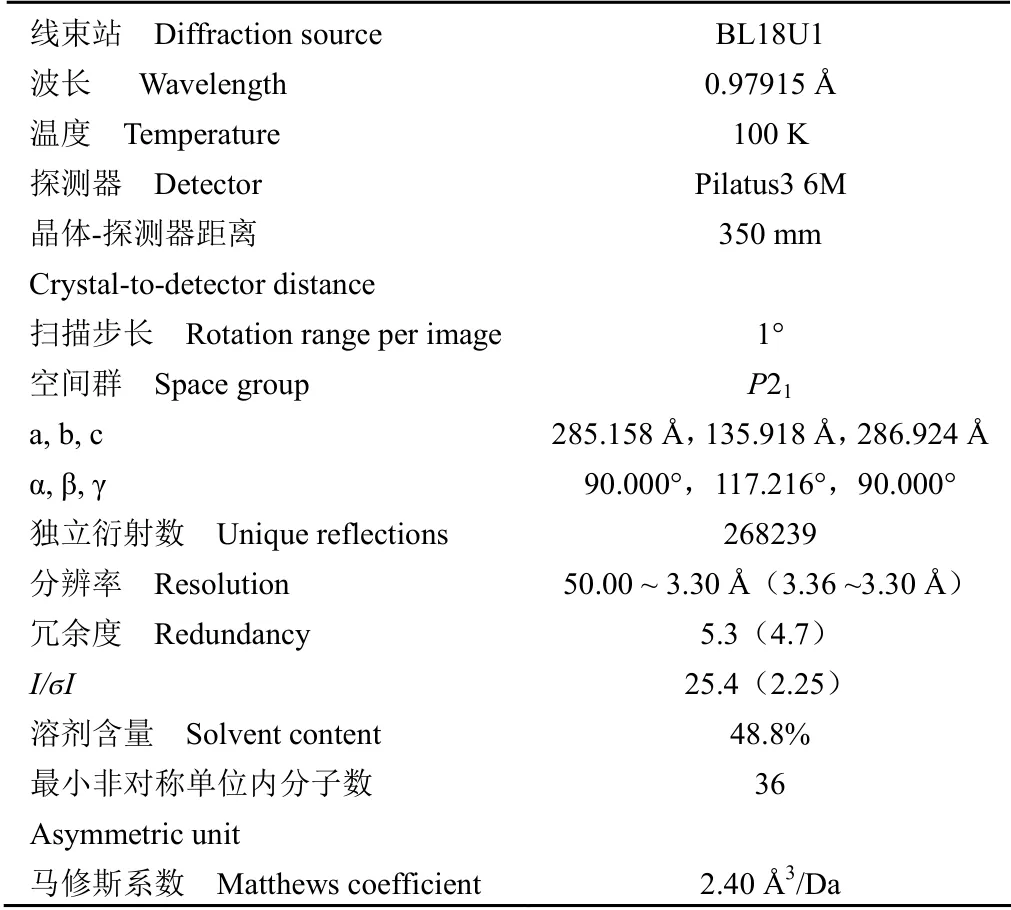
表1 MiCGTb1 晶体数据Table 1 Crystal data of MiCGTb1
3 讨论
本文利用大肠杆菌表达系统异源高效表达来自Mangifera indicaL.的截短蛋白 MiCGTb1,采用 Co2+亲和层析、离子交换层析和分子排阻色谱进行纯化得到可用于结晶的目的蛋白,通过结晶条件的初筛和结晶条件的优化得到最优结晶条件,经上海同步辐射光源 BL18U1 线站收集得到分辨率为 3.30 Å 的 X 射线衍射数据,属于单斜晶系,空间群为P21。从自我回转函数计算的结果来看,κ=60° 有明显的高峰存在,表明晶体的最小非对称单位里存在非晶轴平行的 6 重旋转轴或螺旋轴,因此最小非对称单位里含有的分子数为 36 或42(6 的整数倍)是合理的,如果蛋白质形成 6 聚体,其中没有形成 3 重或 6 重旋转对称的话,最有可能的是最小非对称单位里的分子数是 36 个,即 6 个 6 聚体。对于数据解析来说分辨率仍需提高,后期实验可通过添加剂筛选或添加底物等方式来提高结晶质量,争取将分辨率提高至 3 Å 以内,为以后解析C-糖基转移酶的空间结构乃至阐述催化机制奠定坚实的基础。

