康复新液治疗溃疡性结肠炎小鼠的效果
金旭敏,孙洁,薛鹏鹏,董伟杰,陶信洁,徐荷林
温州医科大学,浙江 温州 325035,1.实验动物中心;2.药学院;3.第一临床医学院
溃疡性结肠炎(ulcerative colitis,UC)是一种以黏膜炎症和溃疡形成为主要病理特征的慢性疾病[1-2]。UC发病机制目前不完全清楚,普遍认为与遗传、环境等综合因素导致的结肠黏膜屏障损伤有关[3-4]。目前临床上UC治疗仍以缓解炎症反应的口服小分子药物如抗炎免疫抑制和抗生素等为主要手段[5-6],但不能防止炎症的反复发作,而且多次治疗容易使UC演进为更为顽固的炎症病症[7]。研究发现,康复新液(KFX)具有改善胃肠黏膜创面微循环和抑菌抗炎抗水肿的作用[8],可以用于放射性直肠的治疗[9],但是KFX对结肠黏膜的屏障修复作用仍然缺乏一定的支持。本研究的KFX采用口服给药,以地塞米松液体灌肠剂为阳性药物[10],通过对比评价KFX对UC的治疗效果。
1 材料和方法
1.1 材料和仪器 葡聚糖硫酸钠(DSS)购于美国Sigma公司;KFX(湖南科伦制药有限公司)和地塞米松(DXM,国药集团容生制药有限公司);髓过氧化物酶(myeloperoxidase,MPO)检测试剂盒(武汉爱博泰克生物科技有限公司)。IL-6 兔多克隆抗体(DF6087,1:200,Affinity,江苏亲科生物研究中心有限公司);IL-1β兔多克隆抗体[AB9722,1:200,Abcam®,艾博抗(上海)贸易有限公司];TNF-α小鼠单克隆抗体[52B83,1:100,Santa Cruz®,Santa Cruz Biotechnology(上海)Co.,Ltd.]。SpectraMax M3酶标仪(美国Molecular Devices公司),Nikon正置荧光显微镜(日本Nikon公司),内窥镜影像系统(SD-618型,沈阳沈大内窥镜有限公司)。
1.2 方法
1.2.1 分组:按照文献[11-12]方法,4% DSS加入小鼠饮用水,连续喂养6 d,建立UC模型。模型建立后,小鼠出现毛发紊乱,大便疏松甚至便血,表现出明显的UC症状。15只造模成功小鼠分为3组,每组5只,分别为口服0.9%氯化钠溶液组(Saline组)、地塞米松溶液灌肠组(DXM组)和KFX口服组(KFX组),在第7天开始给药治疗。0.9%氯化钠溶液或KFX,每次1 mL,每日3次灌胃给药,连续治疗7 d;DXM溶液以0.05 mg/kg剂量,每次0.1 mL,每日3次,用注射器经直肠3~4 cm处灌注给药,给药后倒置小鼠15 s,连续给药7 d。治疗期间每日观察小鼠的体质量以及粪便情况,对其疾病活动指数(disease activity index,DAI)进行评分。治疗终点,处死各组小鼠,分离结肠组织,观察结肠外观并测量其长度。体质量变化率(%)=第n天体质量/初始体质量。
1.2.2 结肠长度及MPO活性检测:通过脾脏质量间接评价治疗后UC小鼠整体炎症的缓解情况[13]。治疗终点(第13天)处死各组小鼠,收集小鼠脾脏称重比较。收集整个结直肠观察结直肠形态,并测量结肠长度。取距离肛门6 cm以上的结肠组织100 mg,组织匀浆器匀浆,10 000×g离心10 min,取上清液,利用试剂盒测定组织MPO活性。
1.2.3 结肠镜观察:麻醉小鼠后将灌胃针接在注射器上,对小鼠灌注1 mL 0.9%氯化钠溶液进行肠道清洗。用少量甘油润滑内窥镜镜头,将镜头插入小鼠肛门,在电脑屏幕上进行观察。在造模第6天、第10天以及第13天对小鼠的结肠表面形态进行内窥镜观察,对其表面形态进行评分比较。溃疡评分:0分为无明显溃疡;1分为轻度充血、水肿、表面光滑、溃疡散在分布数量1~2处;2分为黏膜粗糙呈颗粒状、有糜烂水肿出血、溃疡散在分布数量大于2处;3分为高度充血水肿、黏膜表面有坏死及部分区域溃疡;4分为重度出血糜烂,明显大面积溃疡。炎症评分:0分为无明显炎症;1分为黏膜细颗粒状改变;2分为黏膜表面发红、糜烂;3分为黏膜表面明显溃疡、出血;4分为黏膜表面大范围溃疡、出血。
1.2.4 HE、PAS及免疫组织化学和免疫荧光染色方法:取距离肛门6 cm以上的结肠组织,10%多聚甲醛固定,乙醇梯度脱水,石蜡包埋,组织切片机切成厚度为5 μm的薄片,用HE染色、AB-PAS染色和免疫荧光染色,在光学显微镜下观察组织形态。
1.3 统计学处理方法 采用GraphPad Prism 8.0统计软件进行分析。计量资料用±s表示,多组间比较用单因素方差分析,两两比较用LSD-t法。P<0.05为差异有统计学意义。
2 结果
2.1 3组治疗效果比较 3组小鼠造模6 d内的体质量明显减轻,并且Saline组在实验结束时没有恢复。第7天开始DXM组和KFX组小鼠出现不同程度的体质量上升,表明病变肠道功能逐渐恢复。KFX组小鼠的体质量较DXM组在第12天恢复得更接近初始体质量,表明该组病变肠恢复最好。Saline组小鼠DAI评分明显升高,而DXM组和KFX组DAI评分随着第7天开始治疗逐渐下降,且KFX组的评分低于DXM组,差异具有统计学意义(P<0.05),见图1A、图1B。整个治疗过程中,Saline组中的小鼠出现软粪便伴有轻微的腹泻痕迹,并且严重程度逐渐增强,在肛门部位显示水样粪便和大出血。DXM组和KFX组小鼠第7天腹泻和粪便出血明显缓解,第8天2组小鼠粪便转为正常,并未见出血症状。Saline组小鼠结肠出现明显肿胀和萎缩;DXM组和KFX组小鼠结肠组织肿胀有所缓解,DXM组仍有数只出现不同程度的结肠萎缩;与DXM组比,KFX组结肠肿胀与萎缩有所减少;与Saline组比,DXM组和KFX组小鼠结肠长度明显恢复,差异有统计学意义(P<0.05),见图1C、图1D。Saline组小鼠出现明显的脾脏肿大,DXM组和KFX组小鼠脾肿大有明显缓解,KFX组与Saline组比差异有统计学意义(P<0.05),见图1E。表明KFX组的治疗能有效缓解UC小鼠免疫系统的激活。
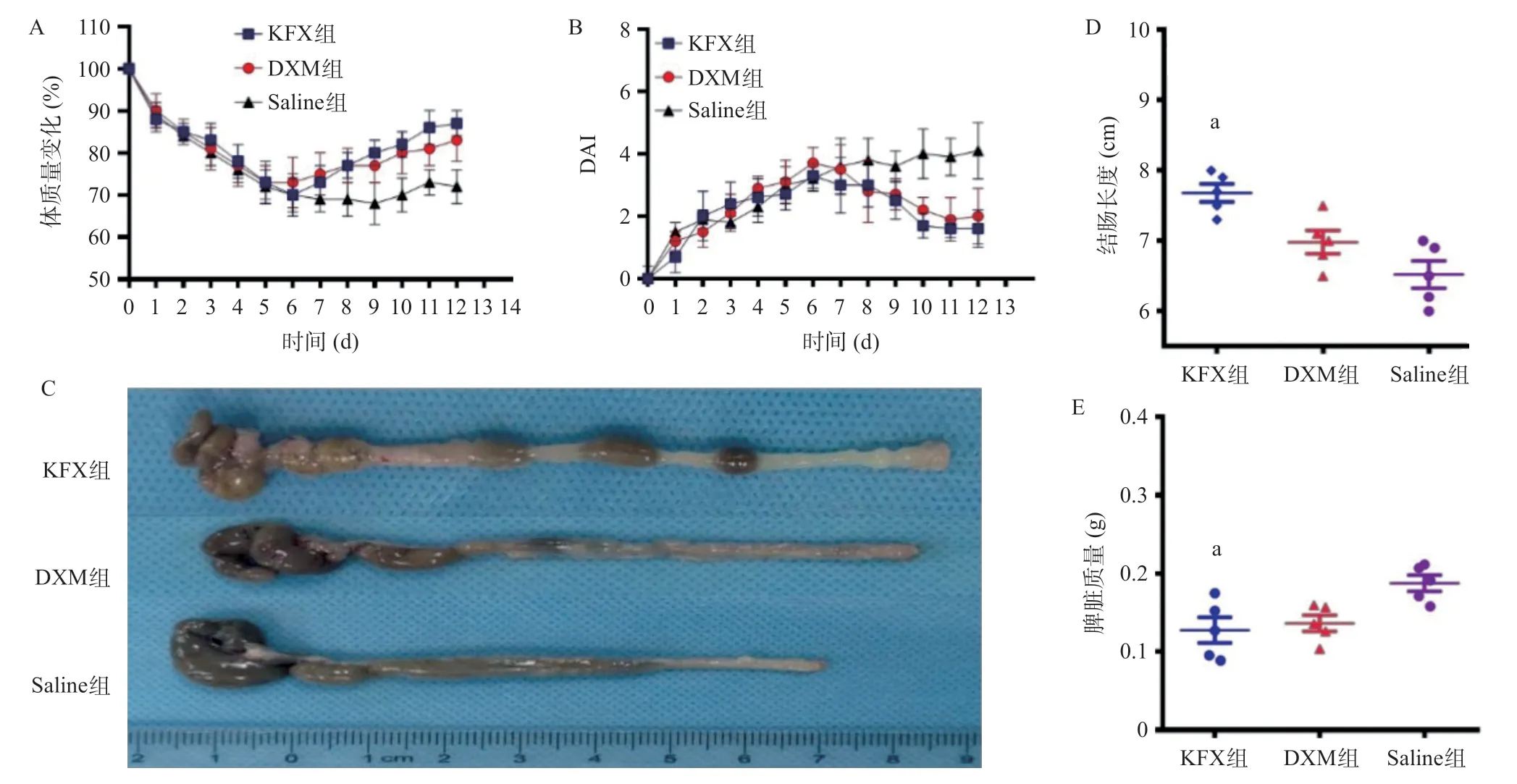
图1 3组对DSS诱导UC小鼠的治疗效果比较
2.2 3组小鼠炎症反应比较 Saline组小鼠结肠出现较高的MPO水平,DXM组和KFX组小鼠结肠组织MPO水平明显降低,差异有统计学意义(P<0.05),见图2A。这些结果表明,KFX治疗可有效地缓解免疫细胞的激活,抑制中性粒细胞结肠组织的浸润,缓解溃疡性结肠的炎症。
2.3 3组小鼠结肠形态比较 造模第5天,各组小鼠结肠均出现严重的溃疡性糜烂,出现大面积的渗血和肿胀的黏膜,与观察到的结肠炎严重程度、血便程度、结肠外观相一致。第9天,DXM组和KFX组小鼠结肠均未见溃疡性糜烂,但仍存在黏膜肿胀;Saline组小鼠的结肠仍可见渗血和大面积溃疡。第13天,DXM组和KFX组小鼠结肠黏膜肿胀均有所缓解,展现出明显的宏观形态修复,见图2B。溃疡评分表明,与Saline组比,DXM组和KFX组小鼠的黏膜恢复明显更好,差异有统计学意义(P<0.05)。经DXM和KFX治疗之后,肠镜炎症评分下降,与Saline组比差异有统计学意义(P<0.05),表明DXM和KFX对溃疡性结肠炎小鼠有明显的治疗效果,见图2C、图2D。

图2 3组小鼠结肠炎症及形态比较
2.4 3组小鼠组织形态比较 第14 天Saline组小鼠结肠出现隐窝脓肿或消失,黏膜下层和肌层水肿,炎性细胞浸润。DXM组和KFX组治疗后,隐窝形态有效修复,黏膜下层和肌层水肿有一定缓解,炎症细胞浸润有所减少。与DXM组比,KFX组展现出完整的黏膜上皮层、隐窝以及肌层黏膜和黏膜下层,相互间分界分明,各层组织未见明显的肿胀与炎症细胞浸润,见图3A。
与Saline组比,DXM组和KFX组的小鼠结肠组组织学评分均得到改善,差异有统计学意义(P<0.01),见图3B。Saline组出现明显的杯状细胞缺失和黏液分泌减少,而DXM组和KFX组均呈现出良好的杯状细胞形态,表明有效改善了UC导致的杯状细胞损伤;且与DXM组比,KFX组出现更完好的杯状细胞的形态,见图3C。与Saline组比,DXM组和KFX组AB-PAS阳性区域面积明显升高,差异有统计学意义(P<0.01),见图3D。表明DXM和KFX有效改善了杯状细胞的缺失,增加了黏液的分泌。

图3 3组修复DSS诱导UC的杯状细胞
2.5 3组小鼠结肠组织的炎症因子水平 在治疗第14天,Saline组IL-1β、IL-6和TNF-α表达均明显上升,DXM和KFX组治疗后荧光表达均下降,差异有统计学意义(P<0.05);且KFX组IL-1β、IL-6和TNF-α荧光强度均低于DXM组,差异有统计学意义(均P<0.05),见图4。荧光强度统计结果如图4B所示,结果说明KFX和DXM均能够有效地发挥抗炎作用,从而产生治疗UC的效用,且KFX具有更好的抗炎效果。
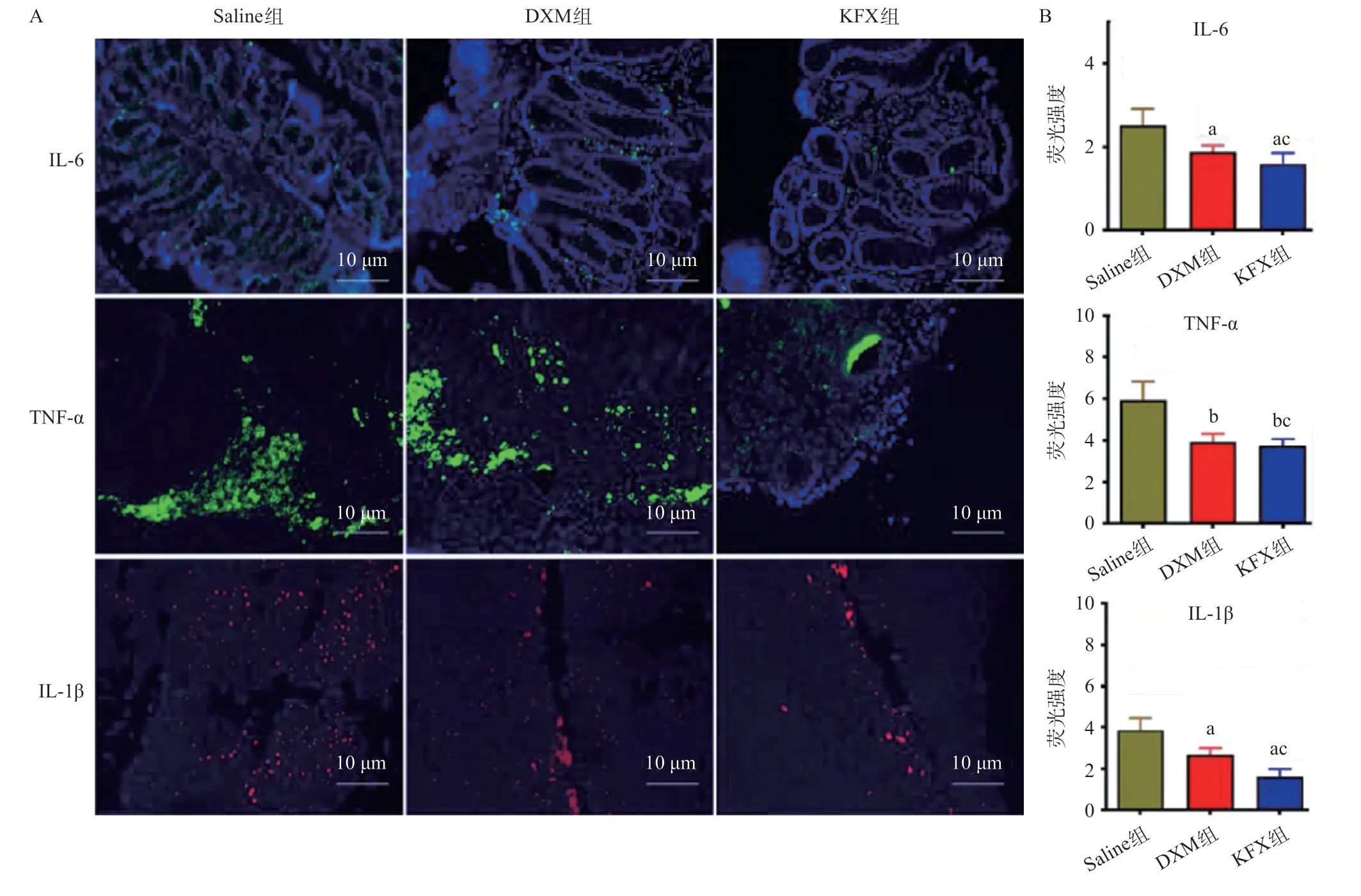
图4 3组小鼠结肠组织的炎症因子水平
2.6 KFX修复DSS诱导的UC小鼠的黏膜屏障 如图5 所示,在第14天Saline组结肠上皮层仅有微弱、分散的Claudin-5、ZO-1和Occludin-1相关荧光,表明细胞间紧密连接被严重破坏。DXM和KFX组治疗后,结肠上皮层出现明显的荧光,与Saline组比,KFX组中Claudin-5、ZO-1和Occludin-1的表达明显升高,差异有统计学意义(均P<0.01);KFX组中Claudin-5、ZO-1和Occludin-1荧光强度明显高于DXM组,差异有统计学意义(均P<0.05),表明KFX组黏膜屏障修复得更为完整。

图5 3组修复DSS诱导UC的黏膜屏障
3 讨论
UC以黏膜炎症和溃疡为主要病理特征,临床呈现反复发作不愈的特点,癌变风险高,预后差,已被WHO列为现代难治病之一[14]。持续或反复出现的结肠炎症是导致结肠纤维化狭窄、结肠癌的重要原因[15]。目前临床UC治疗仍以小分子抗炎药物和抗生素等缓解炎症反应为主要手段,但不能防止炎症的反复发作,缺乏有效的根治药物。加之严重的药物不良反应如肾损伤、免疫抑制引发的感染等,目前小分子药物对UC的治疗临床获益十分有限[16]。
KFX是以美洲大蠊干燥虫体分离提取物精制而成的一种生物制剂[17]。现代药理研究证实,KFX具有促进组织修复、抗炎、抑菌的作用,因此有望用于UC的治疗。研究报道KFX治疗消化性溃疡有效率可达到93%[9]。KFX具有促进表皮生长因子表达以修复黏膜的作用,且可通过抑制AP-1、NF-κB、IL-4等炎性递质的表达来达到全身及局部的抗炎作用[18]。
紧密连接蛋白广泛分布于上皮、内皮、间皮细胞膜上,在细胞间组成分子屏障,调节分子和离子在细胞间隙的弥散。UC小鼠肠道黏膜上皮中,紧密连接蛋白结构和功能发生改变。Claudin-5、ZO-1和Occludin-1 蛋白在肠黏膜屏障功能维持中起重要作用。本研究进一步对治疗后小鼠结肠组织进行Claudin-5、ZO-1和Occludin-1免疫荧光染色,以评价结肠黏膜修复情况,结果表明KFX对黏膜屏障有很好的修复作用。
本课题的KFX采用口服给药方式,以DXM溶液灌肠作为对照组,对比评价KFX的黏膜屏障修复作用。与Saline组相比,DXM或KFX展现出较明显的炎症缓解,黏膜屏障结肠组织形态修复。而且KFX相比DXM展现出更为有效的治疗效果,可能原因如下:①KFX具有促进组织修复、抗炎、抑菌的作用;②KFX具有促进表皮生长因子表达的作用,较DXM不良反应更少。

