Eg5通过c-Myc/SP1/CDK1通路调节去势抵抗性前列腺癌细胞的恶性增殖
胡俊彪,张春霆,夏建洪,姚勇,陆俊仪
金华市人民医院,浙江 金华 321000,1.泌尿外科;2.药剂科
前列腺癌是男性最常见的生殖系统肿瘤,其发病率仅低于膀胱癌和肾癌,居男性泌尿系统恶性肿瘤的第三位[1-2]。前列腺癌异质性极高,分为惰性前列腺癌和侵袭性前列腺癌[3-4]。其中,惰性前列腺癌细胞长期局限于前列腺内,进展缓慢,可采用保守治疗[3]。而侵袭性前列腺癌由于容易发生转移,进展迅速,只能采用睾丸切除术配合雄激素剥夺治疗(androgen deprivation treatment,ADT)[4-5]。然而,侵袭性前列腺癌在接受了手术去势或者ADT之后,往往容易发展为去势抵抗性前列腺癌(castration resistant prostate cancer,CRPC)[6]。去势抵抗性的产生,导致CRPC成为病死率极高的难治前列腺癌[6]。了解前列腺癌发展为CRPC的机制,寻找潜在治疗靶点,是突破CRPC治疗瓶颈的有效手段。
纺锤体有丝分裂驱动蛋白(Kinesin-5,Eg5),在细胞有丝分裂早期对双极纺锤体的形成和染色体单体的分离起着至关重要的作用,与包括胰腺癌、肝癌及前列腺癌在内的多种恶性肿瘤的发生发展密切相关[7-9]。研究表明,Eg5是具有ATP酶活性的运动特性马达分子,参与调节细胞周期、细胞凋亡、肿瘤侵袭转移及DNA损伤应答等多种生物学功 能[7,10]。Eg5在恶性肿瘤细胞内的过度表达会导致转录因子c-Myc的过度表达[11]。而c-Myc的过度表达被证明可导致前列腺癌细胞产生去势抵抗性[12]。作为c-Myc的下游靶点,特异性蛋白1(specificity protein 1,SP1)的过表达被证明和肿瘤进展及预后不良密切相关[13]。作为重要的转录因子,SP1被证明与ATP的转录调控密切相关,参与调节DNA双链损伤修复、细胞周期及肿瘤转移[14-15]。Eg5及其下游靶点c-Myc及SP1的生物学功能表明,Eg5可能是治疗CRPC的有效靶点。然而,Eg5调节前列腺癌细胞产生去势抵抗性的机制却鲜有研究。本研究拟通过沉默Eg5的表达或者用小分子抑制剂SB-743921抑制Eg5的活性来探究Eg5对CRPC细胞株DU145生长、凋亡、周期及迁移的调节作用及机制。
1 材料和方法
1.1 材料
1.1.1 细胞:人CRPC细胞株DU145、PC-3及LNCaP均购自上海生命科学院细胞资源中心。人前列腺癌细胞株DU145用含10%胎牛血清、100 mg/L链霉素、100 kU/L青霉素的MEM培养基培养。人前列腺癌细胞株PC-3和LNCaP用含10%胎牛血清、100 mg/L链霉素、100 kU/L青霉素的RPMI 1640培养基培养。
1.1.2 主要试剂和仪器:Eg5单克隆抗体、c-Myc单克隆抗体、SP1单克隆抗体、CDK1单克隆抗体、E-cadherin单克隆抗体、Vimentin单克隆抗体、β-actin单克隆抗体、鼠二抗及兔二抗均购自美国Cell Signaling Technology公司。Cyclin B1 单克隆抗体、Cyclin A1单克隆抗体、CDC25B单克隆抗体及N-cadherin单克隆抗体均购自美国Abcam公司。MTT试剂盒、Annexin V-FITC和典化丙啶(PI)凋亡检测试剂盒均购自上海碧云天生物技术公司。MEM培养基、胰酶及结晶紫染色液均购自南京凯基生物技术股份有限公司。RIPA细胞裂解缓冲液购自南京三翊生物科技有限公司。Eg5小分子抑制剂SB-743921购自美国MedChemExpress公司。RNAiso Plus购自日本Takara-Bio公司。反转录试剂盒及q-PCR试剂盒均购自南京诺唯赞生物科技有限公司。慢病毒NC shRNA载体及Eg5 shRNA载体购自上海吉凯基因医学科技股份有限公司。Cytation 5酶标仪购自美国Biotek公司;MACSQuant流式细胞仪购自德国美天旎生物技术公司;EVOS XL Core倒置荧光显微镜购自美国Thermo Fisher公司;Gel DocTM凝胶成像系统购自美国Bio-Rad公司;CO2细胞培养箱购自美国Thermo Fisher公司;蛋白电泳仪系统购自美国Bio-Rad公司。
1.2 方法
1.2.1 构建Eg5 shRNA稳转细胞株:Eg5在DU145细胞内的表达由慢病毒Eg5 shRNA载体干扰实现。慢病毒NC shRNA及Eg5 shRNA稳转DU145细胞株按照说明书构建,通过测定细胞内Eg5 mRNA及蛋白水平来确定基因是否被沉默。
1.2.2 MTT实验:实验分为对照组、NC shRNA组、Eg5 shRNA组和SB-743921组。其中,NC shRNA组和Eg5 shRNA组是将NC shRNA和Eg5 shRNA稳转DU145细胞以4×104/mL接种于96孔板分别培养24、48、72 h,随后用MTT法测定各组细胞生长活力。SB-743921对3种前列腺癌细胞株的生长抑制作用同样用MTT法测定。用0~24 nmol/L的SB-743921分别处理3种癌细胞72 h后,测定SB-743921对各细胞的IC50值。待确定IC50值后,设置SB-743921组,将对数生长期的人CRPC细胞株DU145、PC-3及LNCaP以4×104/mL铺板至96孔板,待细胞贴壁后,分别用浓度为2.0、4.0、8.0 nmol/L的Eg5 抑制剂SB-743921分别处理细胞24、48、72 h,探索不同浓度SB-743921对细胞生长活力的影响。随后,在每孔加入MTT继续培养4 h,吸除上清液,每孔加入150 μL DMSO,震荡30 s之后,用酶标仪测定570 nm处的吸光度值。细胞生长活力(%)=实验组吸光度值/空白对照组吸光度值×100%。
1.2.3 单克隆形成实验:NC shRNA组和Eg5 shRNA组是将NC shRNA及Eg5 shRNA稳转DU145细胞以500个/孔接种在24孔板,用含有8%胎牛血清的MEM完全培养基培养细胞14 d。SB-743921组是将处于对数生长期的DU145细胞以500个/孔接种在24孔板,待细胞贴壁之后,用SB-743921处理细胞14 d,由于实验细胞密度低,处理时间长,SB-743921的浓度选用2.0 nmol/L。各组细胞每3 d换一次液,待培养细胞14 d后,移除培养基,用PBS清洗两遍,用预冷的甲醇固定10 min,随后用0.1%(g/mL)结晶紫染色10 min,PBS清洗至背景干净,拍照。
1.2.4 细胞凋亡实验:NC shRNA组和Eg5 shRNA组是将NC shRNA及Eg5 shRNA稳转DU145细胞以1× 106/mL接种在6孔板上,培养细胞48 h。SB-743921组是将处于对数生长期的DU145细胞以1×106/mL接种在6孔板上,待细胞贴壁后分别加入4.0 nmol/L和8.0 nmol/L的SB-743921继续培养细胞48 h。待各组细胞处理结束后,收集细胞,PBS清洗细胞两遍,用Annexin V-FITC室温避光染细胞5 min,然后用PI对细胞染色5 min。标记了Annexin V-FITC和PI的细胞用流式细胞仪测定细胞凋亡情况。细胞凋亡数据用FlowJo 7.6软件处理。
1.2.5 细胞周期检测:NC shRNA组和Eg5 shRNA组,将对数生长期的NC shRNA及Eg5 shRNA稳转DU145细胞以1×106/mL接种在6孔板上,待细胞贴壁后换液,培养48 h。SB-743921组将处于对数生长期的DU145细胞以1×106/mL接种在6孔板上,待细胞贴壁后分别加入4.0 nmol/L和8.0 nmol/L的SB-743921继续培养48 h。收集各组细胞后,用PBS清洗细胞两遍,随后将各组细胞固定在70%的乙醇。待细胞固定之后,用含有RNAase A的PI染液室温孵育细胞30 min,多余的PI用PBS清洗除去,上机测定细胞周期分布情况。细胞周期数据用ModFit LT3.3软件分析。
1.2.6 划痕实验:NC shRNA组和Eg5 shRNA组,将对数生长期的NC shRNA及Eg5 shRNA稳转DU145细胞以2×105/mL的浓度接种在6孔板中,待细胞贴壁后用移液器吸头制造划痕,将培养基换为含2%胎牛血清的MEM培养基培养细胞48 h。SB-743921处理组,将处于对数生长期的DU145细胞按照2×105/mL的浓度接种在6孔板中,制造划痕,为避免细胞凋亡对划痕实验的干扰,用4.0 nmol/L的SB-743921处理细胞48 h。用倒置显微镜拍照记录细胞迁移情况,细胞迁移率(%)=(1-48 h划痕宽度/0 h划痕宽度)×100%。
1.2.7 q-PCR实验:待各组细胞培养48 h之后,收集细胞,用RNAiso Plus试剂提取总RNA。cDNA由1.0 μmol/L RNA通过R323 反转录试剂盒反转录得到。q-PCR根据Q311试剂盒说明书要求进行。q-PCR通过real-time q-PCR仪测定各组细胞内Eg5、c-Myc、SP1、CDK1、细胞周期蛋白Cyclin A1、细胞周期蛋白Cyclin B1、细胞分裂周期因子25B(cell division cycle protein 25B,CDC25B)、N-钙黏蛋白(N-cadherin)、波形蛋白(Vimentin)以及E-钙黏蛋白(E-cadherin)表达的影响。溶解曲线分析中,以GAPDH基因作为内参,使用2-△△Ct方法计算相对表达量。各基因引物序列见表1。

表1 q-PCR引物序列
1.2.8 蛋白质印迹(Western blot)实验:待各组细胞培养48 h之后,收集细胞,用RIPA细胞裂解缓冲液在冰上裂解40 min后,离dSDS-PAGE凝胶电泳分离,并将分离得到的目标蛋白通过湿法电转印到PVDF膜上。膜上的蛋白用5%(w/v)脱脂奶粉室温封闭1 h,之后用一抗4 ℃孵育8 h,二抗室温孵育1.5 h。最后,PVDF膜上的蛋白用增强化学发光液显色,检测系统检测后,用ImageJ处理数据。
1.3 统计学处理方法 采用SPSS19.0软件进行分析。计量资料以±s表示,两组比较采用Student’st检验,多组比较采用单因素方差分析,组间两两比较采用LSD检验。P<0.05为差异有统计学意义。
2 结果
2.1 Eg5表达和活性的抑制对前列腺癌细胞生长的影响 SB-743921组与对照组比,Eg5基因的表达差异无统计学意义(P>0.05),见图1。Eg5抑制剂SB-743921处理细胞72 h之后,可显著抑制3种细胞的生长(P<0.05)。其中,SB-743921抑制DU145细胞生长的IC50值为(8.73±0.67)nmol/L,见图2。通过考察不同时间SB-743921对细胞的生长抑制作用,发现SB-743921组和对照组比,可显著抑制DU145细胞的生长(P<0.05),见图3。2.0 nmol/L的SB-743921组和Eg5 shRNA组与对照组和NC shRNA组比,细胞克隆数明显减少(P<0.05),见图4。

图1 DU145细胞内Eg5表达情况
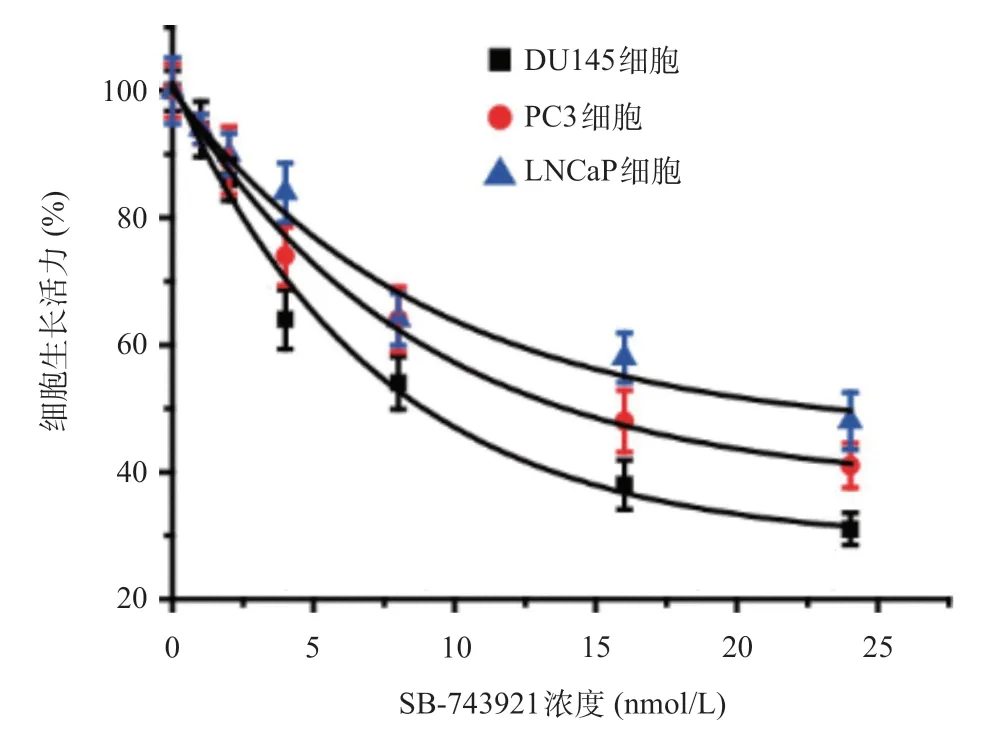
图2 SB-743921抑制前列腺癌细胞增殖

图3 不同时间DU145细胞生长情况
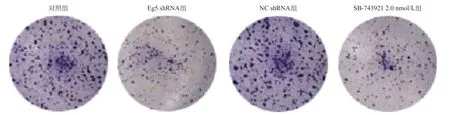
图4 单克隆实验测定DU145细胞增殖情况
2.2 Eg5表达和活性的抑制对DU145细胞凋亡的影响 Annexin V-FITC(+)/PI(+)和Annexin V-FITC(+)/ PI(-)分别表示细胞处在凋亡中晚期和凋亡早期阶段,见图5。NC shRNA组和对照组相比,组间细胞凋亡率差异无统计学意义(P>0.05)。Eg5 shRNA组、4.0 nmol/L和8.0 nmol/L SB-743921组与对照组相比,DU145细胞凋亡率均显著增加(P<0.05),见图6。

图5 DU145细胞凋亡情况

图6 Eg5调节DU145细胞凋亡
2.3 Eg5 表达和活性的抑制对细胞周期的影响 NC shRNA组与对照组比,细胞周期分布差异无统计学意义(P>0.05),见图7。Eg5 shRNA组和SB-743921组与对照组比,细胞周期在G2/M期的含量均显著增加(P<0.05),见图8。

图7 DU145细胞周期分布
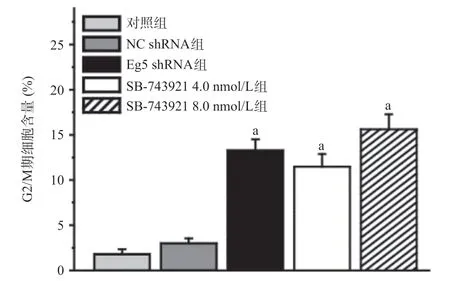
图8 Eg5调节DU145细胞周期分布
2.4 Eg5表达和活性的抑制对DU145细胞迁移的影响 NC shRNA组与对照组相比,细胞迁移率差异无统计学意义(P>0.05)。Eg5 shRNA组和SB-743921组与对照组比,细胞迁移率均显著降低,差异有统计学意义(P<0.05),见图9。
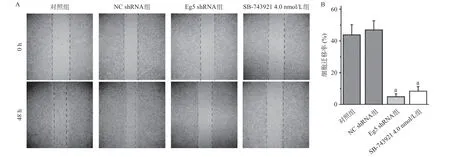
图9 Eg5调节DU145细胞迁移
2.5 q-PCR检测Eg5对c-Myc、SP1、CDK1等基因表达的调节作用 NC shRNA组和对照组比,c-Myc、SP1、CDK1、Cyclin A1、Cyclin B1、CDC25B、N-cadherin、E-cadherin及Vimentin mRNA的相对表达量差异无统计学意义(P>0.05)。Eg5 shRNA组和SB-743921组与对照组比,细胞内c-Myc、SP1、CDK1 Cyclin A1、Cyclin B1、CDC25B、N-cadherin及Vimentin mRNA的相对表达量均降低(P<0.05),E-cadherin的相对表达量均显著增加(P<0.05),见图10。
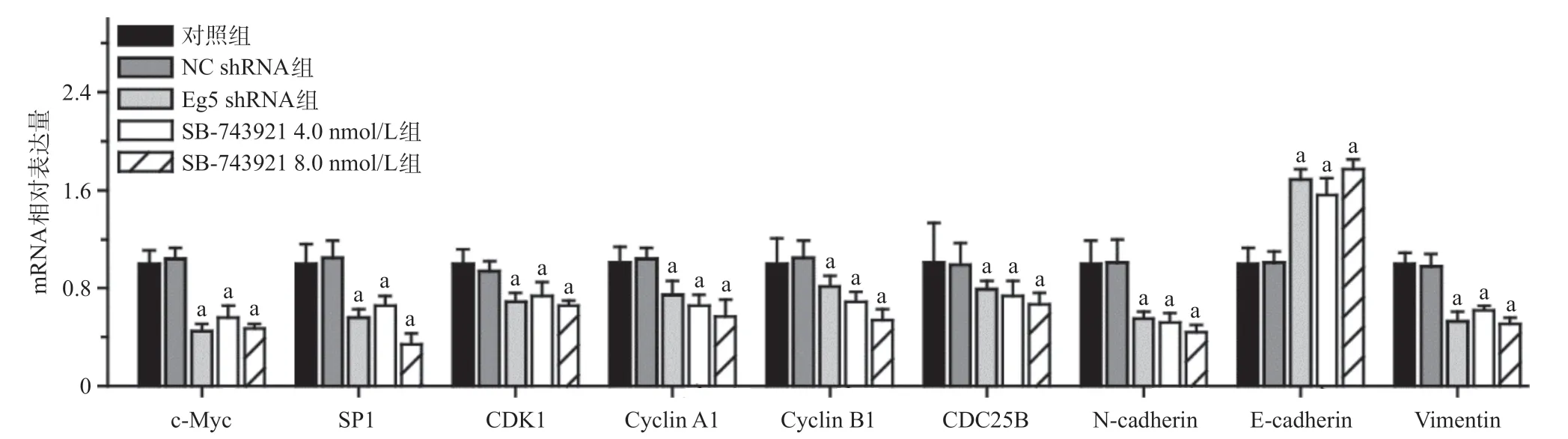
图10 qPCR分析DU145细胞内c-Myc、SP1及相关基因的表达量
2.6 Western blot测定Eg5对DU145细胞内c-Myc、SP1、CDK1等蛋白表达的影响 Western blot检测发现NC shRNA组和对照组比,c-Myc、SP1、CDK1、Cyclin A1、Cyclin B1、CDC25B、N-cadherin、E-cadherin及Vimentin蛋白的表达量差异无统计学意义(P>0.05)。Eg5 shRNA组和SB-743921组与对照组比,细胞内c-Myc、SP1、CDK1 Cyclin A1、Cyclin B1、CDC25B、N-cadherin及Vimentin蛋白的表达量均降低(P<0.05),E-cadherin蛋白的表达量显著增加(P<0.05),见图11。
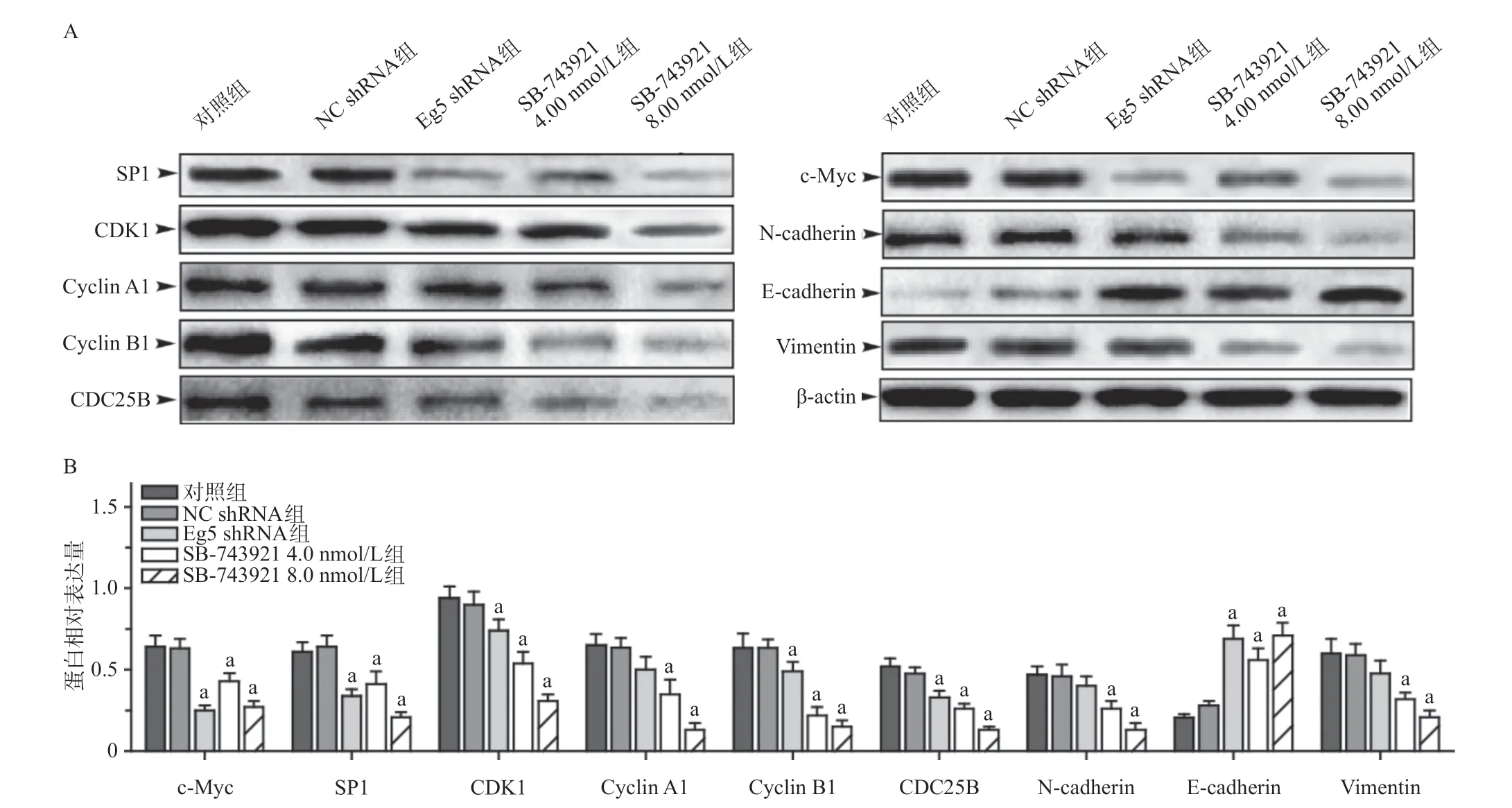
图11 Western blot检测DU145细胞内c-Myc、SP1及相关蛋白的表达量
3 讨论
Eg5生物功能的阻断,会引起细胞有丝分裂阻滞及细胞凋亡,是一个非常重要的药物靶点[8-10]。与很多参与调节有丝分裂的因子不同,Eg5在正常组织细胞中的表达量极低,而在恶性肿瘤细胞内的表达量却很高[9]。Eg5在正常细胞及恶性肿瘤细胞内的差异性表达导致靶向Eg5的疗法不良反应相对较低,是很好的抗有丝分裂疗法。CRPC细胞内存在Eg5的过度表达和活化,探究Eg5对CRPC细胞恶性增殖以及侵袭转移的调节作用,可以为基于该类靶点的药物开发提供理论依据。然而,关于Eg5调节CRPC细胞增殖的研究很少。本研究初步探究了Eg5对CRPC DU145细胞恶性增殖和侵袭转移的调节作用,同时评价了Eg5小分子抑制剂SB-743921对DU145细胞生长及转移的影响,并对相应的机制做了初步的探究。
本研究发现用Eg5 shRNA沉默Eg5在DU145细胞内的表达或者用SB-743921抑制Eg5的功能,均能抑制3种前列腺癌细胞DU145、PC3和LNCap的恶性增殖。进一步的研究发现,Eg5表达和功能的抑制会促进DU145细胞凋亡,阻断细胞周期G2期到M期的转换并削弱细胞的迁移能力。多种基因调节细胞周期G2期到M期的转换,其中周期蛋白依赖性激酶CDK1、Cyclin A1、Cyclin B1及CDC25B发挥关键作用。CDK1是细胞有丝分裂重要的调节,通过与细胞周期蛋白Cyclin A1 及Cyclin B1 来调节细胞周期G2到M期的转换[15-16]。当CDK1表达降低,细胞周期会阻滞在G2/M期,继而导致细胞无法进行有丝分裂而死亡[15]。细胞分裂周期因子CDC25B与CDK1一样,也是参与细胞有丝分裂的重要因子,当CDC25B的表达量降低,会导致细胞周期阻滞在M期[15]。多种基因参与调节CDK1的表达和功能,其中转录因子SP1就被证实可以调节CDK1的表达[13-14]。Eg5是癌基因c-Myc的上游靶基因,研究表明Eg5表达和功能的抑制,会直接导致c-Myc表达量的降低[11,13]。而转录因子SP1是c-Myc的下游靶基因,与肿瘤的恶性增殖及侵袭转移密切相关[13-14]。因此,Eg5可能通过调节c-Myc的表达,进而调节转录因子SP1的表达和功能来调控CDK1等细胞周期相关蛋白的功能。基于此设想,本研究用q-PCR和Western blot评价了Eg5对c-Myc、SP1、CDK1、Cyclin A1、Cyclin B1及CDC25B表达的影响。q-PCR和Western blot结果同时证明,当Eg5表达和功能被抑制后,c-Myc、SP1以及参与调节G2到M期转换的基因CDK1、Cyclin A1、Cyclin B1及CDC25B表达的均显著降低。这表明,Eg5可能通过c-Myc/SP1/CDK1信号通路将细胞周期阻滞在G2/M期。
作为重要的转录因子,特异性蛋白SP1通过调节多种通路来促进肿瘤的恶性进展[13]。除细胞周期,SP1还被证明参与调节肿瘤的侵袭转移[14]。包括N-cadherin、Vimentin和E-cadherin在内的多种基因参与调节肿瘤细胞的侵袭转移[17],而转录因子SP1被证明参与调节N-cadherin、Vimentin和E-cadherin的表达和功能来促进肿瘤细胞的侵袭转移[17-18]。这表明,Eg5很可能是通过c-Myc间接的调节SP1的表达,继而调节N-cadherin、Vimentin和E-cadherin的表达和功能来调控肿瘤细胞的侵袭转移。本研究q-PCR和Western blot结果表明,当Eg5表达和活性受到抑制,会导致细胞侵袭转移相关基因N-cadherin和Vimentin表达的降低以及E-cadherin表达的增加,继而削弱肿瘤细胞的迁移能力。这表明,Eg5可能通过c-Myc/SP1信号通路来抑制CRPC细胞的侵袭转移,但具体的调节机制需要进一步验证。
综上所述,本研究初步探讨了Eg5对CRPC细胞恶性增殖及侵袭转移的影响及机制,为以Eg5为靶点的小分子药物设计提供理论基础。

