血清Galectin-3和HDL-C水平检测对急性缺血性脑卒中预后的影响研究
利荣乔
(广西壮族自治区江滨医院,南宁 530021)
急性缺血性脑卒中(acute ischemic stroke,AIS)患者患病率逐年升高,致残率和致死率较高,严重影响患者身心健康,动脉粥样硬化和炎症反应是AIS 的发病机制之一,而识别有效的生物标志物有助于预测和改善患者预后[1-2]。半乳糖蛋白-3(Galectin-3)是一种人体多效性蛋白,可作为心血管疾病预后判断的敏感生物标志物 。研究表明,血清中Galectin-3 表达增加与卒中的严重程度和预后不良有关[3-5]。高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)是一种抗氧化剂,且HDL-C 的表达与缺血性卒中的死亡率和心血管事件呈负相关,低HDL-C 水平多提示预后不良[3,6-7]。目前有关Galectin-3 和HDL-C 对AIS 预后的协同影响作用的研究尚少。本研究旨在评估Galectin-3 和HDL-C 对AIS 随访6~12 个月内不良预后的影响,为进一步指导治疗AIS 患者提供有力的临床证据。
1.材料与方法
1.1 研究对象 选择2014年1月~2019年6月在广西壮族自治区江滨医院接受治疗的AIS 患者1 104 例进行前瞻性研究,出院后随访6 ~12 个月。诊断标准符合中国急性缺血性脑卒中诊治指南2013 版,发病24 ~48h 内出现局灶性神经功能缺损,经头颅MRI 的DWI 序列证实为急性梗死灶;纳入标准:年龄≥18 岁,发病48h 以内,首次出现缺血性脑卒中患者;排除标准:并发其他严重感染、恶性肿瘤和心肺功能不全的患者;此项研究通过我院伦理委员会批准,所有研究对象均签署知情同意书。
1.2 仪器与试剂 Galectin-3 酶联免疫试剂盒(北京百奥莱博科技有限公司,ZN2192),HDL-C 试剂盒(上海齐源生物科技有限公司,QKT0655),全自动生化分析仪(美国贝克曼库尔特公司 DXI800)。
1.3 方法
1.3.1 Galectin-3 和HDL-C 检测及分组:入院24h内空腹抽取静脉血10ml,采用酶联免疫吸附试验(ELISA)试剂盒检测血清中Galectin-3 含量,严格按照操作步骤进行,采用全自动生化分析仪测定高密度脂蛋白-胆固醇(HDL-C)、低密度脂蛋白-胆固醇(LDL-C)、总胆固醇(TC)、三酰甘油(TG)等血生化指标,Galectin-3 浓度分为:<8.65ng/ml(低水平组)和≥8.65ng/ml(高水平组),HDL-C 浓度分为:<0.9mmol/L(低水平组)和≥0.9mmol/L(高水平组)[1,7]。根据Galectin-3 和HDL-C 水平将患者分为4 组:低Galectin-3/高HDL-C 组,低Galectin-3/ 低HDL-C 组, 高Galectin-3/ 高HDL-C 组和高Galectin-3/低HDL-C 组。
1.3.2 随访及观察指标 :住院期间所有患者均予以抗血小板聚集、降脂稳定斑块、脑保护、改善脑循环和营养脑神经等神经内科常规治疗,收集所有研究对象的一般临床资料,包括人口学资料、实验室血生化指标及脑血管病相关危险因素、梗死类型、用药情况及基线国立卫生研究院卒中量表(NIHSS)评分,治疗后出院随访6~12 个月,随访结局主要包括死亡和心血管事件(如心肌梗死、心绞痛、充血性心力衰竭)的复合结局。次要结局分别是复发性卒中、心血管事件和死亡。
1.4 统计学分析 采用SPSS21.0 软件进行数据分析,非正态分布的计量资料采用中位数(四分位间距)[M(QL~QU)]表示,正态分布的计量资料采用均数±标准差()表示,组间比较采用非参数秩和检验((Mann-WhitneyU秩和检验)或t检验,计数资料采用频数(百分率)表示,组间采用χ2检验,使用Kaplan-Meier 曲线估计各组间主要结局的累积风险,并分别用log-rank 检验进行比较;在多变量Cox 比例风险模型中,调整传统危险因素(年龄、性别、BMI,血管病危险因素、用药情况,模型1)和模型2 在模型1 基础上进一步调整LDL,TC,TG 和NIHSS 评分,然后分析Galectin-3 和HDL-C 水平对预后结局的关联,关联强度用风险比(HRs)和95%置信区间(95%CI)表示,对于心血管事件和死亡的复合结局的危险性,利用受试者工作特征曲线(receiver operating characteristic curve,ROC)分析Galectin-3与HDL-C 对脑卒中预后不良结局的预测价值,P<0.05 为差异有统计学意义。
2 结果
2.1 研究对象一般临床资料 见表1。1 104 例患者中,36 例患者失访(3.26%),1 068 例患者入组,高Galectin-3 组与低Galectin-3 组比较,年龄更大,吸烟饮酒、卒中史患者更多、空腹血糖更高,基线NIHSS 评分更高,差异均有统计学意义(均P<0.05);低HDL-C 组与高HDL-C 组比较,女性、高血压、糖尿病患者、BMI 和TG 水平更高,TC 和LDL 水平更低,差异均有统计学意义(均P<0.05)。
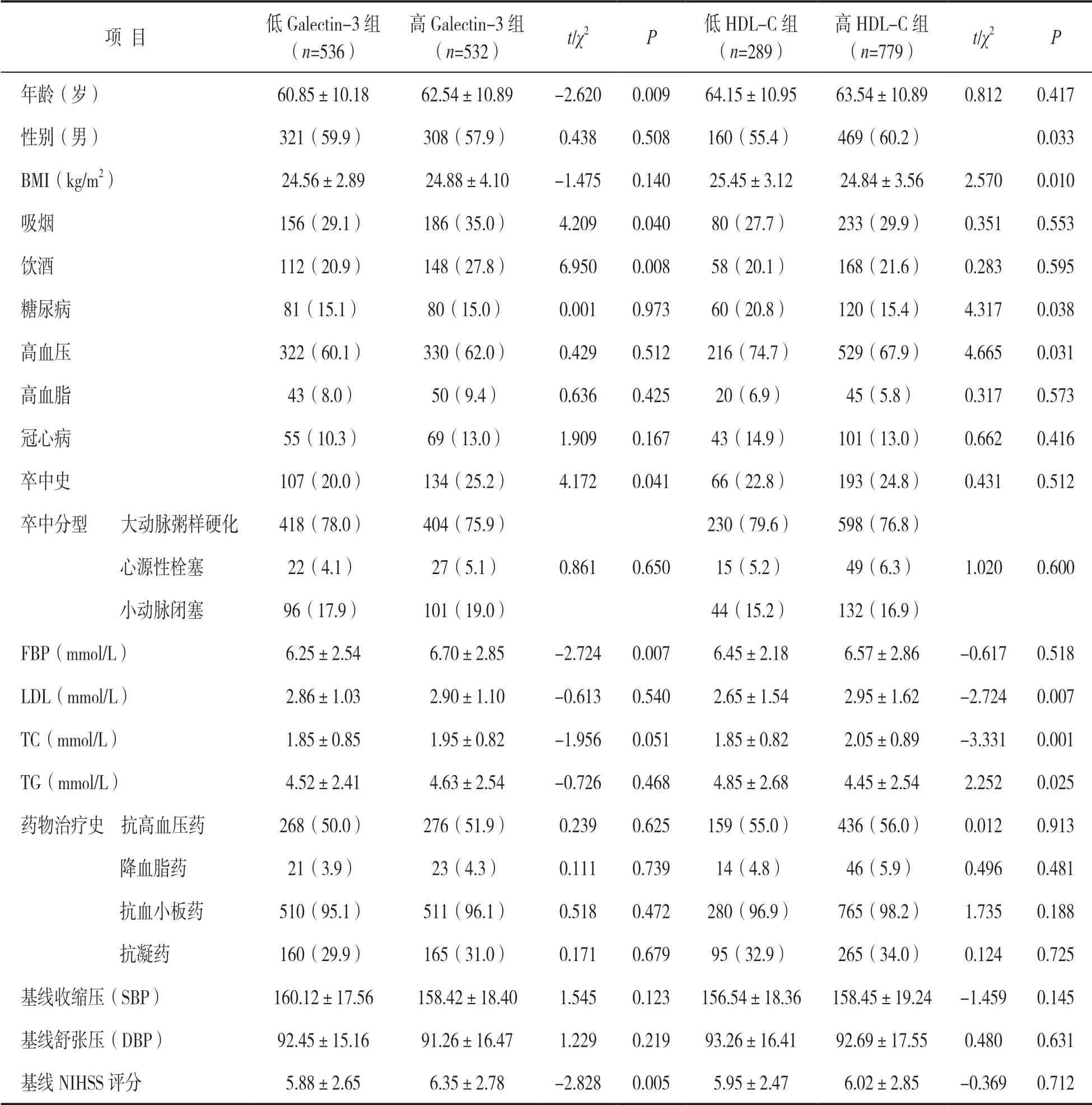
表1 一般临床资料分析[n(%)]
2.2 随访6 ~12 个月结局分析 详见表2。采用Cox 模型分析,控制传统危险因素(模型1),与低Galectin-3/高HDL-C 组相比,高Galectin-3/低HDL-C 组随访6~12 个月内发生心血管事件和死亡的复合结局、复发性脑卒中、心血管事件的HR(95%CI)分别为1.56(1.08~2.22),1.84(1.10~2.98),1.95(1.26~2.98)和1.35(0.85~2.15),在模型1 基础上进一步调整LDL-C,TC,TG和NIHSS评分(模型2),发现高Galectin-3/低HDL-C 组卒中后6~12 个月内主要结局(心血管事件和死亡复合结局)和次要结局(复发性脑卒中、心血管事件)的发生率高(均P<0.05)。
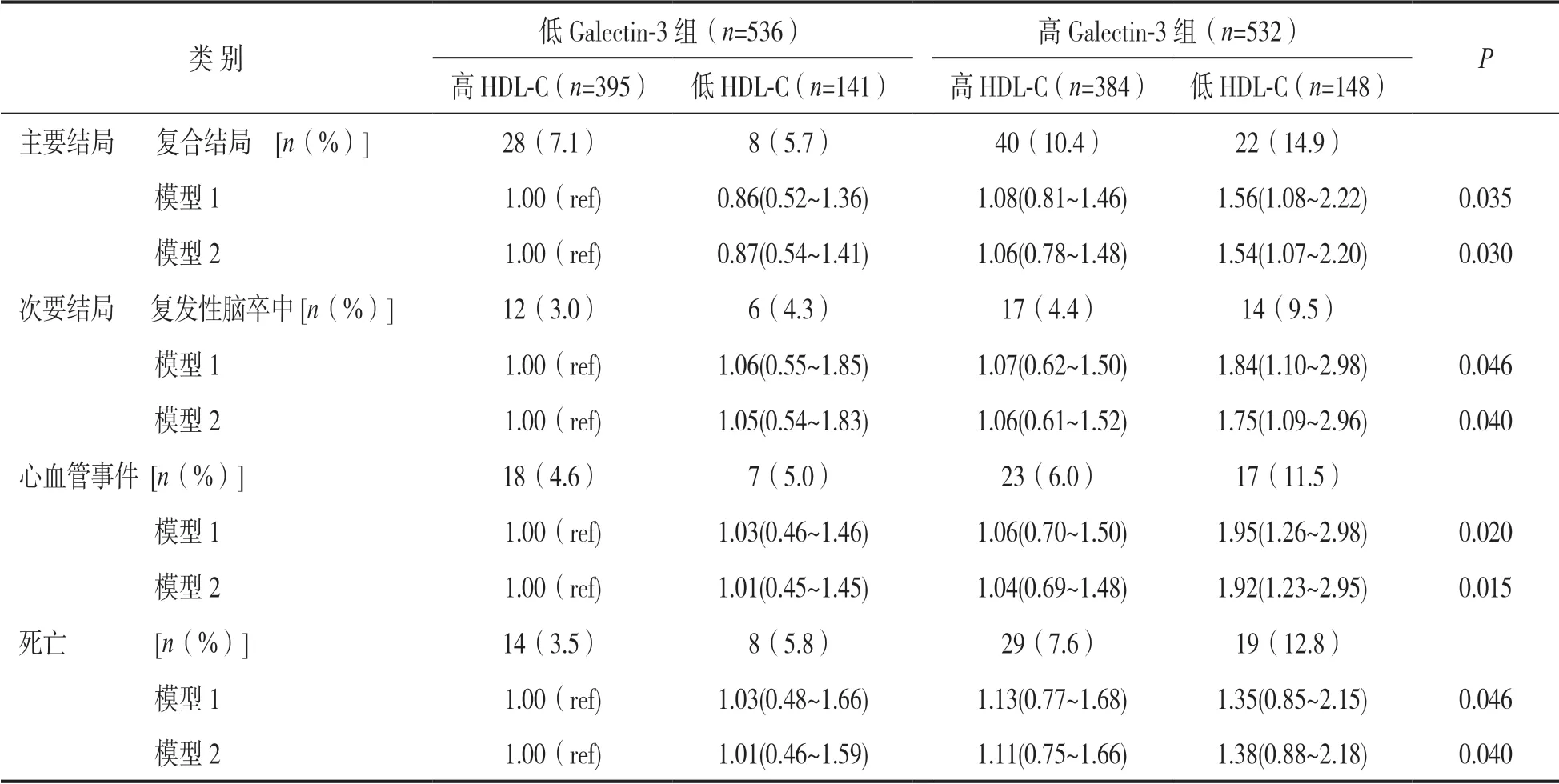
表2 不同亚组间随访6-12 个月预后结局的Cox 模型分析[HR(95% CI)]
2.3 Galectin-3 与HDL-C 水平与心血管事件及死亡复合结局的相关性 见图1。采用Kaplan-Meier 绘制不同Galectin-3 与HDL-C 水平与脑卒中患者6~12 个月后心血管事件和死亡结局的曲线, 不同亚组间随访6~12 个月后心血管事件和死亡复合结局间差异有统计学意义(P<0.05),与低Galectin-3/高HDL-C 相比,高Galectin-3/低HDL-C 组发生心血管事件和死亡复合结局发生率高(Log rank 检验,χ2=4.189,P<0.001)。

图1 Galectin-3 与HDL-C 不同亚组间对卒中后6~12 个月患者预后结局的生存曲线
2.4 Galectin-3 与HDL-C 对脑卒中患者心血管事件和死亡复合结局的预测价值 见图2。采用年龄、性别、BMI,吸烟饮酒史、糖尿病、高血压、高血脂、冠心病、卒中史、卒中梗死类型、FBP,药物治疗史、基线SBP,基线DBP 与患者心血管事件和死亡复合结局建立一般预测模型(一般模型),利用ROC曲线分析一般模型卒中后随访6~12 个月内发生心血管事件和死亡的复合结局预测的AUC 为0.693,95%CI:0.655~0.734,P=0.008。在一般模型基础上增加Galectin-3 与HDL-C 变量的AUC 为0.732,95%CI:0.663~0.738,AUC 增加了0.039(χ2=3.85,P=0.002)。
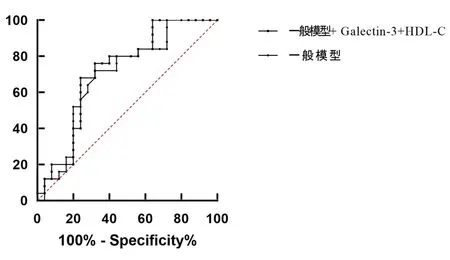
图2 Galectin-3 与HDL-C 预测卒中后6~12 个月患者心血管事件和死亡复合结局的ROC 曲线
3 讨论
AIS 患者是一种常见性脑血管疾病,致残率和致死率较高,严重影响患者的生活质量,而寻找影响患者预后的生物标志物对患者的治疗是十分重要的。然而,目前有关高Galectin-3 和低HDL-C 联合作用对缺血性卒中患者死亡和血管事件的影响研究尚少。因此,本研究拟探讨Galectin-3 和HDL-C 联合作用对缺血性脑卒中6~12个月预后结局的影响,为靶向治疗缺血性脑卒中患者提供重要的临床生物标志物。
Galectin-3 是一种与半乳糖苷结合的蛋白,在纤维化、炎症、组织修复和细胞增殖中起调节作用[4]。Galectin-3 的升高与高血糖患者卒中后6~12个月内的主要预后、卒中复发和血管事件有关,提示Galectin-3 可能是缺血性卒中高血糖患者的重要预后因素[8]。另外,Galectin-3 是动脉粥样硬化和心血管疾病的生物标志物,可能是预测缺血性卒中风险的有效标志物和治疗靶点[4-5,9-10]。研究发现,Galectin-3 浓度在颈动脉粥样硬化患者中升高,并与外周动脉疾病患者心血管死亡风险升高独立相关,Galectin-3 的升高可作为血管炎症的反应标志物,招募单核细胞并促进其向动脉壁迁移,从而放大血管炎症,刺激巨噬细胞在动脉粥样硬化病变中释放炎性介质,特别是在不稳定的斑块区域中释放多种促炎分子[3,11-12]。一项病例对照研究显示,在预后较差的缺血性卒中患者中,Galectin-3 明显升高,而抑制Galectin-3 水平可减少炎性因子的表达,从而改善患者预后[13]。
HDL-C 具有重要的抗动脉粥样硬化和抗氧化功能,但目前还不十分清楚HDL 的抗氧化活性是否与AIS 的严重程度和预后不良相关[7,14-16]。有研究表明HDL-C 与包括缺血性卒中在内的心血管事件风险呈负相关,HDL-C 可促进胆固醇从动脉壁巨噬细胞中流出,具有抗氧化、抗炎及对内皮的保护作用,而发挥抗动脉粥样硬化功能[7,17]一项经静脉溶栓治疗卒中患者的研究表明,低HDL-C 水平与卒中后死亡、复发性卒中或缺血性心脏病等心血管病事件风险增加有关[3]。另外,在病理条件下,HDL-C 抗动脉粥样硬化和抗炎等血管保护作用的主要机制可能与氧磷酶-1(PON1)和髓过氧化物酶(MPO)相关,而MPO/PON1 活性降低是HDL-C抗动脉粥样硬化功能障碍的一个主要影响指标,可间接反映HDL-C 的胆固醇逆转运功能障碍[7,18-19]。
在本研究中,高Galectin-3 和低HDL-C 组与低Galectin-3 和高HDL-C 组相比,在调整了各种混杂因素后,可增加缺血性卒中后6~12 个月内死亡和血管事件、卒中复发和血管事件的复合结局风险。此外,在一般模型中加入Galectin-3 和HDL-C 水平进行ROC 曲线分析发现两指标联合作用(高Galectin-3/低HDL-C 水平)对卒中后预后不良具有预测价值。总之,本研究主要探讨卒中后Galectin-3 与HDL-C 对脑卒中患者心血管事件和死亡复合结局的ROC 曲线预测价值,在一般模型基础上增加Galectin-3 与HDL-C 变量可增加卒中后不良预后风险,尽管本研究中在传统危险因素上添加Galectin-3 与HDL-C 变量仅增加卒中后不良预后的效应并不高,考虑卒中后预后不良存在诸多因素影响及相互协调作用有关。
本研究表明,高Galectin-3/低HDL-C 水平对卒中后预后不良具有协同影响作用,其可能机制是由于急性脑卒中患者分泌Galectin-3 的机制通过Toll 样受体4 促进小胶质细胞的持续激活,激活大脑的炎症反应。此外,Galectin-3 可增强巨噬细胞吞噬氧化LDL-C,加剧动脉粥样硬化和斑块破裂;而在富含脂质的巨噬细胞中,修饰的脂蛋白也会诱导Galectin-3 过表达,而提高HDL-C 水平阻断氧化LDL-C 在动脉壁细胞中的脂质修饰作用,并抑制氧化LDL-C 诱导的单核细胞介导的炎症反应[1-3,7,11-12]。因此,高Galectin-3 伴低HDL-C 水平可能加重缺血性脑卒中后的炎症和氧化应激状态,提示对于同时伴有Galectin-3 升高和HDL-C 降低的卒中患者,应在卒中后急性期降低Galectin-3 和提高HDL-C 水平可能有助于改善患者临床结局。本研究存在一定局限性,低HDL-C 水平的患者数量相对较少,这可能限制了检测Galectin-3 和HDL-C 联合作用与研究结果的显著相关性的效力。另外,随访时间尚短,而Galectin-3 和HDL-C 水平协调作用对卒中后远期预后的协调作用及具体机制尚不清楚,今后拟进一步分组探讨Galectin-3 和HDL-C 水平对卒中远期预后影响及相关机制研究,为寻找精准评估卒中预后的特异性血清标志物提供了重要的参考依据。总之, 高Galectin-3 和低HDL-C 水平与AIS后6~12个月内死亡和心血管事件的复合结局相关,阐明了Galectin-3 和HDL-C 水平可能参与卒中发病机制及其进展,提示高Galectin-3 和低HDL-C 水平的联合判断有利于识别AIS 不良预后结局。今后在临床上,对于ASI 患者可进行常规血清Galectin-3和HDL-C 水平检测,对于高Galectin-3/低HDL-C水平的卒中患者,应予以个性化治疗,有助于改善卒中后不良预后发生情况。

