缬氨酸影响小鼠C2C12细胞脂肪沉积的研究
杜志强,丁 然,赵素娟,陈耀峰,王守志
(1.长江大学动物科学学院,湖北 荆州 434025;2.东北农业大学动物科学技术学院,哈尔滨 150030)
动物肉类产品是人类获取蛋白重要来源。随着国民经济发展,人民生活水平进一步提高,消费者对肉类口感、色泽、风味、嫩度等品质要求逐渐提高。肌内脂肪(Intramuscular fat,IMF)是指肌纤维间或肌细胞内部积累的脂肪,作为脂肪沉积重要形式之一,与肌肉嫩度直接相关[1]。肌内脂肪可提高肌肉系水力,通过降低烹饪中水损失,提高肉质嫩度[2]。同时,IMF对肌肉剪切力和风味产生重要影响[3]。近年来,通过改善饲料营养成分,分子遗传标记和遗传选育等手段成功降低动物腹脂率,但肌肉中IMF随之降低,极大程度影响肉制品品质[4]。因此,合理调节IMF含量,改善肉质品品质成为研究热点。
IMF分为两种,在肌肉细胞内由甘油三酯形成的脂滴,称为肌内三酰甘油(IMTGs);分布在肌肉间质或周围肌束中的脂肪细胞,称为肌肉内脂肪组织(IMAT)[5]。IMTGs含量仅占IMF总TGs含量5%~20%,对于肉质有重要影响[6]。过度补充包括脂肪酸、氨基酸、葡萄糖在内的营养物质,是导致细胞内脂肪沉积重要因素之一[7]。脂肪酸和葡萄糖影响脂质代谢及脂肪沉积相关研究较多,氨基酸在脂肪沉积中作用研究甚少。
氨基酸是蛋白质组成成分,以游离形式储存于动物体内,起营养、感官和生物调节等作用。越来越多证据表明,支链氨基酸(Branched-chain amino acids,BCAAs)在脂质代谢调节中起重要作用[8],同肥胖及代谢紊乱相关。血浆中BCAAs浓度被认定为脂质代谢稳态重要特征之一[9]。BCAAs包括亮氨酸、异亮氨酸和缬氨酸(Valine),均为哺乳动物必需氨基酸。BCAAs可通过自身分解代谢,促进脂肪细胞分化及脂肪合成[10]。饮食剥夺BCAAs对降低小鼠腹部脂肪量具有重要影响[11]。当饮食中缺乏支链氨基酸,尤其是缬氨酸时,小鼠腹部脂肪沉积急剧减少[12];补充缬氨酸后小鼠血液中循环脂肪酸水平显著上升[13]。在猪乳腺上皮细胞中,缬氨酸可通过上调AKT/mTOR/SREBP-1c信号通路相关蛋白,增加与脂肪酸合成和细胞内TGs含量相关蛋白表达[14]。目前支链氨基酸研究日益增多,但对缬氨酸促进肌肉细胞脂肪沉积研究较少,对其促进肌肉细胞脂肪沉积具体分子机制尚不明确,有待进一步探究。
C2C12细胞具备良好双向分化潜能,既可成脂分化,也可成肌分化形成肌管,是研究脂肪沉积的优良模型。目前,在肥胖、高血脂、胰岛素抵抗和肝脂肪变性等代谢疾病及体外代谢相关方向研究广泛[16]。本试验使用不同浓度缬氨酸处理C2C12细胞,通过蛋白免疫印迹试验检测相关信号通路蛋白表达与成熟,油红O染色检测C2C12细胞内脂滴沉积、CCK8试验检测细胞增殖情况,探究缬氨酸是否具备影响肌肉细胞脂肪沉积能力及其潜在机制,为合理调节畜禽肌肉脂肪含量提供参考依据。
1 材料与方法
1.1 主要仪器与试剂
仪器:CO2恒温细胞培养箱(Thremo,美国),SW-CJ-IFD无菌操作台(安泰,苏州),四度立式展示柜(SC228,海尔,青岛),全波长酶标分析仪(Thermo,美国),荧光倒置显微镜(DFC280,Lei⁃ca,德国)。
试剂:L-缬氨酸(纯度>99%)(Solarbio,北京),胎牛血清(FB25015,Gibco,美国),DMEM/F12细胞培养基(C11330500bt,Gibco,美国),PBS(P1020-500,Hyclone,美国),OPTI-MEM(31985070,Gibco,美国),SDS-PAGE凝胶试剂盒(P0012A,碧云天,中国),SREBP-1c抗体(14088-1-AP,Proteintech,美国),β-actin抗体(sc-47778,Cell Signaling Technology,美国),软脂酸(P101061-5g,阿拉丁,上海),CCK8-Kit(BS350B,Biosharp,北京),蛋白浓度测定试剂盒(P0012S,碧云天,北京),油红O染料(Biosharp,北京)。
C2C12细胞:试验中小鼠成肌细胞系为商品化细胞系,购自武汉普赛诺生命科技有限公司(CL-0044)。
1.2 细胞培养
细胞复苏后置于37℃、5%CO2培养箱中。密度长至25 mm2培养瓶底80%左右时,用PBS冲洗两次弃废液。加入500 μL胰蛋白酶于37℃消化50~70 s,细胞呈流沙状后加入适量预配全培养基(加入5%胎牛血清,1%双抗并过滤除菌的DMEM/F12)。将细胞悬液混匀后于适当密度平铺在细胞培养瓶或六孔板中,置于培养箱静置培养用于后续试验。
1.3 缬氨酸处理C2C12细胞
根据先前试验得到C2C12培养条件,将生长状态良好C2C12细胞按照一定初始密度接种于六孔板中,待细胞生长至50%密度时,将培养基更换为不含胎牛血清的OPTI-MEM培养基,12 h后向六个孔中依次加入缬氨酸母液,使六个孔终浓度依次为0、0.15、0.30、0.45、0.60及0.75 mmol·L-1,于37℃培养箱继续培养36 h。向六孔板每孔加入200 μL的RIPA裂解液(RIPA裂解液需预先加入PMSF,防止蛋白降解)。细胞于冰上裂解1 min,用细胞刮板收集细胞,移液器转移至1.5 mL EP管中,于-20℃保存或直接作BCA试验。
1.4 蛋白免疫印记
取10 μL样品,根据BCA浓度测定试剂盒说明书加入工作液和标准蛋白,于562 nm波长测定吸光度,根据标准蛋白OD值绘制标准曲线后,计算蛋白质含量。将剩余蛋白样品1:1加入2×蛋白上样,沸水滚煮10 min,超声破碎3次,每次30 s,置于冰上作后续试验。
采用蛋白免疫印迹试验方法检测SREBP-1c、nSREBP-1c及β-actin蛋白表达量,参照SDSPAGE快速凝胶试剂盒配制蛋白胶。根据BCA试验结果计算每个样品点样体积,保证每孔蛋白上样量一致。点样结束后,室温恒压100 V条件下电泳,至蛋白预染Marker出现分层时,调整电压至140 V,待溴酚蓝指示条带距胶底1~2 cm时停止电泳;120 V恒压湿转110 min;转膜结束后用含有5%脱脂乳的TBST溶液室温封闭120 min;将NC膜置于一抗稀释液中,按抗体说明书比例稀释一抗,4℃过夜封闭;12 h后于一抗稀释液中取出NC膜,TBST清洗3次,每次10 min;37℃摇床孵育二抗60 min;再于TBST中清洗3次,每次10 min;于显影系统对条带显色。Image J软件扫描蛋白条带灰度值,以β-actin为标准,SPSS 17.0对条带灰度扫描结果定量分析,Graphpad绘图以展示蛋白相对表达情况。
1.5 油红O染色测定缬氨酸对C2C12脂肪沉积的影响
按参照1.3试验方法,用0 mmol·L-1及0.45 mmol·L-1缬氨酸处理C2C12细胞36 h,预冷PBS冲洗细胞2~3次,加入预先配置4%多聚甲醛于4℃下固定细胞30 min。同时配制油红O染料,静置5~10 min后用3层定性滤纸过滤。细胞固定结束后,PBS冲洗2~3次,每孔加入500 μL油红O染料,37℃避光孵育20 min,孵育结束后弃油红O染料,向每孔迅速加入500 μL 60%异丙醇,15 s后弃废液,1×PBS漂洗3次,每次2 min。于倒置显微镜下观察并拍照,阳性细胞将被染料标记为红色或橙黄色。
1.6 缬氨酸对细胞增殖的影响
将生长状态良好的C2C12细胞悬液均匀接种于四块96孔板中,每孔100 μL细胞悬液(约2 500个细胞),12 h后更换OPTI-MEM培养基。12 h后,按照0、0.15、0.30、0.45、0.60及0.75 mmol·L-1浓度梯度向96孔板中加入缬氨酸母液(每个浓度设置12次重复),预留12个空位作为空白对照,于培养箱中静置培养。分别于缬氨酸处理12、24、36及48 h时取出96孔板,于无菌操作台中向每孔加入10 μL CCK8试剂,在酶标板振荡器上震荡混匀后于37℃恒温避光孵育90 min,在450 nm波长处于酶标仪测定OD值,利用SPSS 17.0计算各组间差异情况。
1.7 棕榈酸浓度筛选
C2C12细胞接种于六孔板12 h后更换OPTIMEM,细胞饥饿处理12 h后按照0、25、50、75及100 μmol·L-1终浓度向六孔板加入棕榈酸母液,继续培养12 h。12 h后收取蛋白样品,煮样,BCA定量后,通过蛋白免疫印迹试验检测C2C12细胞中SREBP-1c蛋白表达情况。
1.8 不同浓度棕榈酸对C2C12细胞增殖的影响
本次试验共分为6组,第1组为空白对照组,即不加任何药物处理组(Control)。对照组与其他5组每孔接种100 μL细胞悬液,铺板12 h后更换OPTI-MEM培养基,饥饿12 h后,除对照组,其他5组均加入0.45 mmol·L-1缬氨酸,培养24 h后,按照0、25、50、75及100 μmol·L-1浓度梯度加入棕榈酸处理12 h。每孔加入10 μL CCK8试剂,混匀后于37℃培养箱静置孵育90 min,于450 nm波长下检测吸光度,根据吸光度确认细胞增殖情况,SPSS 17.0计算组间差异。
1.9 油红O染色和蛋白免疫印记测定缬氨酸对棕榈酸依赖的脂质沉积的影响
试验分为4组:空白对照组(Control),缬氨酸组(Valine),棕榈酸组(PA)及缬氨酸与棕榈酸协同处理组(Val+PA)。
取生长状态良好小鼠C2C12细胞,接种于六孔板中,细胞生长至约40%时更换为OPTI-MEM培养基,饥饿处理12 h后,向Valine组和Val+PA组加入0.45 mmol·L-1缬氨酸,培养24 h后向PA组和Val+PA组加入75 μmol·L-1棕榈酸,继续培养12 h,油红染色检测C2C12细胞内脂滴合成情况。另取一块六孔板按照上述试验分组设置对C2C12加药处理,收取蛋白后参照1.4所述相关实验操作开展蛋白免疫印迹试验,检测SREBP-1c蛋白表达情况。
1.10 统计分析
数据以平均值±标准误差表示,使用SPSS 17.0处理与计算数据,Graphpad 8.0软件制图。
2 结果与分析
2.1 不同浓度缬氨酸处理影响SREBP-1c蛋白表达
不同浓度缬氨酸对SREBP-1c蛋白表达的影响如图1所示。

图1 不同浓度缬氨酸对SREBP-1c蛋白表达的影响Fig.1 Influence of different concentrations of valine on SREBP-1c protein expression
根据前期试验结果,为获得最适缬氨酸浓度,在六孔板中加入缬氨酸至6种不同终浓度(0、0.15、0.30、0.45、0.60及0.75 mmol·L-1)。蛋白免疫印迹检测C2C12细胞中SREBP-1c、nSREBP-1c表达情况。由图1A可知,C2C12细胞中SREBP-1c及nSREBP-1c蛋白表达随缬氨酸剂量升高而逐渐增加;至0.45 mmol·L-1时,蛋白表达水平达到最高,继而降低(灰度扫描结果:图1C和D)。由此可见,缬氨酸呈剂量依赖性形式促进C2C12细胞中SREBP-1c蛋白表达和成熟,且最适浓度为0.45 mmol·L-1。
2.2 不同浓度缬氨酸影响C2C12脂滴合成
向六孔板中缬氨酸处理组孔中加入终浓度0.45 mmol·L-1缬氨酸处理36 h后,使用油红O染色液对细胞染色,检测C2C12细胞脂滴合成情况。如图2所示,添加0.45 mmol·L-1缬氨酸后,细胞内开始产生脂滴。结果说明,缬氨酸促进SREBP-1c表达和成熟,但若缺乏脂质沉积所需底物,缬氨酸可能无法较大程度促进C2C12细胞脂肪沉积。
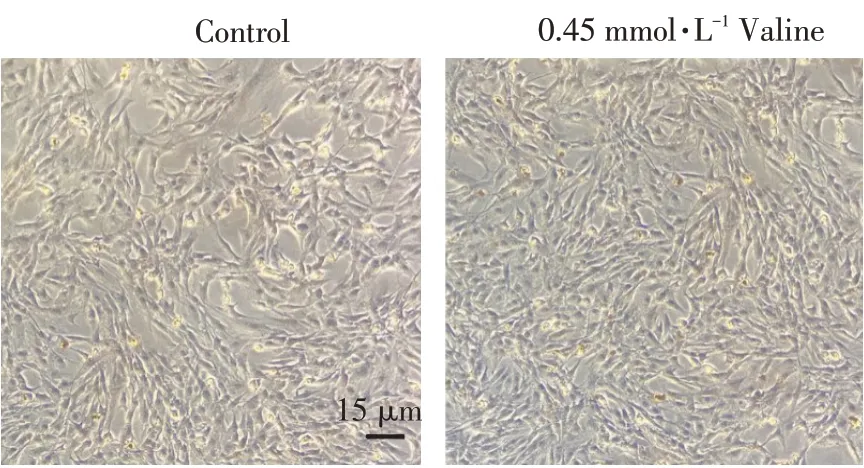
图2 油红O染色检测0.45 mmol·L-1缬氨酸对C2C12细胞脂滴沉积的影响Fig.2 Oil red O staining detected the effect of 0.45 mmol·L-1 valine on lipid droplet deposition on C2C12 cells
2.3 缬氨酸促进C2C12细胞增殖
添加6种不同浓度缬氨酸(0、0.15、0.30、0.45、0.60及0.75 mmol·L-1),分别处理12、24、36和48 h,开展CCK8试验以检测细胞增殖情况。在缬氨酸处理细胞12 h时,各组间无显著差异(见图3A);至24 h时,0.45 mmol·L-1缬氨酸处理组较对照组出现显著差异(P<0.01),较0.15 mmol·L-1缬氨酸组(P<0.05)及0.75 mmol·L-1组(P<0.001)均出现显著差异(见图3B);至36 h时,与对照组相比,0.45 mmol·L-1缬氨酸处理组较其余各组均出现不同程度显著差异,且C2C12细胞增殖情况随缬氨酸浓度升高而升高,在0.45 mmol·L-1达到峰值后,随浓度进一步提高,促进作用逐渐降低,但0.75 mmol·L-1时未对细胞增殖产生抑制(见图3C);至48 h时,0.45 mmol·L-1缬氨酸处理组与0.60 mmol·L-1组相比无显著差异(P>0.05)(图3D)。因此,缬氨酸呈剂量依赖性影响C2C12细胞增殖,且最适浓度为0.45 mmol·L-1,最适处理时间为36 h。

图3 缬氨酸影响C2C12细胞增殖Fig.3 Effects of valine treatment on C2C12 cell proliferation
2.4 不同浓度棕榈酸促进SREBP-1c蛋白表达
棕榈酸单独处理C2C12后(终浓度分别为0、25、50、75及100 μmol·L-1),检测SREBP-1c蛋白表达情况。在75 μmol·L-1时,细胞中SREBP-1c蛋白表达量达到峰值(见图4A),相对于其他浓度均差异显著(P<0.05)(见图4B)。

图4 不同浓度棕榈酸对SREBP-1c的影响Fig.4 Effects of different concentrations of palmitic acid on SREBP-1c
2.5 添加棕榈酸后缬氨酸对C2C12细胞增殖的影响
先前试验结果表明,添加0.45mmol·L-1缬氨酸促进细胞增殖,通过CCK8试验验证加入棕榈酸是否对细胞增殖产生影响。由图5可知,棕榈酸可在一定程度上促进C2C12细胞增殖,增殖作用在50 μmol·L-1时达到最盛,75 μmol·L-1次之,但棕榈酸浓度增至100 μmol·L-1时,添加棕榈酸组OD值略低于仅添加0.45 mmol·L-1缬氨酸组,但仍略高于空白对照组,说明此时棕榈酸可能已开始抑制细胞增殖,但抑制作用低于0.45 mmol·L-1缬氨酸对C2C12细胞增殖的促进作用。
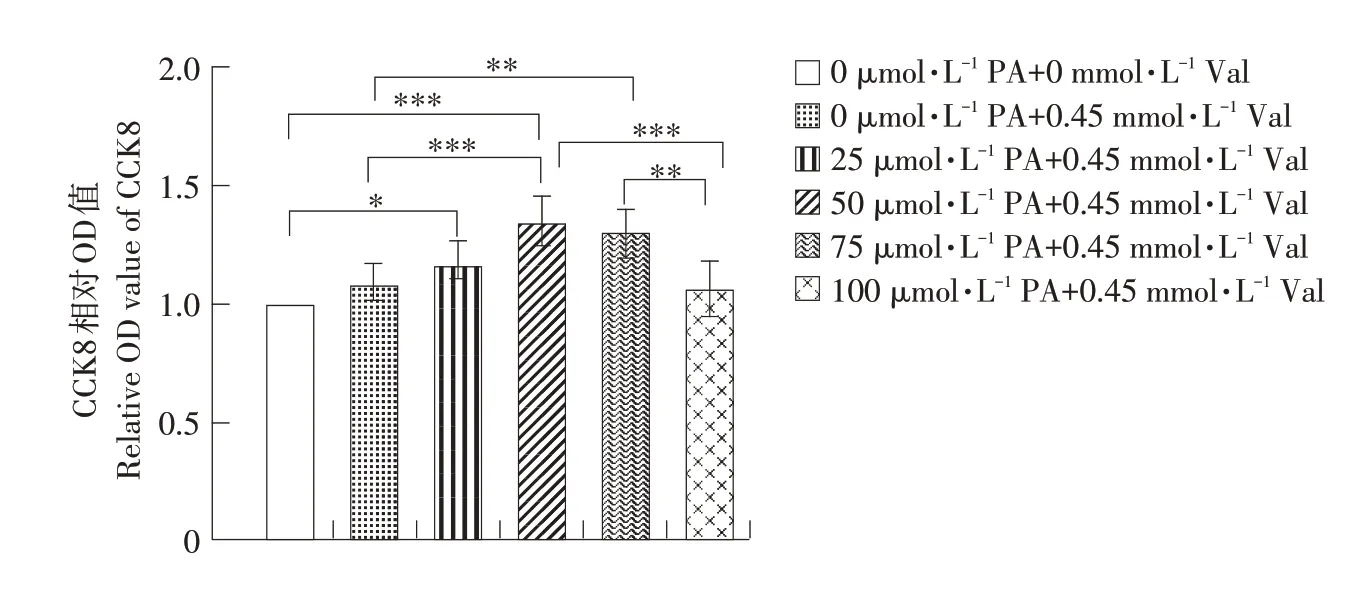
图5 添加棕榈酸后缬氨酸对C2C12细胞增殖的影响Fig.5 Effects of valine on C2C12 cell proliferation after adding PA
2.6 缬氨酸协同棕榈酸促进C2C12细胞脂肪沉积
为探究缬氨酸与棕榈酸同时处理C2C12细胞如何发挥作用,设置4个组别:对照(Control组);0.45 mmol·L-1缬氨酸(Valine组);75 μmol·L-1棕榈酸(PA组);0.45 mmol·L-1Val处理24 h后,添加75 μmol·L-1PA(Val+PA组)。油红O染色后,发现PA组较Control组细胞内脂滴明显增多,而Val+PA组脂滴沉积最多(图6A)。PA组较Control组,SREBP-1c蛋白表达显著上调,但是与Valine组无显著差异(图6B;图6C)。Val+PA组,同其他3组差异显著,表明缬氨酸和棕榈酸处理,可以协同促进C2C12细胞脂肪沉积。
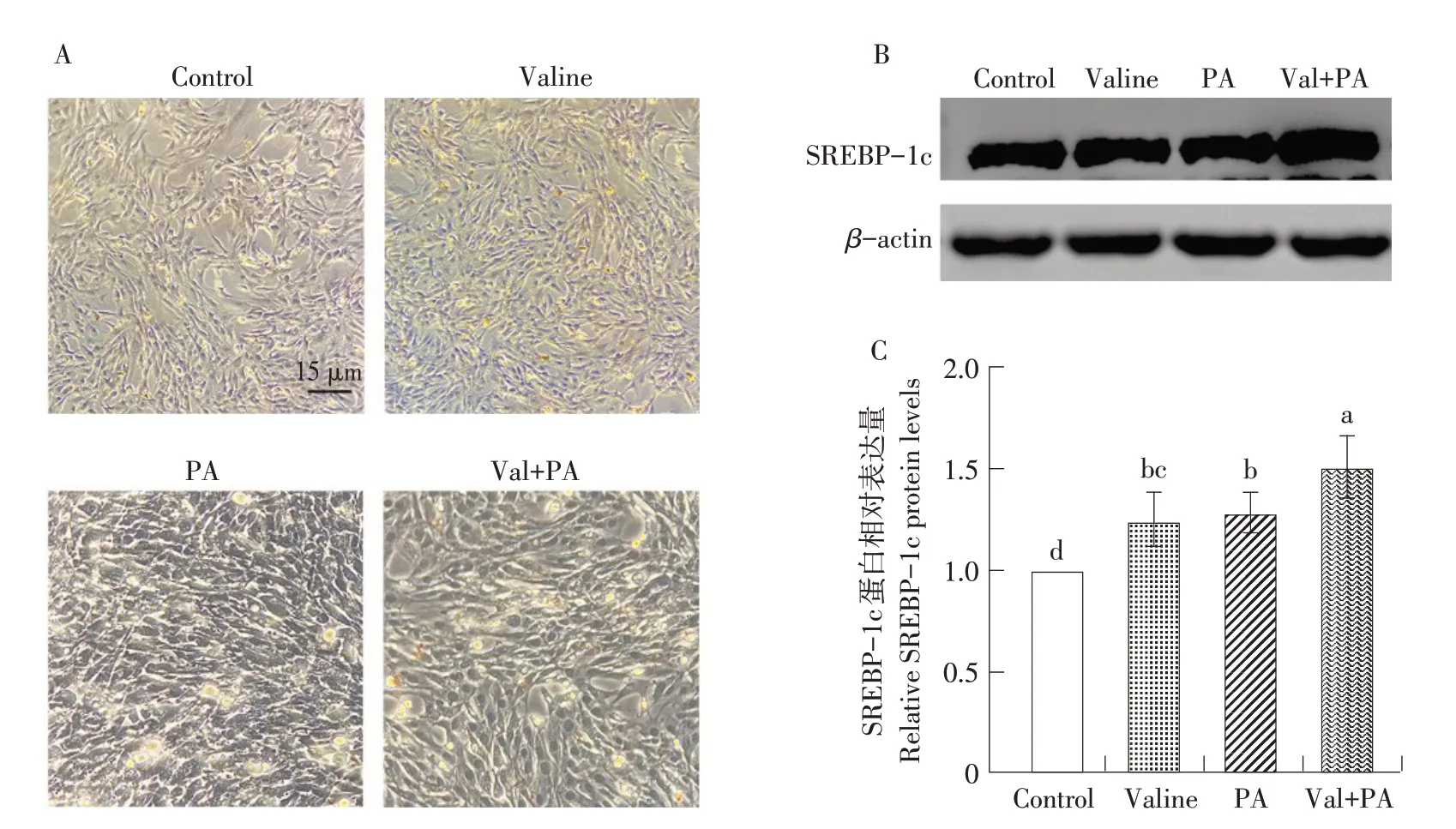
图6 缬氨酸协同棕榈酸促进C2C12脂肪沉积Fig.6 Synergistic effects of valine and palmitic acid on C2C12 lipid deposition
3 讨论
3.1 缬氨酸对C21C2细胞脂肪沉积和细胞增殖的影响
肌内脂肪是肉质一项重要指标,主要成分为磷脂与TGs。体外研究表明,过表达调控甘油三脂(TG)合成关键调节因子SREBP-1c,主要通过AKT磷酸化,激活mTOR/SREBP-1c信号通路促进山羊乳腺上皮细胞中脂肪酸从头合成及TG合成[17]。相反,如果抑制AKT/mTOR信号通路,则使脂肪沉积相关基因表达下调[18]。研究表明,支链氨基酸对细胞脂肪沉积具有调节作用。亮氨酸可增加肌管内脂质含量,当亮氨酸和棕榈酸酯协同处理细胞时,细胞代谢偏好发生改变[19]。异亮氨酸可通过肌肉生成和肌内脂质沉积共同增加肌肉质量[20]。妊娠母猪补充缬氨酸,可通过刺激AKT/mTOR/SREBP-1c信号途径,增加乳腺合成总乳脂、甘油三酯和多不饱和脂肪酸含量[21]。但缬氨酸是否使肌肉细胞内沉积脂滴及其作用机制未见报道。
研究显示,缬氨酸对C2C12细胞中SREBP-1c蛋白表达与成熟具有显著促进作用,但油红染色结果显示细胞内并未产生较多脂滴。缬氨酸分解代谢产物3-羟基异丁酸酯(3-HIB)可作为内皮细胞旁分泌因子刺激脂肪酸摄取[22],被认为与饮食诱导肥胖造成的胰岛素抵抗相关[23],是公认的2型糖尿病和胰岛素抵抗重要标志[24]。与亮氨酸和异亮氨酸降解产生CoA结合分解代谢物不同,3-HIB-CoA完全且仅由缬氨酸分解形成,被限速酶3-羟基异丁酰辅酶A水解酶(HIBCH)水解[25]。Lyon等研究表明,3-HIB从肌肉、心脏和前脂肪细胞释放[26],参与肌管中胰岛素信号传递[27]。在发育脂肪细胞中,3-HIB线粒体分解代谢是将由缬氨酸衍生的碳结合到从头合成脂肪酸中的关键步骤,3-HIB还可转化为葡萄糖[28]。因此,缬氨酸处理后C2C12细胞内脂滴沉积较少,可能因缺乏脂质沉积相关底物,将添加棕榈酸作为底物开展后续试验。
3.2 棕榈酸对C2C12细胞脂肪沉积和细胞增殖的影响
无脂肪酸存在时,0.45 mmol·L-1缬氨酸虽可刺激C2C12细胞中SREBP-1c蛋白表达与成熟,但在细胞内沉积的脂滴较少。Zhou等研究发现,在奶牛乳腺上皮细胞中,脂肪酸是激活SREBP-1c信号和甘油三酯合成必需物质[29]。
棕榈酸又名软脂酸,是脂肪生成过程中第一种脂肪酸,由软脂酸可继续生成更长脂肪酸。棕榈酸较油酸对HepG2细胞中SREBP-1c信号通路影响更大,显著增加细胞中甘油三脂合成与脂滴沉积[30]。但过量棕榈酸对细胞造成脂毒性,引起C2C12肌管萎缩[31]。
研究表明,50 μmol·L-1棕榈酸孵育C2C12肌管24 h可引起脂滴积聚并增加TG含量[32],但未见棕榈酸对C2C12细胞脂滴沉积影响的报道。本次试验通过SREBP-1c蛋白表达情况初步筛选棕榈酸浓度。结果表明,75 μmol·L-1棕榈酸孵育细胞12 h,可在不对细胞增殖造成抑制情况下,使SREBP-1c蛋白表达量显著上调,并在细胞内沉积脂滴。进一步试验结果表明,在同时添加0.45 mmol·L-1缬氨酸和75 μmol·L-1棕榈酸条件下,C2C12细胞中SREBP-1c蛋白表达量显著高于其他组;油红染色结果表明,细胞内可沉积较多脂滴。说明在脂肪酸存在情况下,缬氨酸对C2C12细胞中脂肪沉积的促进效应显著。但缬氨酸促进脂肪酸转运还是甘油三酯合成,亦或二者均受调控仍有待进一步研究。
4 结论
研究揭示缬氨酸剂量依赖性促进C2C12细胞SREBP-1c蛋白成熟与表达,且呈剂量依赖性方式促进细胞增殖。研究表明,缬氨酸在棕榈酸存在时,促进C2C12细胞内脂质蓄积,为缬氨酸作为饲料添加剂提高畜禽肉质水平提供理论依据。

