三株香猪源多杀性巴氏杆菌的分离与鉴定
张瑞华,高善颂,李焕发,张丹萍,窦心怡,韩先杰
(青岛农业大学动物医学院,山东 青岛 266109)
猪巴氏杆菌病又被称为猪肺疫[1],在辽宁、青海、四川、上海、湖南、湖北等地常有发生,给我国生猪养殖业造成了重大的经济损失。在对该病的诊断治疗和防控过程中,猪源多杀性巴氏杆菌的分离鉴定和血清型鉴定是不可或缺的一部分。多杀性巴氏杆菌通常存在于各种动物的口腔和咽部粘膜中,当各种原因引起动物应激反应或者导致动物机体抵抗力降低时,该菌会迅速生长繁殖引起动物患病,并发生内源性感染[2],还可与猪传染性胸膜肺炎、猪伪狂犬病、猪喘气病、猪链球菌病等发生继发感染或混合感染[3]。
2019年1月某规模化香猪场有5头病死小香猪送检,为确定病原并为其用药提供参考,本研究从送检病例中分离到3株细菌,经鉴定均为A型多杀性巴氏杆菌,并对其进行了药物敏感性试验等。
1 材料与方法
1.1 试验材料
1.1.1 细菌来源 采集于青岛某猪场病死香猪的肺脏。
1.1.2 主要试剂 PCR试剂等购自青岛紫恩生物科技有限公司;药敏纸片购自青岛科盛源科技发展有限公司;脑心浸液肉汤培养基、绵羊血琼脂培养基、生化试剂等购自北京索莱宝科技有限公司。
1.2 试验方法
1.2.1 细菌的分离及形态观察 将病死猪肺脏置于超净工作台中,使用无菌接种环蘸取细支气管中分泌物,划线接种于绵羊血琼脂培养基上,至恒温培养箱中培养16~18 h,观察生长情况。培养结束后挑取单个菌落至载玻片上,对其进行革兰氏染色并使用油镜观察细菌形态。
1.2.2 生化试验 挑取分离菌接种到脑心浸液肉汤培养基中增殖培养,取培养完成的菌液离心洗涤后接种到细菌微量发酵管中,37℃恒温箱中培养16~22 h,培养完成后查看并记录生化反应结果。
1.2.3 16S rRNA基因的扩增 使用煮沸法提取细菌DNA,用于扩增细菌16S rRNA基因序列的通用引物[4]见表1,由青岛派森诺基因生物技术有限公司合成。PCR扩增体系(25μL):2×TaqMaster Mix 12.5μL,上下游引物各1.5μL,DNA模板2.5μL,去离子水7.0μL。PCR扩增程序:95℃预变性1 min;95℃变性15 s,53℃退火15 s,72℃延伸2 min,共34个循环;72℃延伸7 min;10℃终止反应。

表1 扩增16S rRNA基因通用引物序列
1.2.4 PCR产物测序 由青岛派森诺基因科技有限公司对PCR扩增产物进行测序。利用NCBI的BLAST工具进行序列的同源性比对,利用MEGA 6软件进行进化分析。
1.2.5 细菌血清型鉴定 5对鉴定血清型的引物序列[5]见表2。PCR扩增体系(25μL):上下游引物各1.0μL,DNA模板2.0μL,2×TaqMaster Mix 12.5μL,灭菌去离子水8.5μL。PCR扩增程序:94℃预变性3 min;94℃变性15 s,56℃退火15 s,72℃延伸75 s,共32个循环;72℃延伸7 min;4℃结束反应并保存。

表2 鉴定血清型的引物序列
1.2.6 动物试验 挑取单菌落接种到脑心浸液肉汤培养基中,封上封口膜后放入37℃恒温振荡培养箱中培养16~22 h,并计算活菌数。设置浓度分别为104、105、106cfu/mL攻毒组和对照组,每处理随机选取8只健康小白鼠,对照组不做任何处理,攻毒组腹腔注射菌液均为0.3 mL。连续3 d观察死亡情况,采用改良寇氏法计算LD50值。
1.2.7 药敏试验 药敏试验根据Kirby-Bauer法进行,按照相关标准[6]和青岛科盛源科技发展有限公司提供的纸片法药敏试验指导进行药物敏感性判定。
2 结果与分析
2.1 细菌分离与形态观察
从肺脏中共分离出3株菌,在绵羊血琼脂培养基上经过37℃培养24 h,菌落呈灰白色、湿润、半透明的露珠状,不溶血(图1)。革兰氏染色呈阴性,形态为两端钝圆的短杆菌(图2)。将本试验分离菌分别命名为SD-PM07、SD-PM08和SD-PM09。
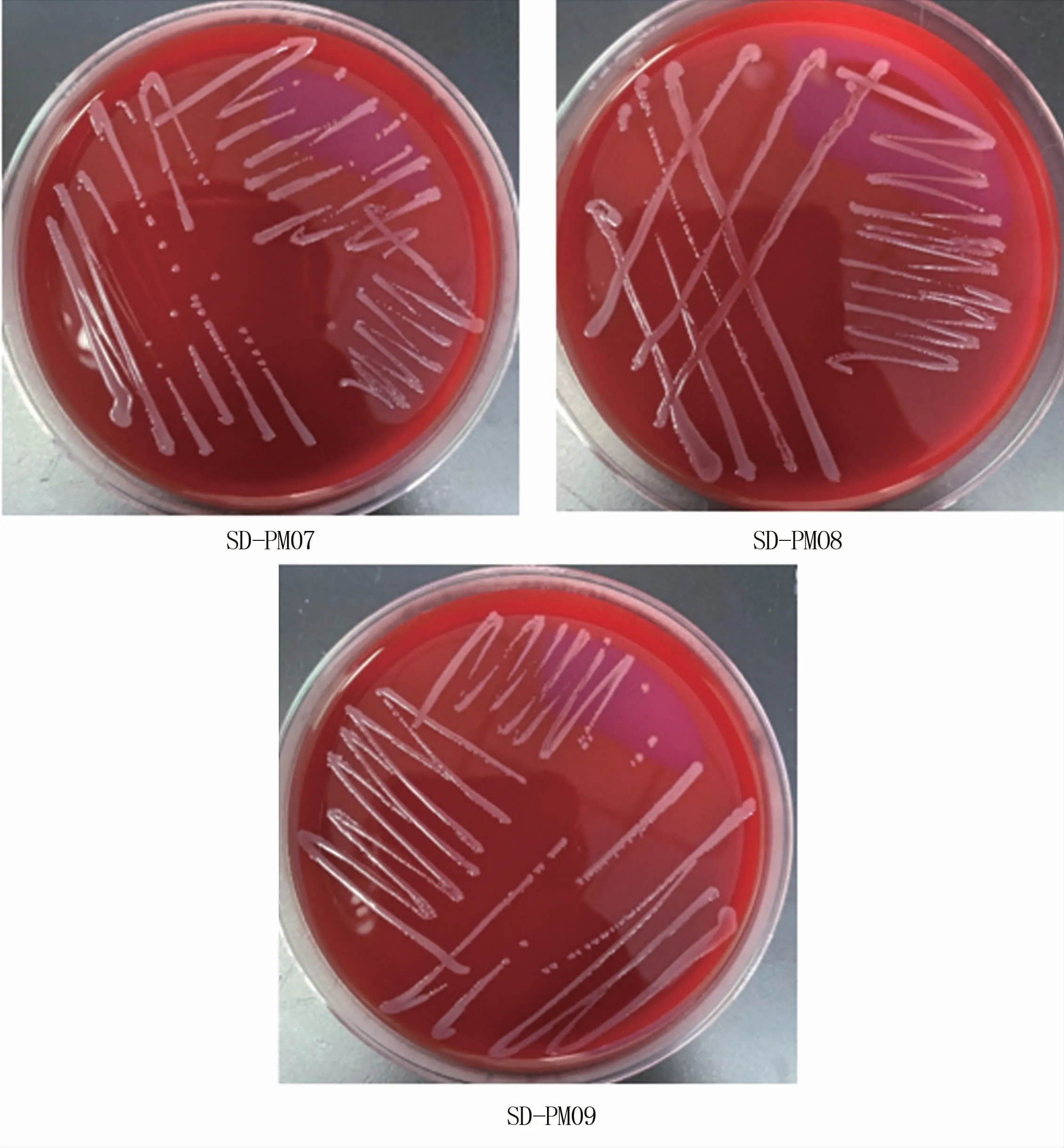
图1 绵羊血琼脂培养基上分离菌菌落
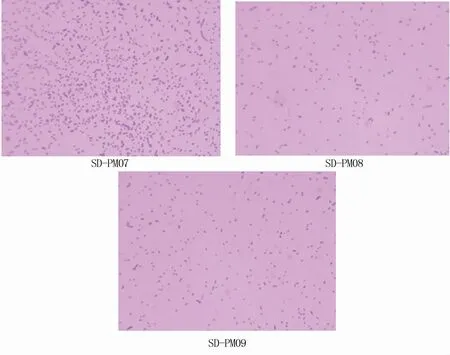
图2 分离菌菌体形态(1 000×)
2.2 生化试验结果
分离菌SD-PM07、SD-PM08、SD-PM09的生化试验结果一致(表3),与巴氏杆菌的生化特征相符[7]。

表3 生化试验结果
2.3 细菌16S rRNA基因的扩增
扩增结果(图3)显示,3株分离菌均扩增出大小约为1 500 bp的目的DNA,与预期大小相符。
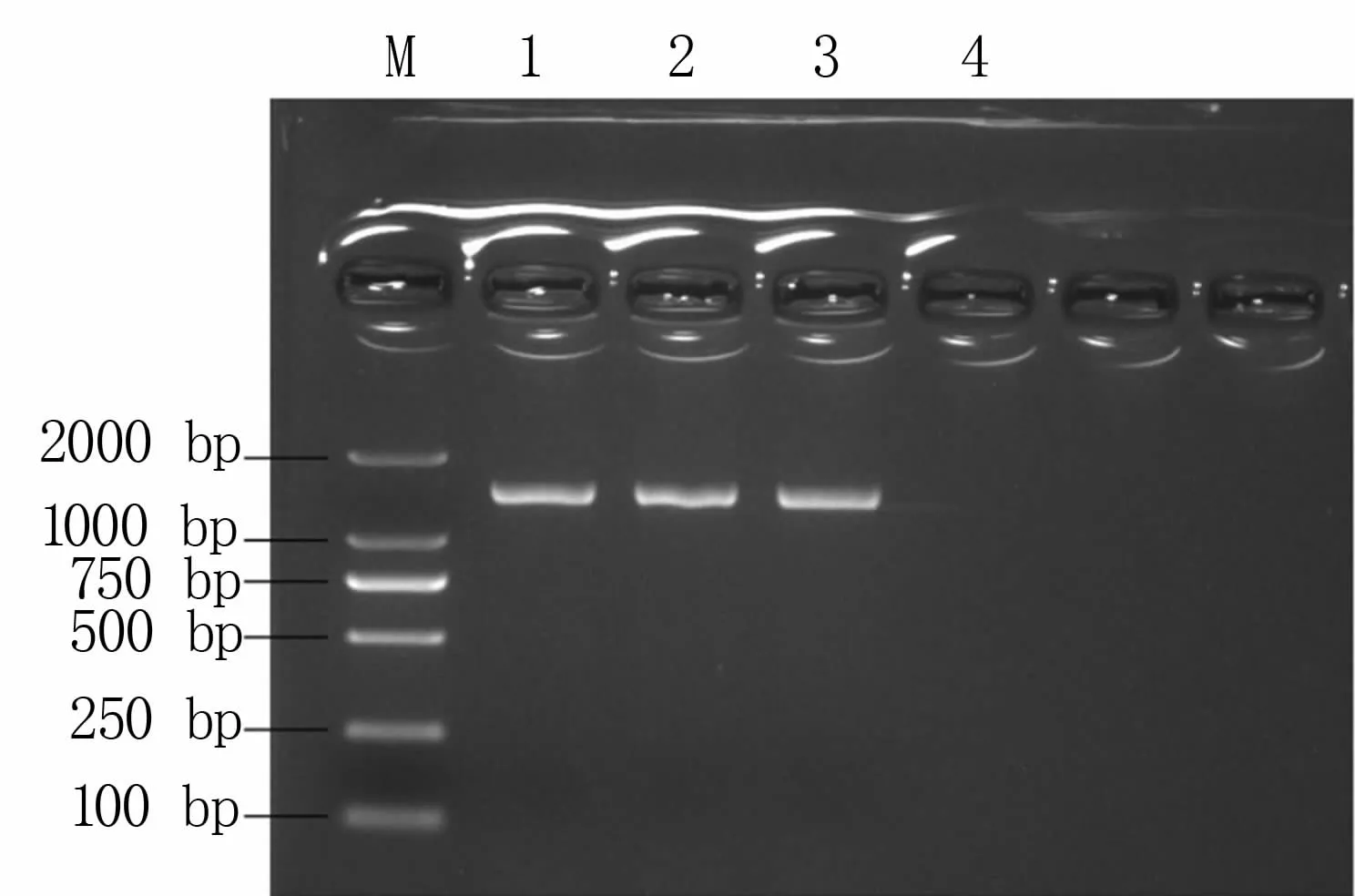
图3 分离菌16S rRNA基因扩增结果
2.4 基因测序分析
同源性比对结果显示,分离菌与多杀性巴氏杆菌(GenBank序列号CP048402)同源性为99.9%,结合形态观察和生化试验结果,可确定分离菌株为多杀性巴氏杆菌。由序列进化树(图4)可知,3株分离菌单独处在小的分支上,其遗传进化来源还需进一步研究。

图4 分离菌株基于16S rRNA基因序列的进化树分析
2.5 血清型鉴定
荚膜血清型鉴定结果(图5)表明,3株分离菌均是A型血清型。
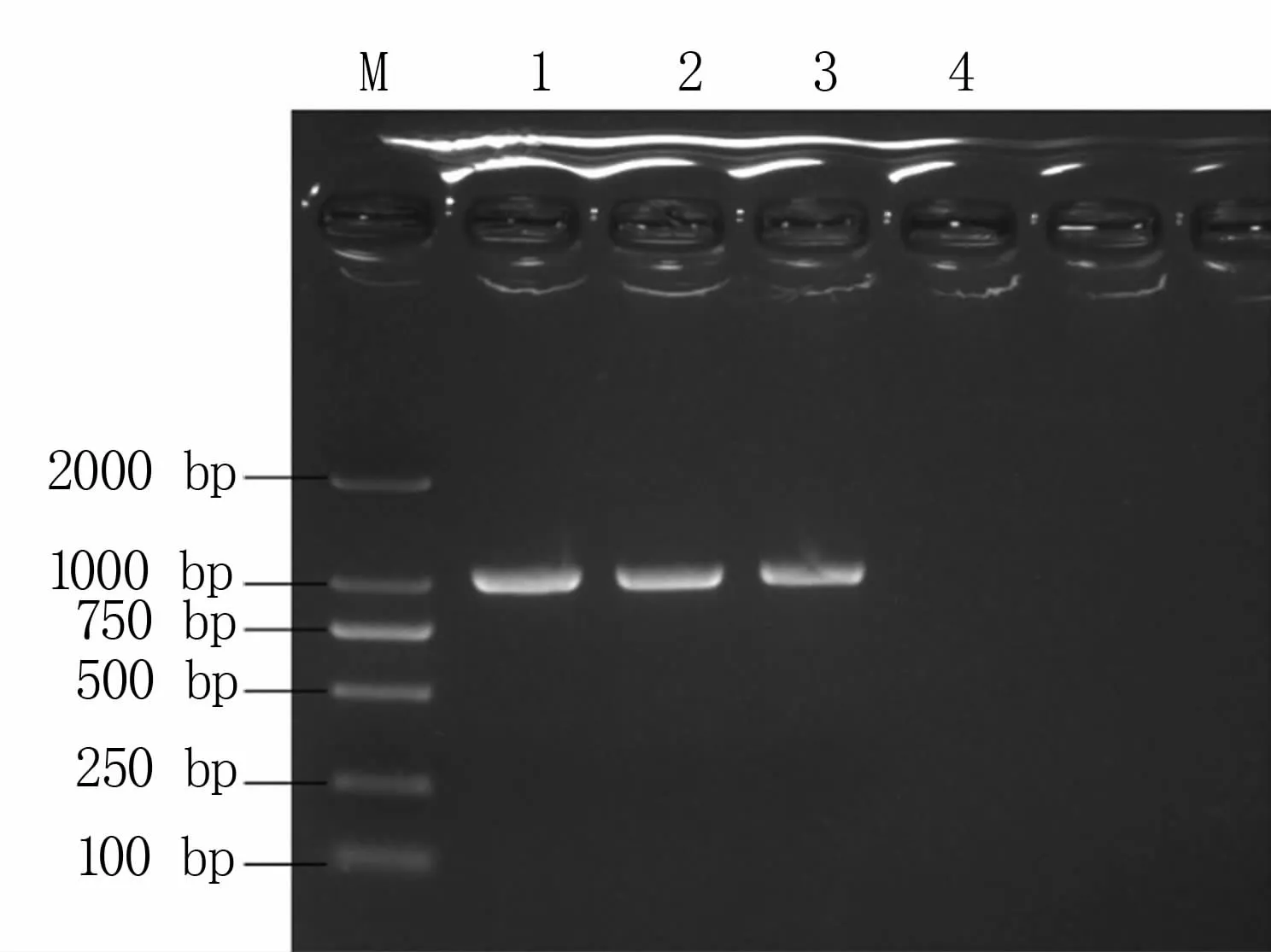
图5 分离菌株荚膜血清型鉴定
2.6 致病性试验结果
本试验分离菌株的LD50为1.8×105cfu/mL。对死亡小鼠进行病理解剖发现其肝肿大、有坏死点,肺充血、有出血点,小肠壁薄、有出血点,大肠壁上有出血点。切取部分发病组织进行涂片,革兰氏染色后使用油镜观察,视野中呈现大量革兰氏阴性短杆菌。
2.7 药敏试验结果
药敏试验结果(表4)表明,分离菌对头孢他啶、庆大霉素、头孢哌酮、链霉素、左氧氟沙星、卡那霉素、头孢曲松、哌拉西林、氨芐西林、头孢噻肟敏感;对强力霉素中度敏感;对氧氟沙星耐药。
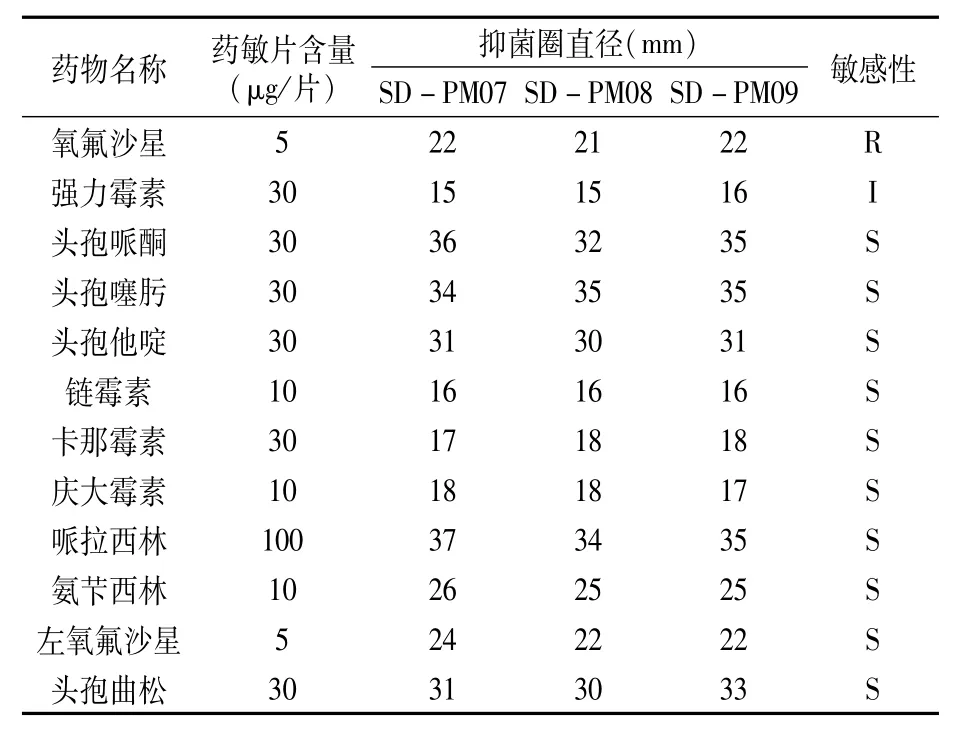
表4 分离菌药物敏感试验结果
3 讨论与结论
经生化试验、16S rRNA基因序列分析及血清型鉴定,3株分离菌均为多杀性巴氏杆菌A型。药敏试验结果显示,分离菌株主要对β内酰胺类抗生素敏感。
经分析,该猪场主要由于饲养环境差导致细菌感染。猪多杀性巴氏杆菌可通过猪饲料、饮水以及空气等进入机体进行感染[8];饲养管理不当、环境卫生差导致动物机体抵抗力下降,从而更容易使病原菌侵入动物血液引发感染、死亡。因此,日常需要加强饲养管理,做好圈舍卫生以及消毒工作等,以防止病原体入侵。

