粪菌移植结合噬菌体抵抗雏鸡沙门氏菌感染的作用
王曦,任金瑞,朱见深,李均同,吴香菊,戴美学,丛晓燕,侯云峰,吕强华,刘玉庆,杜以军,齐静
(1.山东师范大学生命科学学院,山东 济南 250014;2.山东省农业科学院畜牧兽医研究所/山东省畜禽疾病防治与繁育重点实验室,山东 济南 250100;3.山东金铸基药业有限公司,山东 济南 271100)
肠炎沙门氏菌是养鸡产业中一种重要致病菌,可引起早期雏鸡大量死亡,在30日龄以后转为隐性携带而难以致死,但伴随着持续性排菌,对养殖业造成巨大的经济损失[1,2]。抗生素是养殖企业防治沙门氏菌的常用手段,但是抗生素的滥用导致大量耐药菌的出现,严重威胁公共卫生安全[3,4]。随着《全国遏制动物源细菌耐药行动计划(2017—2020年)》的出台,一些具有减抗或降抗潜力的技术快速发展,如粪菌移植(fecalmicrobiota transplantation)和噬菌体(phage)疗法。
粪菌移植是将健康供体肠道中的功能菌群移植给患病受体,帮助患病受体重新建立肠道菌群结构,从而达到治疗疾病、促进受体健康的目的[5]。已有研究表明粪菌移植可用于治疗肠道相关疾病,清除大部分抗药性机会致病菌(如人的复发性艰难梭菌感染和溃疡性结肠炎)[6];促进宿主健康并提高其抗病能力[7]。其中健康安全的供体是粪菌移植中一个重要的基础和前提[8]。
噬菌体是一种特异性侵染细菌并利用宿主的代谢机制进行复制的病毒,且不会对宿主动物体内的正常微生物群产生负面影响[9]。因此,噬菌体疗法在治疗动物致病菌感染方面具有较大优势[10]。本实验室前期研究发现,使用噬菌体疗法可以有效降低沙门氏菌感染导致的试验鸡的死亡率[11]。
有研究表明,将噬菌体与益生菌联合使用比各自单独应用能够更有效地减少雏鸡中的沙门氏菌[12]。健康成年个体的肠道菌群亦可以作为益生菌加以利用[13,14]。成年SPF鸡的肠道菌群安全、敏感,以其作为供体进行粪菌移植可以降低受体雏鸡中大肠杆菌的抗药性水平[15]。但是由于SPF鸡生活在封闭隔离的环境中,导致其肠道菌群较为单一,且利用SPF鸡的粪菌移植在抵抗病原菌入侵方面的研究较少[16-18],因此本试验采用粪菌移植与噬菌体结合疗法,研究其对感染沙门氏菌的SPF雏鸡的治疗效果。其核心是:①给予幼龄动物健康成年动物的肠道菌群,使幼龄动物提前具备一定抵抗病原菌入侵的能力;②当幼龄动物感染致病菌时,再使用噬菌体疗法来配合治疗。本研究旨在评估粪菌移植与噬菌体结合疗法的安全性与应用潜力。
1 材料与方法
1.1 试验动物及分组
试验动物来自山东省农业科学院家禽研究所SPF鸡胚场,供体动物为208日龄SPF成年鸡2只,受体动物为1日龄SPF雏鸡160只,随机分为4组,每组40只。Ca组:每只鸡在1日龄时口服0.1 mL PBS缓冲液;在3日龄时口服0.1 mL肠炎沙门氏菌液,约6.2×108cfu。Cb组:每只鸡在1日龄和3日龄时口服0.1 mL PBS缓冲液。FPa组:每只鸡在1日龄时口服0.1 mL粪菌移植液;3日龄时,每只鸡口服6.2×108cfu肠炎沙门氏菌液;攻毒2 h后,口服0.1 mL噬菌体混合液,约1.38×108pfu;8日龄时,每只鸡再次口服等量的噬菌体混合液。FPb组:每只鸡在1日龄时口服0.1 mL粪菌移植液;3日龄时,每只鸡口服0.1 mL PBS缓冲液;2 h后,口服0.1 mL噬菌体混合液,约1.38×108pfu;8日龄时,每只鸡再次口服等量的噬菌体混合液。接受粪菌移植与噬菌体的组统称为FP组;未接受粪菌移植与噬菌体的组统称为C组;攻毒的组统称为a组;未攻毒的组统称为b组。各组分别在隔离器内隔离饲养至40日龄,正常饲喂雏鸡饲料和饮水。
1.2 粪菌移植菌液的制备
无菌采集两只成年SPF鸡的新鲜盲肠内容物放入50 mL无菌离心管中,以1∶10(g/mL)的比例与无菌PBS缓冲液(内含10%的甘油)混合,振荡均匀,1 800 r/min离心10 min,将离心后所得悬液经灭菌三层滤布(纱布、0.2 mm滤布、0.1 mm滤布)过滤,最终获得均一、棕色的粪菌移植供体菌液,直接用于粪菌移植;或置于-80℃冻存,使用之前在冰水浴中提前2~4 h融化,可用于粪菌移植操作。
1.3 肠炎沙门氏菌的制备
将实验室保存的肠炎沙门氏菌(ATCC 13076)解冻,用接种环蘸取一环在LB固体培养基上划线后置于恒温培养箱中,37℃培养24 h,获得沙门氏菌单菌落。挑取单菌落置于装有100 mL LB液体培养基的500 mL锥形瓶中,37℃、180 r/min振荡培养8 h左右,离心后弃上清,使用无菌PBS缓冲液洗涤2次,分光光度计初测OD600值,适当稀释使OD600在1.0左右,菌液浓度约为109cfu/mL。随后用PBS缓冲液进行倍比稀释,利用微量平板稀释法[19]精确计算攻毒菌液的实际剂量为每只鸡6.2×108cfu。
1.4 噬菌体的制备及效价测定
选择实验室分离保存的两株沙门氏菌噬菌体(编号为2-2G和3G),参照文献[20]中的方法进行活化富集,利用双层平板法测得2-2G的效价为8.6×108pfu/mL,3G的效价为9.52×109pfu/mL。吸取等量的两种噬菌体液置于同一个离心管中振荡混匀后,检测其混合效价为1.38×109pfu/mL。
1.5 生存曲线及体重测定
每天观察并记录试验鸡的生存状况,绘制生存曲线。在第11、19、40日龄时每组随机选择4只鸡,称量体重,记录体重的变化情况。
1.6 指标检测
将第11、19、40日龄每组随机采集的4只SPF鸡经颈动脉放血致死,收集血液,分离血清,并无菌剖检,采集空肠和肝脏组织,分别进行如下指标的检测。
1.6.1 细胞因子检测 将收集的血液在4℃冰箱静置24 h,4 000 r/min离心8 min,收集血清,-20℃保存。使用江苏晶美生物科技有限公司生产的鸡白细胞介素1β(IL-1β)、鸡白细胞介素18(IL-18)和鸡γ干扰素(IFN-γ)ELISA试剂盒检测3个日龄各组SPF鸡血清中3种细胞因子的变化,具体步骤按照试剂盒说明书进行。
1.6.2 肠道绒毛长度、隐窝深度以及肝脏病理变化 将收集的空肠(邻近回肠的部分,约1 cm)和肝脏组织(每只鸡无菌取指甲大小2片)分别放入盛有1 mL多聚甲醛的离心管中进行固定,送武汉赛维尔生物科技有限公司进行病理切片的制备,检测3个日龄各组SPF鸡的肠道绒毛长度和隐窝深度,并描述肝脏的病理变化。
1.6.3 肝脏组织中沙门氏菌的定性检测 在40日龄,各组无菌采集步骤1.6中2只SPF鸡的肝脏组织,利用DNA提取试剂盒(BioFlux)提取肝脏组织中总DNA,用PCR方法对各组肝脏组织中沙门氏菌进行定性检测。用于鉴定沙门氏菌的目的基因为FimW基因,引物序列[21]如表1所示,由生工生物(上海)工程股份有限公司合成。

表1 扩增肠炎沙门氏菌FimW基因的PCR引物序列
PCR扩增体系(16μL):2×TaqPCR Master-Mix缓冲液8μL,上游与下游引物各1μL,无菌去离子水4μL,DNA模板2μL。PCR反应程序:95℃预变性3 min;95℃变性30 s,56℃退火30 s,72℃延伸30 s,共35个循环;72℃延伸10 min。PCR产物经1.5%的琼脂糖凝胶电泳进行检测并测序,分析沙门氏菌在肝脏中的定殖情况。
1.7 数据处理与分析
采用软件GraphPad Prism 7.0绘制生存曲线,利用Mann-Whitney检验进行差异显著性分析。
2 结果与分析
2.1 生存曲线与体重变化
3日龄进行肠炎沙门氏菌攻毒之后,Ca组在5日龄至13日龄共死亡13只,30日龄时死亡1只,之后无死亡现象,除去试验期间处死的12只,最后Ca组剩余14只存活;其他3组均无死亡现象(图1A)。总体来看,Ca组受沙门氏菌攻毒的影响较大,体重较其他组更低。在11日龄和19日龄,FPb组体重显著高于C组(P<0.05);40日龄时,FP组与Cb组的体重无显著差异(P>0.05),但三者体重均显著高于Ca组(P<0.05)(图1B)。
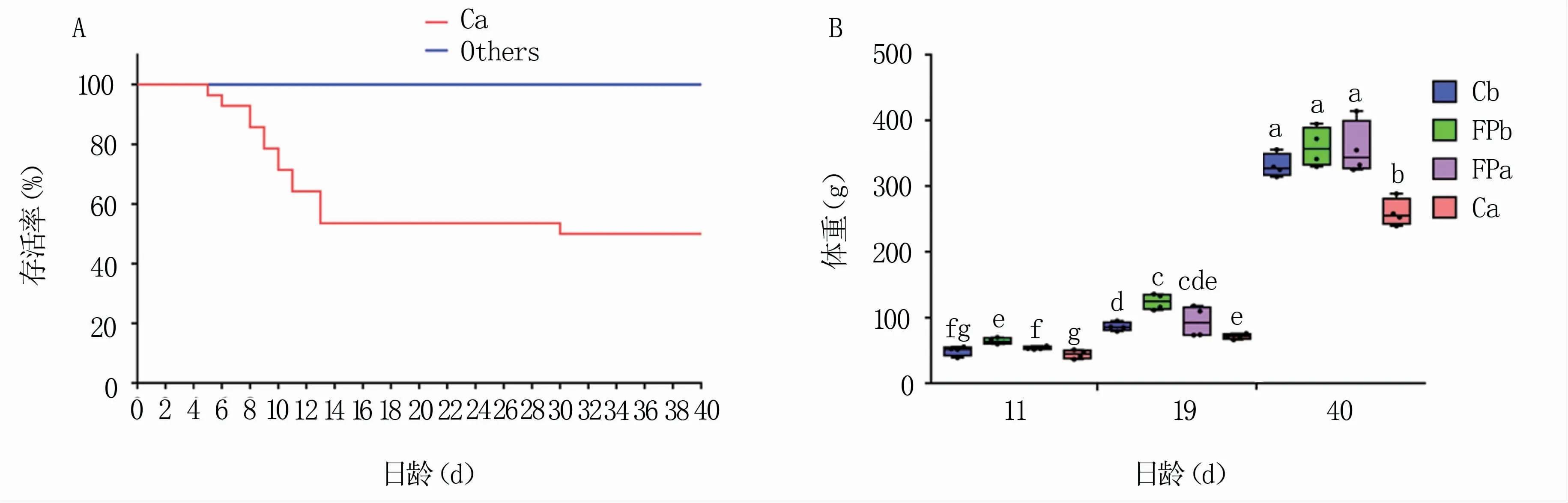
图1 各组SPF鸡的生存曲线与体重变化
2.2 血清细胞因子变化
在11日龄和40日龄,Ca组SPF鸡血清中的IFN-γ浓度显著高于其他3组(P<0.05),且FP组与Cb组无显著差异(P>0.05);只有Ca组血清中IFN-γ浓度随着日龄的增加而显著增加(P<0.05),其他3组随着日龄的增加无显著变化(P>0.05,图2A)。11日龄至40日龄,Ca组的IL-1β浓度显著高于b组(P<0.05),FPa组与Ca组无显著差异(P>0.05);各组血清中IL-1β的浓度随着日龄的推移无显著变化(P>0.05,图2B)。11日龄和19日龄,Ca组中IL-18的浓度显著高于Cb组(P<0.05),b组间无显著差异(P>0.05),40日龄时各组中IL-18的浓度无显著差异(P>0.05);Ca组IL-18浓度随日龄推移而显著下降(P<0.05),其他3组IL-18浓度随着日龄推移无显著变化(P>0.05,图2C)。

图2 3个日龄3种细胞因子的比较
2.3 肝脏病理变化分析
Cb组和FPb组的肝脏组织切片中未观察到明显的病变(图3A-F)。FPa组只在11日龄局部可见淋巴细胞灶性浸润(黑色箭头,图3G),19日龄和40日龄时没有观察到病变(图3H、I)。在11、19、40日龄时,Ca组的肝脏组织中均可见明显的淋巴细胞灶性浸润(黑色箭头,图3J-L)。

图3 各组SPF鸡肝脏病理切片(200×)
2.4 肝脏中沙门氏菌的定殖检测
PCR扩增结果(图4)表明,只有Ca组出现了目的条带,且测序结果与目的条带大小一致,说明在40日龄时,除Ca组外,其它3组肝脏中均没有肠炎沙门氏菌的定殖。
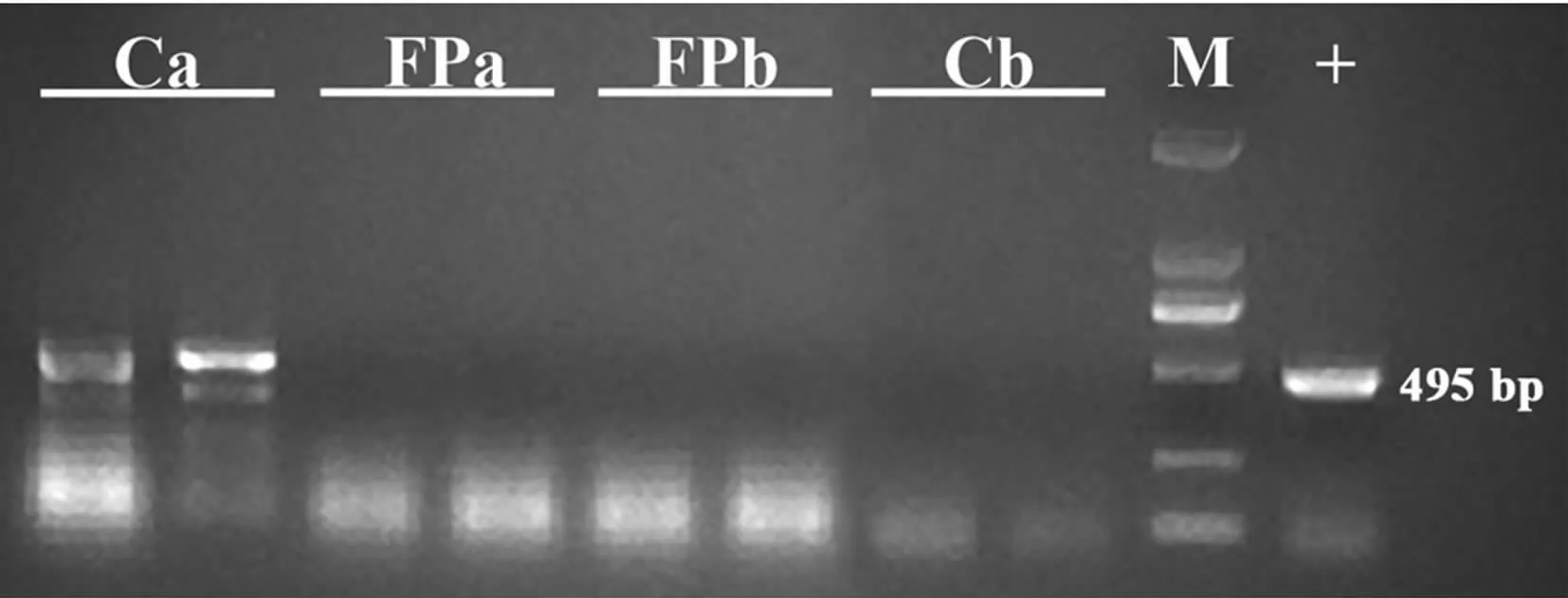
图4 40日龄各组SPF鸡肝脏中沙门氏菌的定性检测
2.5 肠道绒毛长度与隐窝深度分析
在3个日龄中,C组间的肠道绒毛长度始终无显著差异(P>0.05),FP组间的肠道绒毛长度也无显著差异(P>0.05)。11日龄时,各组间的肠道绒毛长度无显著差异(P>0.05);19日龄和40日龄时,FP组的肠道绒毛长度均显著高于C组(P<0.05)。FP组的肠道绒毛长度随着日龄的增加而显著增加(P<0.05),而C组的肠道绒毛长度随着日龄的增加无显著变化(P>0.05,图5A)。随着日龄的推移,Ca组的隐窝深度逐渐高于Cb组(P<0.05),各组的隐窝深度随着日龄的增加而降低(图5B)。各组肠道绒毛长度与隐窝深度的比值(V/C)如图5C所示,在11日龄,各组间的V/C值无显著差异(P>0.05);在19日龄,Cb组和FP组间的V/C值无显著差异(P>0.05),且都显著高于Ca组(P<0.05);40日龄,FP组的V/C值显著高于Ca组(P<0.05),Cb组的V/C值与其他3组均无显著差异(P>0.05)。各组V/C值均随着日龄的增加而增加。

图5 3个日龄下的肠道绒毛长度与隐窝深度
3 讨论
从各组受体动物表现上来看,粪菌移植与噬菌体的结合疗法有效降低了感染沙门氏菌的雏鸡死亡。11日龄和19日龄时,FPb组的体重显著高于C组(P<0.05),表明粪菌移植与噬菌体的结合疗法对SPF雏鸡的生长起到了促进作用。40日龄时,FP组与Cb组的体重无显著差异(P<0.05),且都显著高于Ca组(P<0.05),3个日龄Ca组的体重始终低于其他组。这表明肠炎沙门氏菌感染导致了SPF雏鸡生长速率变慢,而粪菌移植与噬菌体结合疗法使感染肠炎沙门氏菌的雏鸡体重恢复到正常水平。
肠炎沙门氏菌入侵会刺激机体中促炎因子与趋化因子分泌的增加,如:IL-1β、IL-18和IFN-γ等[22]。本研究中,肠炎沙门氏菌的入侵促进了动物体内IFN-γ、IL-1β和IL-18的释放。3个日龄中,b组间3种细胞因子的浓度基本无显著性差异(P>0.05),说明粪菌移植与噬菌体的结合治疗并没有引起SPF鸡全身的炎症反应。11日龄和40日龄,FPa组IFN-γ的浓度显著低于Ca组(P<0.05);11日龄至40日龄,FPa组中IL-1β的浓度与Ca组无显著性差异(P>0.05);11日龄,FPa组中IL-18的浓度显著低于Ca组(P<0.05),19日龄至40日龄,Ca组IL-18的浓度下降,与FPa组无显著性差异(P>0.05)。这可能是因为粪菌移植与噬菌体的结合疗法对SPF雏鸡的免疫能力起到了一定增强作用。
沙门氏菌的感染不限于肠道,它们能够存在于巨噬细胞丰富的肝脏中[23],并引起肝脏组织损伤,导致炎症反应与灶性病变[24]。本研究中Ca组3个日龄的肝脏均出现了炎性病变,FPa组只在11日龄发现炎性病变,说明粪菌移植与噬菌体的结合疗法减少了沙门氏菌导致的雏鸡肝脏的炎性病变。
通过收集雏鸡肝脏样品进行检测是沙门氏菌感染的常规诊断方法之一[25]。通过对各组SPF鸡40日龄的肝脏进行DNA提取和PCR反应,发现只有在Ca组中检出沙门氏菌特有的FimW基因。这表明粪菌移植与噬菌体的结合疗法清除了肠炎沙门氏菌在肝脏中的定殖,起到了抵抗肠炎沙门氏菌感染的作用。
肠道绒毛长度、隐窝深度和绒毛长度与隐窝深度的比值可用来比较各组SPF鸡的消化吸收能力[26]。本研究中FP组的肠道绒毛长度及其与隐窝深度的比值均随着日龄的推移显著高于Ca组(P<0.05);与其他3组相比,Ca组的隐窝深度在3个日龄均处于最高水平。这表明肠炎沙门氏菌的感染抑制了SPF雏鸡肠道绒毛的生长以及导致隐窝深度增高,而粪菌移植与噬菌体的结合疗法不仅改善了感染沙门氏菌的雏鸡肠道绒毛的发育情况,还能促进正常雏鸡肠道绒毛的生长,增强了雏鸡消化吸收能力。
4 结论
本研究表明粪菌移植与噬菌体的结合疗法在一定程度上提高了雏鸡的免疫水平,减少了因感染沙门氏菌导致的雏鸡肝脏的炎性病变,清除了沙门氏菌在肝脏中的定殖,增强了雏鸡的消化吸收能力,降低了死亡率,促进了体重增长,保护了雏鸡度过幼龄虚弱期,是减少抗生素使用的可行途径,为粪菌移植与噬菌体的结合疗法在抵抗动物病原菌的感染方面提供了参考依据。

