低管电压联合模型迭代重建技术在胃癌CT增强中的应用价值
张 磊,袁玉山,马培旗,彭 彬,胡献阔,王震寰
胃癌是发病率位于当今全球第五的恶性肿瘤,其发病率和病死率均较高,目前主要采用以手术治疗为主的综合治疗,而术前准确的影像学分期对病人诊疗和预后至关重要[1]。研究[2]表明,CT在胃癌术前受累情况评估和术后随访方面优势明显,但病人反复接受检查所面临的辐射剂量是亟需解决的问题。模型迭代重建技术(iterative model reconstruction,IMR)是一种可以优化图像质量、降低辐射剂量的新型迭代重建技术[3]。本研究旨在探讨采取低管电压联合IMR在胃癌CT增强中的应用价值。现作报道。
1 资料与方法
1.1 一般资料 收集2018年6月至2020年6月于我院胃肠外科住院治疗并行CT增强检查的胃癌病人,最终纳入54例。其中采用低剂量联合IMR重建扫描26例作为观察组(见图1),采用常规CT增强滤波反投影(filtered back projection,FBP)重建28例作为对照组(见图2)。纳入标准:(1)所有病人均行外科手术切除并做病理;(2)CT平扫加增强资料完整。排除标准:(1)临床或影像学资料不完整;(2)行CT扫描时胃腔充盈不佳,无法行术前CT评分;(3)术前接受其他治疗的胃癌病人。其中观察组男21例,女5例,年龄44~85岁;对照组男21例,女7例,年龄46~89岁。以最新TNM分期标准作为胃癌分期参照标准[4]。
1.2 检查方法 所有病人腹部CT平扫和增强检查均在Philips Brilliance iCT 256层CT机上完成。病人检查前禁食4~6 h以上,检查前饮水500~1 000 mL充盈胃腔。造影剂为碘克沙醇(80 mL),经肘正中静脉注入,流速为3 mL/s。动态增强扫描包括动脉期、门静脉期和延迟期,分别于注射对比剂后延迟30、60、90 s进行。
观察组管电压为100 kV,对照组管电压为120 kV,为保证图像质量,每组病人扫描时均固定噪声比,管电流则根据病人体质量不同变化。2组其余扫描参数均一致:准直器宽度128×0.625 mm,重组层厚3 mm,间隔1.5 mm,螺距0.899,X管旋转速度0.75秒/圈,矩阵512×512,视野350 mm。
1.3 图像分析与评价 所有图像均在Philips Portal工作站上进行评价。图像质量客观评价由1名从事腹部影像诊断的副主任医师进行,且不告知图像具体重建方法。选取同一胃癌病灶层面,在胃癌病灶上取3个感兴趣区(region of interesting,ROI),且同层面皮下脂肪及竖脊肌勾画ROI,所有ROI面积均为50 mm2,记录CT值及标准差,取3个ROI平均值用于计算噪声、信噪比(signal-to-noise ratio,SNR)和对比噪声比(contrast-to-noise ratio,CNR)。以胃癌病灶CT值的标准差作为图像噪声。SNR=胃癌病灶CT值/皮下脂肪标准差,CNR=(胃癌病灶CT值-竖脊肌CT值)/皮下脂肪标准差。
图像主观评价由2名从事腹部影像诊断的副主任医师采用双盲法分别对各组图像进行评价。主观评价各指标均按照4分法进行评定[5]:图像失真(image distortion,ID):1分,图像失真严重、不可接受;2分,图像有部分失真、影响主要结构的观察;3分,图像有失真、但不影响主要结构的观察;4分,无失真或失真很小。低对比分辨力(low contrast detectability,LCD):1分,不可接受;2分,可接受;3分,高于平均值;4分,优良。病灶边缘锐利度(lesion edge sharpness,LES):1分,模糊;2分,可接受;3分,锐利度较好;4分,非常锐利。

1.4 辐射剂量评价 采用CT容积剂量指数(computed tomography dose index volume,CTDIvol)、CT剂量长度乘积(dose-length product,DLP)及有效剂量值(effective dose,ED)评价病人的辐射剂量。记录每位病人扫描过程中的CTDIvol及DLP,通过公式DLP×k(k=0.015 mSv·mGy-1·cm-1)计算ED。
1.5 统计学方法 采用t(或t′)检验、Wilcoxon符号秩和检验和Kappa检验。
2 结果
2.1 2组病人辐射剂量指标比较 观察组CTDIvol、DLP和ED均明显低于对照组(P<0.01)(见表1)。
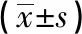
表1 2组病人辐射剂量指标比较
2.2 2组图像客观评价指标比较 观察组图像SNR、CNR均明显大于对照组(P<0.01)(见表2)。
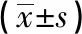
表2 2组图像客观评价指标比较
2.3 2组图像主观评价指标比较 2名阅片医师对图像质量主观评价的一致性均较好,其中观察组图像LCD、LES、ID评分的Kappa值分别为0.728、0.783、0.803,对照组图像LCD、LES、ID评分的Kappa值分别为0.781、0.736、0.767,2组LCD和LES差异均有统计学意义(P<0.05),而ID差异无统计学意义(P>0.05)(见表3)。
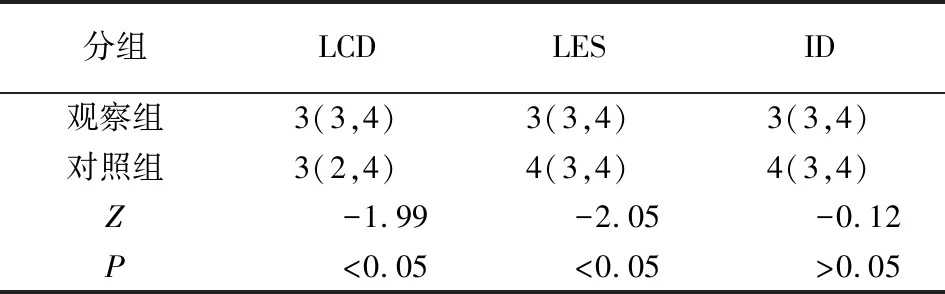
表3 2组图像主观评价指标比较[M(P25,P75)]
2.4 2组病人胃癌T分期诊断符合率比较 观察组胃癌T分期符合率为88.46%,高于对照组的64.29%(P<0.05)(见表4)。

表4 2组病人CT增强诊断胃癌T分期符合率比较
3 讨论
我国胃癌发病率近年虽有所下降,但死亡率仍持续上升[6]。目前胃癌治疗的总体策略是以外科手术为主的综合治疗,因此术前准确评估胃癌浸润情况对于手术的选择及预后至关重要。胃癌TNM分期是目前临床公认的评估胃癌病人术后预后的金标准。国内外学者多认为CT增强可作为胃癌首选临床分期手段[2,4],同时在术后疗效及随访过程中,CT增强仍是目前应用较广泛、价值较大的一种手段。但是胃癌病人行腹部CT增强扫描往往是多期扫描,由此必然会导致病人遭受更多的辐射剂量,通过降低扫描条件后,传统的重建技术通常很难保障图像足够的信噪比及对比度。因此,如何在保证图像质量的同时降低辐射剂量一直是CT发展的研究热点。
近年随着计算机科学的发展,基于迭代重组算法的低剂量CT扫描技术得到广泛关注。IMR是一种完全迭代算法,其较早期迭代重组提供更多CT系统特性的模型,依托于快速的并联处理系统和合理的约束条件,使其在临床的应用成为可能[7]。同时由于IMR技术采用统计学模型及CT系统模型,相对于以往部分模型迭代重建,可以较大幅度降低噪声,因此其具有很大降低辐射剂量的潜力[8]。程强等[9]应用低管电压联合IMR进行肝脏CT增强扫描的研究发现,低管电压组较常规管电压组辐射剂量明显降低,同时IMR较FBP可以明显降低图像噪声,提高CNR。颜俏燕等[10]报道,低管电压联合迭代重建技术可以在不影响结肠癌术前CT T分期诊断效能的前提下大大减少辐射剂量。对于胃癌的显示方面,有学者[11]通过比较多种重建方法在胃癌低剂量CT扫描中价值发现,低电压联合IMR可以显著降低图像噪声,提高图像SNR,同时很好地显示胃癌病灶与周围组织的对比度、边缘锐利度、肿块浸润范围等。同时,研究[12]报道胃癌病灶在CT门脉期显示相对较好,是因为发生在肿瘤腺体结构紊乱,局部毛细血管床比较复杂,导致血流比较缓慢对比剂通过时间延长,因此当动脉期时病灶强化往往不是很明显,而在门脉期时造影剂大量进入肿瘤毛细血管床且停留时间较长,病灶显示较明显。因此本研究以门脉期图像作为研究对象,采用低管电压联合IMR对胃癌病人进行CT增强扫描,以常规FBP组进行对照,发现观察组较对照组有效剂量平均降低约73.33%,在图像的主、客观评价方面,IMR组在LCD、LES、ID方面均较好,同时SNR与CNR较FBP组增高,与文献报道结果大致相似。
关于胃癌TNM分期,CT对于早期胃癌总体检出率欠佳,因为增强CT仅能显示三层胃壁结构,未能与组织病理学分期一一对照。但也有学者[13]利用双能CT对早期胃癌和进展期胃癌观察中发现AM40 keV可清楚地描绘胃壁结构,从而增加T1期肿瘤检出率。而对于进展期胃癌的CT评判准确率总体相对较高。其中付英杰等[14]报道CT动态增强结合MPR技术对胃癌临床T分期的准确率为83.33%。本研究中对照组的准确率为64.2%,可能系样本误差、观察者水平以及成像技术等因素所致,而观察组的准确率达88.4%,与对照组差异有统计学意义,说明IMR对于降低噪声、提高病灶的对比度及边缘显示方面具有较好的价值。
综上,低管电压联合IMR可以在降低被检者辐射剂量的同时,更好地显示胃癌病灶的浸润程度,值得临床应用推广。但本研究仍有一定局限性,首先是样本量较少,研究结果相对局限,后期将继续扩大研究人群,并进行个性化剂量设计进行更深入的研究;其次,本研究未对胃癌T分期中的亚分期进行分别阐述研究,后期将进一步完善。

