荧光染料双染流式法和萤火虫荧光素酶法检测CAR-T 细胞杀伤的方法学研究
吴亚松,李 薇,朱 毅,李 东
1南京医科大学附属明基医院输血科,江苏 南京 210003;2湖南师范大学附属第一医院血液科,湖南 长沙 410005;3南京医科大学第一附属医院胰腺中心,4普外科,江苏 南京 210009
嵌合抗原受体T(chimeric antigen receptor-T,CAR-T)细胞在针对B细胞急性淋巴细胞白血病[1-2]和B细胞淋巴瘤[3-4]的临床试验中取得了巨大成功,彻底改变了血液肿瘤的治疗方法,为相应疾病的患者提供了新选择。在CAR-T 细胞治疗技术的研发过程中,细胞杀伤实验是非常关键的验证手段,此实验用CAR-T细胞与靶细胞以一定比例共培养,特定时长之后用特定的方法检测靶细胞的死亡比例,即可以用靶细胞的死亡率来表示CAR-T 细胞的杀伤能力。靶细胞死亡率的检测方法中,传统的51Cr(铬51)释放实验需要专门的放射性检测仪器[5],而铕元素(Europium)标记、乳酸脱氢酶(lactate dehydrogenase,LDH)代谢产物等检测方法具有较高的检测背景,导致信噪比较低[6-7],因此我们建立并比较了荧光染料双染流式法和萤火虫荧光素酶法两种方法,希望以此验证这两种方法的有效性与适用条件。
1 材料和方法
1.1 材料
人淋巴瘤细胞系Raji 细胞和人白血病细胞系K562细胞购自中国典型培养物保藏中心细胞库,表达luciferase 基因的Raji-luc 细胞和表达人CD19 基因的K562-CD19细胞为本实验室构建;Malme-3m细胞购自南通表源生物技术有限公司,表达人CD19和luciferase基因的Malme-3m-CD19-luc细胞为本实验室构建;人外周血单个核细胞(peripheral blood monouclear cell,PBMC)来自天津市血液中心,CD19-CART细胞为本实验室构建。
DMEM 培养基(C11995500BT,Gibco 公司,美国);胎牛血清(FSP500,Excell 公司,美国);Calcein-AM(货号C131116-1mg,上海阿拉丁生化科技股份有限公司);CellTracker DeepRed Dye(货号C34565,Invitrogen 公司,美国);D-Luciferin(货号7902-1G,BioVision 公司,美国);ATP(货号A100885,上海阿拉丁生化科技股份有限公司);PBS(SH30256.01,HyClone公司,美国);0.25%Trypsin(25200-072,Gibco 公司,美国);二氧化碳培养箱(Thermo 公司,美国);生物安全柜(Thermo Scientific 1300 Series A2,Thermo公司,美国);小动物活体成像系统(IVIS Lumina Ⅲ,Caliper 公司,美国);流式细胞仪(Guava EasyCyte,Millipore公司,美国)。
1.2 方法
1.2.1 靶细胞系构建
pRL-luciferase、pRL-hCD19、pRL-hCD19-luciferase 3 个质粒分别与pCMV-VSV-G 和pCMV-dR8.91 2 个包装质粒共转染293-T细胞,收获的病毒上清经20倍浓缩后,分别感染Raji细胞、K562细胞和Malme-3m细胞,经流式细胞术分选纯化后,得到Rajiluc、K562-CD19、Malme-3m-CD19-luc 3 个细胞系作为杀伤实验的靶细胞。
1.2.2 CAR-T细胞的制备与培养
用CD19-CAR 质粒与pCMV-dR8.91 和pCMVVSV-G 2个包装质粒按照4∶3∶1的比例,用PEI共转染293-T细胞,转染后48 h收获病毒上清,经超速离心后换T细胞培养基(X-VIVO15+0.5%HSA)进行20倍浓缩。人PBMC细胞经Ficoll分离后加100 ng/mL可溶性CD3 抗体(OKT3)和300 U 白细胞介素(interleukin,IL)-2刺激,48 h 后换液加入病毒32 ℃300g离心90 min感染,感染后24 h换新鲜T细胞培养基,CAR-T细胞培养到第7天即可作为效应细胞开展杀伤实验。
1.2.3 荧光染料双染流式法检测细胞杀伤
荧光染料双染流式法是用两种不用的荧光染料标记靶细胞,在与效应细胞共培养后检测杀伤的方法,在流式细胞仪上检测双荧光细胞的减少确定死亡细胞,并计算杀伤效率[8-10]。具体方法为:在1 mL T细胞培养基(X-VIVO15+0.5%HSA)中加入1×106个Raji 细胞,加入Calcein-AM 至终浓度2 nmol/L,加入CellTracker DeepRed Dye 至终浓度0.1 μmol/L,混匀后37 ℃避光孵育30 min,孵育完成后用PBS洗3次,以1×104个/孔的密度接种于96 孔板中。实验组取CD19-CART 细胞,PBS 洗1 遍后重悬于T 细胞培养基中,以1∶1、5∶1、10∶1的细胞量分别加入到对应的Raji细胞孔中,每孔终体积为200 μL,阳性对照组不加CD19-CART 细胞,用T 细胞培养基补足体积至200 μL。所有孔混匀后放置CO2培养箱37 ℃孵育约4 h,孵育完成后即可直接用流式细胞仪检测。
使用的染料包括一种绿色荧光染料Calcein-AM和一种红色荧光染料CellTracker DeepRed Dye,两个染料都可以对活的靶细胞均匀染色,用流式细胞仪可以检测到显著的阳性。设置流式检测象限的X轴为Red-R,Y轴为Green-B,则双阳性的靶细胞在象限的右上角,双阴性的效应细胞在象限的左下角。
杀伤效率计算公式为:(靶细胞密度值阳性对照-靶细胞密度值实验组)/靶细胞密度值阳性对照×100%。
1.2.4 萤火虫荧光素酶法检测细胞杀伤
萤火虫荧光素酶法是利用萤火虫荧光素酶(Firefly luciferase,下文简称“luc”)的化学发光特性,用基因工程方法构建表达luc 的靶细胞,在杀伤实验检测时加入luc 的发光底物后,即可通过发出的荧光信号的强弱来显示活细胞数目,以此来计算杀伤效率[11-12]。具体方法为:用表达luc的细胞作为靶细胞,以1×104个/孔的密度接种于96 孔板中,实验组将CD19-CART 细胞以1∶1、5∶1、10∶1、20∶1 的细胞量分别加入到各个靶细胞孔中,每孔终体积为200 μL,阳性对照为只有靶细胞且不加CAR-T 细胞,用培养基补足体积至200 μL,阴性对照为靶细胞加50 μL 2%Triton X-100溶液裂解,所有孔混匀后放置CO2培养箱37 ℃孵育约16 h。孵育过后,首先每孔加入50 μL 2%的Triton X-100 溶液,用移液器混匀后每孔取出50 μL,加入到检测用的黑色96 孔板中,再向黑色96孔板中每孔加入50 μL的底物溶液(300 μg/mL D-Luciferin 水溶液与2 mg/mL ATP水溶液按照体积比为3∶1 混和),用移液器混匀后静置5 min,上机检测。检测仪器可用多功能酶标仪或活体成像仪。
杀伤效率计算公式为:[(荧光强度阳性对照-荧光强度阴性对照)-(荧光强度实验组-荧光强度阴性对照)]/(荧光强度阳性对照-荧光强度阴性对照)×100%。
1.3 统计学方法
用SPSS20.0统计软件进行数据处理,采用涉及两组数据间的比较时统计方法采用Student-t检验。涉及3组及以上数据间的比较时统计方法为单因素方差分析,用LSD 法进行多重比较。P<0.05为差异有统计学意义。
2 结果
2.1 荧光染料双染流式法在悬浮细胞杀伤实验中的效果
为了验证荧光染料双染流式法检测杀伤实验的效果,用靶向CD19 的CD19-CAR 病毒感染人的PBMC 制备了CD19-CART,经流式细胞术验证,其CD3阳性率大于90%,其CAR阳性率可达39.5%(图1A),将此CD19-CART 细胞与CD19 阳性的Raji 细胞共孵育可检测到IFN-γ释放的显著提高(图1B),证明此CD19-CART细胞具有针对CD19阳性细胞的杀伤能力。
为了观察细胞数目而非相对的比例,需要将流式参数设置为显示细胞浓度,这样所有样品收集等体积的上样量,即可得到相应目的细胞的浓度数值(图1C)。为了验证流式方法检测细胞数量的准确性,我们用效应细胞的剂量梯度与流式读数做标准曲线,结果显示了很好的线性关系(图1D)。杀伤效率随着CD19-CART 效应细胞的增多而增高的趋势(图1E)。
CD19-CART细胞作为效应细胞,并用感染对照病毒的同批次培养T细胞作对照,用上述“荧光染料双染流式法”开展了以Raji 细胞和表达CD19 的K562细胞(K562-CD19)为靶细胞的杀伤实验,结果显示CD19-CART 细胞对两种悬浮靶细胞的杀伤都高于其对照T细胞,差异具有显著性(图1F、G)。
鉴于有些杀伤实验会用到贴壁细胞作为靶细胞,我们用黑色素瘤细胞系Malme-3m 构建了表达CD19的贴壁细胞系Malme-3m-CD19,并用上述方法开展了同样的杀伤实验,但结果却显示误差过大,CD19-CART 细胞与对照T 细胞对靶细胞的杀伤效率没有显著性差异(图1H),分析认为贴壁细胞若采用此种方法会需要采用胰酶消化与吹打等操作,不但容易造成更多的细胞损伤,而且已标记到胞内的染料还可能外泄,进而更易产生较大误差,因此此流式方法更适用于悬浮细胞的检测,对于贴壁细胞还需其他更温和且更适合的方法。

图1 荧光染料双染流式法可检测CAR-T细胞对悬浮细胞的杀伤实验
2.2 萤火虫荧光素酶法在贴壁细胞杀伤实验中的效果
为了验证荧光素酶法检测杀伤实验的效果,我们在96孔板中加入按比例稀释的靶细胞,加入底物后用活体成像仪检测,拍下96 孔板发光照片(图2A),计算出的标准曲线(图2B),证明了此方法的准确性。在加入了相等数目靶细胞Raji-luc细胞的孔中分别加入1倍、5倍、10倍、20倍数目的CD19-CART 细胞,加入底物后用活体成像仪检测,拍下96 孔板发光照片(图2C、D)。由于靶细胞被杀伤后释放出的荧光素酶降解需要一定时间,为了增加实验的准确性,我们为荧光素酶法设定了更久的杀伤孵育时间(过夜杀伤,16 h),考虑到实验组与对照组都经历了同样的孵育时长,我们认为细胞在此孵育期间的增殖效应对双方是等效的,所以在此实验中默认细胞增殖不影响结果判定。结果显示,随着加入的CD19-CART细胞的增加,杀伤效率呈显著增高趋势(图2E)。
用此方法开展CD19-CART 细胞及其对照T细胞对悬浮的Raji-luc细胞和贴壁的Malme-3m-CD19-luc(表达CD19 和luciferase 的Malme-3m 细胞)的杀伤实验,结果显示CD19-CART细胞对两种靶细胞的杀伤都显著高于其对照T 细胞,差异有统计学意义(图2E、F),因此萤火虫荧光素酶法对悬浮细胞和贴壁细胞的杀伤实验都适用。
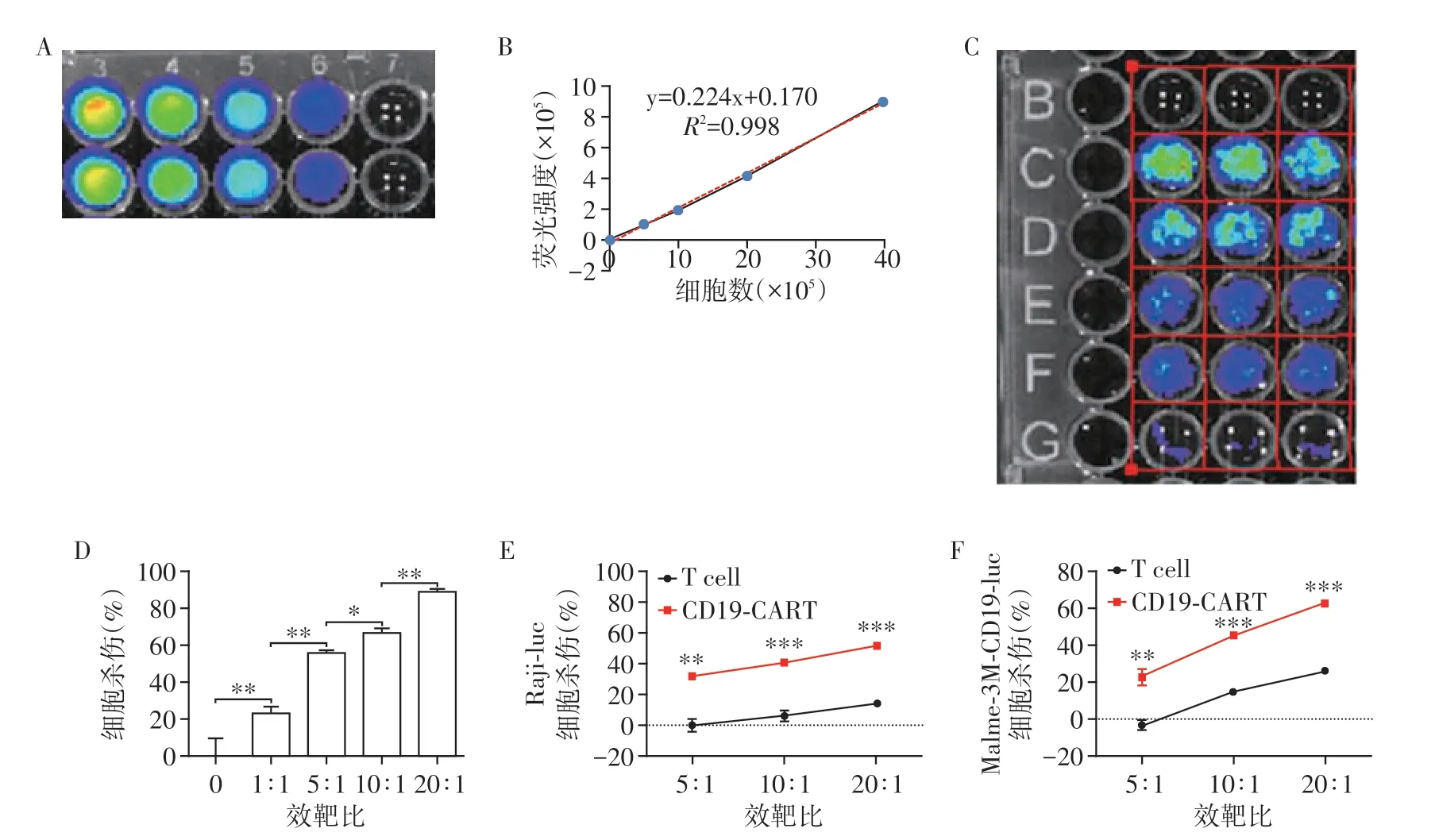
图2 萤火虫荧光素酶法对靶细胞为悬浮细胞或贴壁细胞的杀伤实验
3 讨论
CD19-CART 细胞治疗已经成为复发/难治性B细胞白血病和非霍奇金淋巴瘤的最优疗法,其完全缓解率甚至可为50%~90%,由此引起了学术界极大的兴趣,催生了大量的CD19 和非CD19 靶向性的CAR-T 研究[13-15],所针对的疾病除了血液系统肿瘤外,还包括多种实体瘤等[16-17],而所有这些研究都需要细胞杀伤实验来证明其有效性。传统的51Cr 释放、Europium 标记、LDH 代谢产物等杀伤实验检测方法都各有缺点,难以同时兼顾便利性和准确性。
本研究比较了两种简便且准确的杀伤实验检测方法:荧光染料双染流式法和萤火虫荧光素酶法。荧光染料双染流式法不需构建特殊的靶细胞系,只需用两种荧光染料对靶细胞染色,即可用流式细胞仪进行杀伤效率检测,其缺点是在使用贴壁靶细胞时会因产生过大的误差而导致实验失败;萤火虫荧光素酶法对悬浮细胞和贴壁细胞都适用,可用多功能酶标仪或活体成像仪检测,但前提是要先构建出表达荧光素酶(luc)的靶细胞。有研究者在NK92细胞杀伤K562细胞这种非特异性杀伤的实验条件下比较了这两种方法[18],但并未开展CAR-T细胞杀伤多种靶细胞的可行性验证,本文则是在CD19-CART 细胞的特异性杀伤实验中,使用了自然表达CD19的Raji细胞、过表达CD19的K562细胞两种悬浮细胞和一种过表达CD19 的Malme-3m 贴壁细胞这3 种靶细胞,实际检验了这两种方法在各个实验条件下的表现。两种方法虽仍各有缺点,但其便利性和准确性得以兼顾,有望帮研究者降低进入CART领域的门槛,促进CAR-T研究的发展。
实验中发现萤火虫荧光素酶法在低效靶比条件下,T细胞对照组有时会出现负的杀伤结果,分析可能是加入的T细胞通过细胞接触等机制提高了靶细胞的代谢水平,进而导致了荧光素酶蛋白的表达升高。鉴于同组的T细胞或CAR-T细胞条件都加入了相同数量的T 或CAR-T 细胞,我们认为这种统一的背景变化不会影响最终的杀伤结论。
综上所述,本研究建立了荧光染料双染流式法和萤火虫荧光素酶法两种CAR-T 杀伤实验检测方法,并比较了在靶细胞为悬浮细胞和贴壁细胞时这两种方法的可行性和优缺点,结果显示荧光染料双染流式法仅适用于悬浮细胞的杀伤实验,不适用于贴壁细胞的情况;而萤火虫荧光素酶法在靶细胞为悬浮细胞或贴壁细胞的情况下都可以用来检测杀伤效率。

