大鼠腰椎间盘退变模型的建立及其形态学观察
陈 莎,王诗忠,邓德万
(1.福建省立金山医院,福建 福州350028;2.福建医科大学,福建 福州350108;3.福建中医药大学附属福鼎医院,福建 福鼎355200)
下腰痛(low-back pain,LBP)是一种以后背、腰骶部疼痛为主要表现,可伴有下肢放射痛或麻木的临床疾病。在成年人群中患病率可达12%,严重影响患者工作及生活[1]。1970年CROCK[2]提出椎间盘紊乱学说,研究证实椎间盘退变可诱发下腰痛,但其机制尚未明确[3]。理想的动物体内退变模型是研究椎间盘退变机制及有效治疗手段的必要基础,本文通过建立一种大鼠腰椎间盘退变模型,并进行形态学观察,为相关研究提供动物模型依据。
1 实验材料
1.1 实验动物SPF级3月龄健康雄性SD大鼠16只,体质量250~300 g,由上海动物实验中心提供,许可证号:SCXK(沪)2012-0002。
1.2 实验试剂 苏木素伊红染色液(上海碧云天生物科技公司);TUNEL试剂盒(美国Promega公司)。
1.3 实验仪器 切片机、倒置显微镜(德国LeiCa公司);激光共聚焦显微镜(日本Leiss公司)。
2 实验方法
2.1 动物分组及模型制作 实验大鼠适应性饲养1周后,按体质量进行编号,运用随机数字表法将16只大鼠分为假手术组及模型组,每组8只。大鼠腰椎间盘退变模型的制作采用纤维环穿刺法[4-5],并加以改进,术前16只大鼠禁食禁水12 h,称重,计算10%水合氯醛用量(3 mL/kg),予腹腔注射麻醉。模型组进行造模手术,假手术组仅切开皮肤再缝合。造模手术操作:大鼠剃毛暴露腹部手术区,清洁后仰卧固定,消毒后铺巾,于前正中线右侧旁开0.5 cm处做一纵行切口,暴露腹后壁,保护好肠管及下腔静脉,从脊柱附着点上,缓慢剥离腰大肌,暴露L3/L4、L4/L5、L5/L6椎间盘(髂嵴平对L5/L6椎间盘或L6椎体),取21G穿刺针平行于软骨终板进针,穿刺深度约为2.3 mm。穿刺成功后,依序关腹、缝皮。每只大鼠术后放入单笼饲养,予青霉素5万单位肌注,每日1次,连续3 d。术后注意大鼠进食情况及步态,有无伤口感染及尿潴留等。
2.2 取材2组大鼠同等条件喂养8周后,以过量10%水合氯醛腹腔注射处死大鼠,经后正中线切开皮肤、逐层分离,剥除椎旁肌肉韧带,取下完整腰椎节段后,于冰面上快速取出L4/L5椎间盘组织,放入4%多聚甲醛中固定48 h,于37℃恒温箱中以10%EDTA脱钙30 d,包埋切片后予HE染色及TUNEL法进行形态学观察。
2.3 HE染色法观察椎间盘组织病理情况 将切片分别浸入苏木精及伊红中染色、水洗、烘干、封片后,于光镜下观察各切片组织形态学结构,并进行组织学分级评分[6],该评分级别共三级,每一级的评分内容包含4项:纤维环结构、纤维环与髓核分界线、髓核中的基质及髓核中的细胞,满足任意一项即计入1分;最低0分,最高12分。
2.4 TUNEL法检测椎间盘组织凋亡情况 切片染色处理后,采用DeadEnd荧光测定TUNEL系统检测细胞凋亡,于激光共聚焦显微镜(Leiss LSM710)下分析样本,200倍高倍视野下观察并拍照,镜下细胞核由DAPI染为蓝色,凋亡细胞呈绿色荧光。
2.5 统计学方法 采用SPSS 22.0软件进行统计分析。计量资料符合正态分布以(x±s)表示,采用单因素方差分析。
3 结 果
3.1 椎间盘组织HE染色 假手术组椎间盘组织中髓核无明显皱缩,网状结构完整,与纤维环界限分明,纤维环结构完整、排列有序;模型组椎间盘组织中髓核皱缩、结构紊乱,髓核细胞肿胀,髓核纤维环之间界限不清,纤维环局部撕裂、排列紊乱,纤维环细胞出现肿胀。见图1。

图1 2组椎间盘组织HE染色图(×25)
3.2 2 组椎间盘组织学分级评分 假手术组椎间盘组织学分级评分为(5.00±0.82)分,模型组为(11.25±0.96)分,2组比较差异有统计学意义(P>0.05)。
3.3 TUNEL法检测椎间盘组织凋亡情况 镜下可见,细胞核为蓝色荧光,TUNEL阳性细胞呈绿色荧光。假手术组仅见少量TUNEL阳性细胞表达,模型组TUNEL阳性细胞表达较假手术组明显增多。见图2。
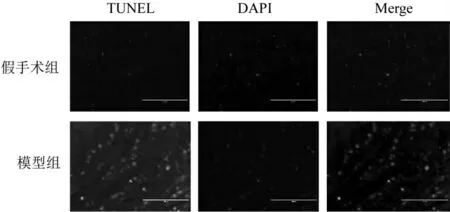
图2 2组椎间盘组织TUNEL染色图(×200)
4 讨 论
建立可靠的动物椎间盘退变模型,是研究椎间盘源性疼痛机制及其治疗手段的基础。目前已报道如鼠、兔、猪、羊、犬等动物均已建立椎间盘退变模型,造模手段主要有以下几类:①改变脊柱生物力学,如利用加压装置[7]、剪除椎旁肌肉韧带[8]等诱发退变;②造成椎间盘损伤,如纤维环切开、穿刺法[9]、髓 核抽 吸法[10]、髓核 内注 射 木 瓜凝乳蛋 白酶法[11];③阻断软骨终板血供通路,减少椎间盘营养供应以诱导退变[12-13];④自发退变模型,如通过敲除特定基因,造成椎间盘物质代谢异常以引起退变,或使用具有椎间盘自发退变特性的动物,如沙鼠[14]。以上几类模型各有优势,但生物力学改变模型需要特殊加压装置或较高的操作技巧,髓核损伤模型不利于后续形态学观察及成分研究;终板损伤模型具有理论基础,但相关研究结果提示其可重复性差、缺乏稳定性;自发退变模型最为接近自然退变过程,但造模周期长、成本高,故应用受限。本模型采用的纤维环穿刺法,模拟纤维环损伤后,髓核组织突出、脱水、变性等椎间盘退变过程。穿刺深度选择2.3 mm,可达纤维环全层,退变程度较纤维环部分穿刺法(穿刺深度1.5 mm)更高,且在穿刺4周后即可观察到退变表现[4]。
椎间盘退变与遗传基因、营养缺乏、生物力学改变、炎症反应及细胞凋亡等多种因素相关。其中细胞凋亡是机体为维持内环境的稳定,细胞自主进行的有序死亡,细胞凋亡所致的活性细胞数目减少、基质合成不足,可引发椎间盘正常结构破坏。有研究发现,人体退变椎间盘组织标本中,细胞凋亡现象超过半数[15]。TUNEL法是一种结合分子生物学及形态学的实验方法,广泛应用于凋亡细胞或凋亡小体的检测中,能直观准确地反映凋亡细胞的形态及位置。故本实验采用该方法结合最常见的HE染色法,观察验证椎间盘退变模型,镜下可见模型组椎间盘结构紊乱、纤维环与髓核界限模糊、TUNEL阳性细胞表达较假手术组明显增多等退变表现。
综上所述,本实验建立了一种有效的椎间盘退变模型,其操作简便、重复性好、创伤较小,术后8周可观察到明显退变,较为经济,可作为椎间盘退变研究的模型基础。

