溶藻弧菌T3SS exsD 基因敲除突变株构建及其表型特征
王俊霖,招 茵,苏茵茵,周诗慧,曾福源,谢 妙,王 娜,简纪常,庞欢瑛
(1.广东海洋大学水产学院// 广东省水产经济动物病原生物学及流行病学重点实验室// 广东省教育厅水产经济动物病害控制重点实验室,广东 湛江 524088;2.中国检验检疫科学研究院,北京 100176)
溶藻弧菌(Vibrio alginolyticus)为嗜盐嗜温性的革兰阴性菌[1-2],普遍存在于海洋环境和多种海洋动物中,是鱼、虾、贝等海水养殖动物的主要致病菌之一[3]。此外,该菌可导致人类的食物中毒、中耳炎、头痛、乏力以及败血症等多种疾病[4]。
III 型分泌系统 (Type III secretion system,T3SS)是多数革兰阴性菌的重要毒力因子,其功能是将细菌效应蛋白注射至宿主细胞中,最终导致宿主细胞死亡[5-6]。近年来,关于细菌T3SS 的结构、装配以及致病机理研究取得较大进展,研究较为深入的有副溶血弧菌(Vibrio parahemolyticus)[7]、铜绿假单胞菌(Pseudomonas aeruginosa)[8]、哈维弧菌(Vibrio harveyi)、嗜水气单胞菌 (Aeromonas hydrophila)[9]等。有关溶藻弧菌T3SS 的研究主要集中在装置蛋白[10-12]、效应蛋白[13-15],而对调控蛋白的研究报道较少。
在铜绿假单胞菌中,ExsD 是T3SS 的负调控因子[16],对T3SS 分泌相关蛋白、调节蛋白和效应蛋白有显著抑制作用[17-18]。副溶血弧菌的T3SS1 主要受ExsACDE 操纵子调控,在诱导条件下,ExsA 通过结合T3SS1 结构基因和效应蛋白基因的启动子来介导T3SS1 的细胞毒性,ExsD 蛋白可直接与ExsA 蛋白结合,阻断T3SS1 的分泌;ExsC 蛋白可直接与ExsD 蛋白结合,从而免去其对ExsA 蛋白的抑制作用,促进T3SS1 的表达,即ExsA 和ExsC是T3SS1 的正向调控子,ExsD 是T3SS1 的负向调控子[8]。然而,目前尚鲜见有关溶藻弧菌T3SS 调控蛋白ExsD 表型的研究报道。
本研究通过overlapPCR 和同源重组技术,构建缺失株ΔexsD,并比较其生长、泳动能力、胞外酶活性、生物膜形成能力、药物敏感度、毒力等与野生株HY9901 的差异,为进一步研究溶藻弧菌ExsD蛋白的功能和T3SS 的致病机制提供理论依据。
1 材料与方法
1.1 材料
1.1.1菌株与质粒 溶藻弧菌野生株HY9901 为广东省水产经济动物病原生物学及流行病学重点实验室保存;同源重组菌株S17-1λpir (TPR,SMR,ΛPIR),Biovector Co.,LTD;大肠杆菌感受态BL21(DE3),北京全式金生物公司;自杀质粒 pDM4(SACB,CMR),Biovector Co.,LTD,引物见表1。

表1 实验用引物Table1 Primers used in this study
1.2 方法
1.2.1缺失株的构建 参照Milton 等[19]方法,用引物ExsD-A1-F/ExsD-A1-R 和ExsD-A2-F/ExsD-A2-R对exsD编码序列上下游同源臂进行扩增。除BglII和SalI 限制位点序列外,两个扩增片段均含有10 bp的重叠序列。将这些产物作为“splicing by overlap extension”(SOE) PCR 的模板,利用引物ExsD-A1-F和ExsD-A2-R 扩增融合片段。全片段用BglII 和SalI酶切,连接到自杀载体 pDM4(酶切),生成pDM4-exsD-A1F+A2R。将所得质粒电穿孔至大肠杆菌 S17-1,通过电转法转入溶藻弧菌菌株HY9901。用氨苄西林和氯霉素在TSA 板上筛选成功转入质粒的单克隆菌株。取若干插入突变单菌落,划线于LB平板 (4 g/LL-阿拉伯糖) 中,置28 ℃下培养18 h。挑取平板上菌落,以引物ExsD-A1-F/ExsD-A2-R 检测单菌落,野生型溶藻弧菌作为对照。单菌落纯化后,再次进行扩增验证,测序结果验证缺失株ΔexsD是否构建成功。
1.2.2缺失株ΔexsD的验证 参照冯建儒等[20]的方法,提取野生株HY9901 和缺失株ΔexsD的RNA,反转录成cDNA,利用引物ExsD-F/ExsD-R 进行PCR 扩增验证。
1.2.3突变株的遗传稳定性检验 将缺失株ΔexsD在TSB培养基上连续传代30次,用引物ExsD-A1-F/ExsD-A2-R 进行PCR 及电泳检测,确定ΔexsD是否可稳定遗传。
1.2.4生长曲线测定 挑选溶藻弧菌野生株HY9901、缺失株ΔexsD单菌落,接种于新鲜TSB培养基,在D(600 nm)=0.5 时按照1∶100 的比例接种到新鲜培养基中继续培养24 h。在此期间,每2 h取样1 次。以时间点为横坐标,D(600 nm)为横坐标绘制两株菌株的生长曲线。每个样品设3 个重复。
1.2.5细菌泳动实验 配制LBS 培养基(在LB 培养基中添加20 g/L 的NaCl、3 g/L 的琼脂[21],分别用牙签挑取溶藻弧菌野生株HY9901、缺失株ΔexsD单菌落以垂直的方式插入到上述平板,注意彼此之间的距离。于28 ℃条件下静置培养7 h,测量泳动圈的直径。
1.2.6胞外蛋白酶活性检测 将高压灭菌后烘干的玻璃纸平铺在含有1.5%琼脂的TSA 平板上。吸取D(600 nm)=0.5 的溶藻弧菌野生株HY9901、缺失株ΔexsD各100 μL,涂布于含有玻璃纸的TSA 平板,于28 ℃培养箱中培养18 h。用4 mL 无菌磷酸盐缓冲液(PBS)缓慢吹打、洗涤玻璃纸,洗涤液于4 ℃、10 000g条件下离心0.5 h。将上清液过0.22 μm 的微孔滤网,得到细菌的胞外产物,4 ℃下保存。
分别取溶藻弧菌野生株HY9901、缺失株ΔexsD的胞外产物100 μL,分别加入100 μL 0.5 g/L 的偶氮酪蛋白溶液,混匀。补加pH 8.0 的Tris-HCl 溶液,于37 ℃下孵育0.5 h。加入100 g/L 的三氯乙酸400 μL,室温下孵育0.5 h,终止反应。以12 000g离心5 min,取上清液,加入0.525 mol/L 的NaOH 溶液800 μL 进行显色反应,用酶标仪测定D(442 nm)。用煮沸后样品作为空白对照,实验重复3 次。
用软件SPSS12.0 进行单因素方差分析,用Duncan 多重比较,根据P值确定显著性。
1.2.7药敏实验 用纸片扩散法测定菌株对30 种抗生素的敏感性。测定抑菌圈直径,通过比对说明书判读结果。
1.2.8半数致死量LD50测定 分别接种 HY9901、ΔexsD的单克隆至TSB 中,摇床振荡培养18 h,以1∶100 比例重新接种到新的TSB 中,培养至D(600 nm)=1.00,以5 000 r/min 离心3 min,收集菌体,用PBS 清洗2 次,并调节至梯度浓度108、107、106、105、104,以PBS 为空白对照,实验用斑马鱼(Danio rerio)共180 尾,随机分组,每组10 尾。实验组以肌肉注射方式每尾注射5 μL 菌液。对照组以同样方式注射等量PBS。每组设置3 个重复组。记录7 d 内鱼体死亡数,直至死亡情况稳定。用寇氏法计算半数致死量。
1.2.9生物膜厚度检测 结晶紫染色。挑取溶藻弧菌野生株HY9901、缺失株ΔexsD单菌落接种于5 mL 新鲜的TSB,培养至D(600 nm)=0.5。按照1∶10 比例稀释菌液,分别接种于无菌的96 孔板,每孔加100 μL,28 ℃下分别培养6、12、24、48、72 h。72 h 后用无菌PBS 300 mL 轻轻洗掉菌液,重复3 次,倒置晾干。加150 μL 甲醇固定20 min,倒置30 min,晾干。用每孔加150 μL 的结晶紫草酸铵溶液,染色15 min;用自来水轻轻冲洗掉,倒置晾干。每孔加入150 μL 的体积分数95%乙醇,室温放置30 min,在D(570 nm)条件下测定,以新鲜的TSB 溶液为阴性对照。实验重复3 次。
共聚焦显微镜观察及测定[22]。将野生株HY9901 及缺失株ΔexsD接种到新鲜TSB 培养基,于28 ℃下震荡培养24 h,将菌液D(600 nm)调至0.5,以1∶50 比例加至NEST 玻底培养皿中,37 ℃下静置培养24 h。用8.5 g/L 生理盐水清洗3 次,加入质量分数10% SYTO9 绿色荧光染料,置黑暗处染色20 min。用生理盐水清洗3次,加入100 μL 40% 生理盐水-甘油,进行共聚焦显微镜观察。激发波长为488 nm,扫描从底部至顶部的生物膜,测定膜厚度。
1.2.10T3SS 相关基因的表达分析 用高糖培养基(Dulbecco’s Modified Eagle,DMEM)诱导T3SS分泌,T3SS 相关基因的引物如表1 所示,16S rRNA用作内部参考。根据Li 等[23]方法提取RNA,用合成cDNA 和实时荧光定量PCR 分析T3SS 的hop基因[14-15]在不同时段的表达量。
1.2.11数据统计与分析 实验数据采用SPSS 17.0软件进行单因素方差分析。
2 结果
2.1 缺失株ΔexsD 的构建及验证
图1 可见,正确的缺失突变克隆扩增产生948 bp 片段,野生型扩增片段长1 788 bp。

图1 缺失株ΔexsD 的构建Fig.1 Construction of the mutant strain ΔexsD
克隆纯化后,再次扩增验证,并递交PCR 产物测序,测序结果证实,exsD缺失突变株构建成功。
野生株和缺失株ΔexsD接种培养18 h 后,成功提取到完整的RNA(图2(A))。特定引物ExsD-F/ExsD-R 扩增结果表明,野生株HY9901 处有981 bp的条带,缺失株ΔexsD扩增不出条带(图2(B)),证明已成功构建缺失株ΔexsD。

图2 缺失株ΔexsD 的验证Fig.2 Verification of the mutant strain ΔexsD
2.2 突变株的遗传稳定性
野生株HY9901 及缺失株ΔexsD均经连续传代30 代,野生株可检测到1 788 bp 的片段,缺失株ΔexsD得到948 bp 的片段,表明溶藻弧菌HY9901在缺失基因exsD情况下依旧可稳定遗传(图3)。

图3 ΔexsD 的遗传稳定性分析Fig.3 Genetic stability detection of deletion mutant ΔexsD
2.3 生长曲线
比较野生株HY9901 和缺失株ΔexsD在TSB中的生长曲线(图4)可知,两株菌生长基本一致,说明ΔexsD基因缺失不会影响菌株生长。两株菌的繁殖速度均较快,2~ 6 h 时达到指数生长。

图4 缺失株ΔexsD 与HY9901 生长曲线Fig.4 Growth rates of HY9901 ΔexsD and HY9901
2.4 泳动能力
图5 可知,与溶藻弧菌野生株HY9901 比较,缺失株ΔexsD泳动能力极显著上升(P< 0.01)。
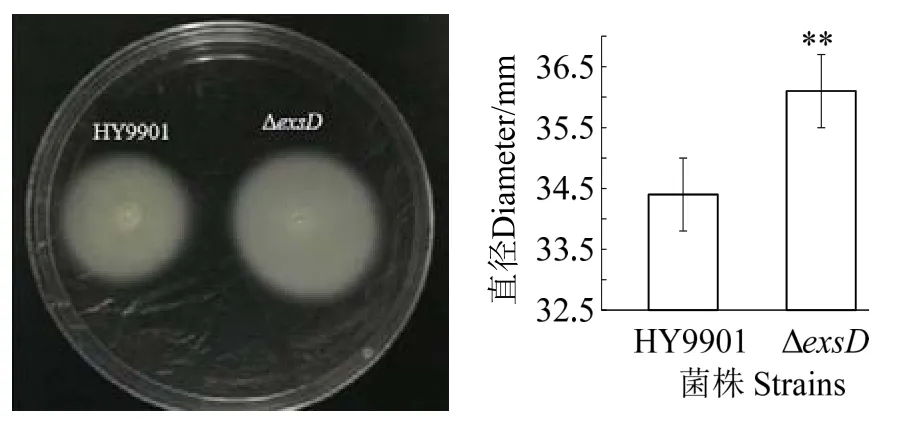
图5 泳动能力Fig.5 Swimming motility
2.5 胞外蛋白酶活性
图6 表明,与溶藻弧菌野生株比较,缺失株ΔexsD的酶活性显著上升(P< 0.05)。

图6 胞外蛋白酶活性Fig.6 Activity of ECPase
2.6 药敏试验
表2 可见,溶藻弧菌野生株HY9901 与缺失株对多数抗生素耐药,相较于野生株,exsD基因的缺失,使菌株对米诺环素、庆大霉素、卡那霉素、多西环素、新霉素的敏感性从耐药变成中度敏感。

表2 药敏试验结果Table 2 Drug sensitivity test results of the HY9901 and HY9901 ΔexsD
2.7 半数致死量LD50
由表3 可知,与野生株比较,突变株ΔexsD对斑马鱼的半数致死剂量下降,是前者的1/3.68,表明exsD基因缺失影响了溶藻弧菌的致病性,导致毒力上升。
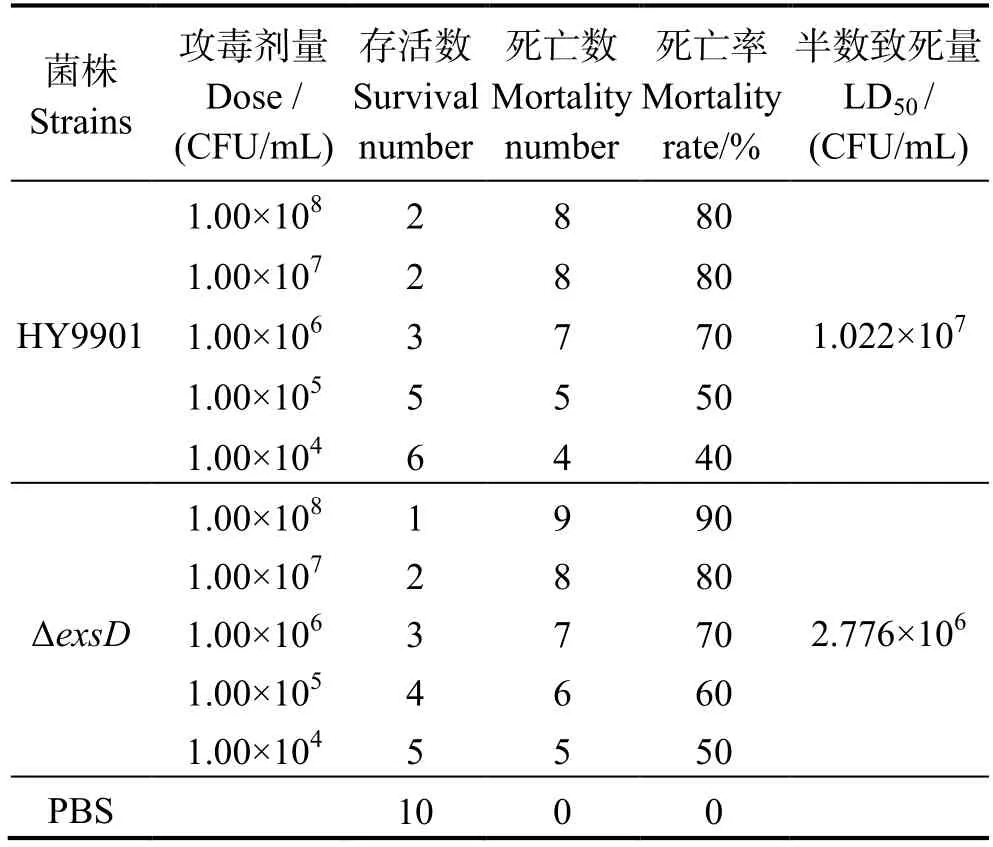
表3 溶藻弧菌HY9901、突变株ΔexsD 对斑马鱼的LD50Table 3 LD50 of HY9901 and ΔexsD for zebrafish
2.8 生物膜厚度
图7 可见,溶藻弧菌野生株HY9901 和缺失株ΔexsD形成生物膜的能力在前48 h 略有不同,48 h后则差别不大,在24 h 时缺失株ΔexsD生物膜(0.62)明显厚于野生株HY9901(0.36)(P< 0.05)。

图7 野生株、缺失株ΔexsD 的生物膜Fig.7 Biomembrane thickness of HY9901 and its ΔexsD
共聚焦电镜(24 h)的结果如图8 所示,相对于野生株HY9901,缺失株ΔexsD生物膜厚度显著增加(P< 0.05),与结晶紫染色结果相符。

图8 野生株、缺失株ΔexsD 的生物膜(共聚焦电镜)Fig.8 Measurement of biofilm by LSCM
2.9 mRNA 表达差异
图9 表明,与HY9901 野生型相比,ΔexsD组hop的表达量在18、24、36、48、72 h 时均极显著上升(P< 0.01)(图9)。
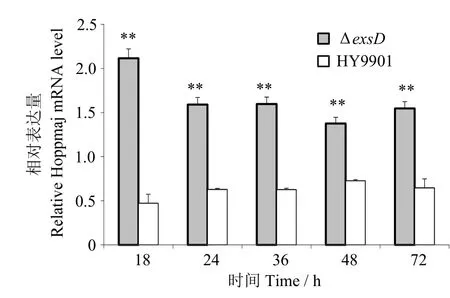
图9 HY9901 和ΔexsD 在DMEM 中T3SS 效应蛋白基因hop 的mRNA 表达Fig.9 Expression of T3SS effector protein gene hop of HY9901 and ΔexsD induced by DMEM
3 讨论
细菌毒力因子T3SS 表达与分泌受环境和相关调控蛋白ExsAD 的影响,部分细菌exsD基因有负调控T3SS 的作用,但调控机制复杂。如铜绿假单胞菌可与真核细胞接触,或在特定环境条件下诱导T3SS 表达分泌[16]。T3SS 由ExsA 蛋白直接调控,而ExsCDE 三个蛋白可感应胞外Ca2+浓度来调控ExsA 的转录活性[8,24-25]。为检测铜绿假单胞菌ExsD 对转录的影响,Michelle 等[16]通过LacZ 报告基因融合实验表明,exsD基因的缺失显著促进了T3SS 分泌,及调节蛋白和效应蛋白的表达。又如,Zhou 等[26-27]发现,副溶血弧菌在LB-S 培养基生长时,exsD基因的缺失激活T3SS1 基因的转录,而野生株exsD基因的回补抑制了其基因的转录;当在DMEM 中生长时,副溶血弧菌ExsD 在NY-4 中的过表达阻止了T3SS1 基因的转录,表明ExsD 为负向转录调控;ExsD 直接与ExsA 结合,并可能阻止ExsA 与T3SS1 基因的启动子区域结合。Liu 等[28]确定,经典的铜绿假单胞菌ExsACDE 蛋白-蛋白调控模型适用于溶藻弧菌,并在溶藻弧菌中证实ExsA和ExsC 正调控T3SS,ExsD 和ExsE 负调控T3SS。然而,溶藻弧菌T3SS ExsD 蛋白的表型与具体调控机制还未充分阐明,本研究敲除溶藻弧菌T3SS 的调控基因exsD,并分析其表型特征,可为进一步阐明exsD功能提供依据。
端生鞭毛及众多周生鞭毛是细菌表面附属结构的重要组成部分,影响弧菌的泳动力,鞭毛调控蛋白可直接影响细菌泳动能力[29-30]。刘文竹[31]报道,溶藻弧菌tssj基因的缺失可影响溶藻弧菌鞭毛的生成,减弱突变株的泳动能力。本研究中,野生株HY9901 与缺失株ΔexsD泳动能力差异极其显著(P< 0.01),exsD基因的缺失增强了突变株的泳动能力,表明ExsD 蛋白与溶藻弧菌的泳动能力之间相互关联,推测exsD基因对溶藻弧菌鞭毛的生成或鞭毛蛋白的表达以及泳动能力为负调控影响。
胞外酶是一类多种活性酶的总称,也是病原菌致病的主要毒力因子之一,可以特殊形式在宿主体内增殖,轻者破坏宿主免疫系统,重者使宿主细胞发生溶解进而死亡[32]。致病性弧菌的胞外产物有多种酶活性,许兵等[33]用杯碟法测出溶藻弧菌的胞外产物,且对对虾有致死作用,其中蛋白酶成分是决定病原菌致病性的重要因素。本研究中,缺失株ΔexsD的蛋白酶活性相对于野生株HY9901 显著上升(P< 0.05),推测ExsD 蛋白可通过调控其他效应蛋白,或与其他调控蛋白协同作用降低溶藻弧菌的蛋白酶活性。然而ExsD 蛋白如何影响溶藻弧菌蛋白酶活性,还需进一步实验验证。
目前,对溶藻弧菌病防治以抗生素为主,但长期大量使用抗生素会使溶藻弧菌产生耐药性[34-35]。另一方面,细菌的耐药性也可通过耐药质粒接合、转导的传播作用或从其他携带耐药基因的铁载体上获得[36-37]。溶藻弧菌存在耐药基因[38-39],胡梦华等[39]研究发现,溶藻弧菌菌株VA-76 携带arr-2、drfA27、strA、strB、floR、cat和qnrvC耐药基因,既有一定的致病能力,且对多种抗生素耐药。本研究中,溶藻弧菌HY9901 与缺失株ΔexsD也对大多数抗生素耐药,与野生株相比,exsD基因的缺失,使其对米诺环素、庆大霉素、卡那霉素、多西环素、新霉素五种抗生素的耐药性从耐药变成中度敏感。这可能说明exsD可直接或间接调控相关耐药基因的表达。而细菌的生物膜可促进细菌抵御抗生素,在临床上引起多重耐药性[40],本研究中,在6 h 前,ΔexsD形成生物膜能力弱于野生株,这也可能是细菌对抗生素的耐药性从耐药到敏感的原因之一。
细菌可特异性和选择性地在介质表面黏附,生成一层生物膜,有减轻抗生素干扰并在宿主免疫防御中保护自身作用[41]。本研究通过结晶紫染色和共聚焦扫描两种方法证明,缺失株ΔexsD形成生物膜能力在24 h 时高于野生株,说明exsD基因在细菌生长的稳定期对生物膜形成负调控。Sara 等[42]与夏飞等[43]报道,细菌在致病过程中,密度感应系统发挥重要作用,有4%~12%基因受其调控,并直接控制多种毒力因子表达,包括生物膜形成。因此,ExsD蛋白在细菌生长的稳定期显著影响生物膜厚度可能与密度感应现象有关,这需进一步实验验证。
细菌的毒力体现在产毒力和侵染力,它会与宿主发生一系列的相互作用,最终产出毒素并侵染宿主[44]。Phan 等[45]发现,副溶血弧菌缺失株ΔHUs(Δvp0920、Δvp2911)与野生株相比,exsA、exsD、vp1680、vp1671等T3SS1 相关基因的表达水平降低,另外在ΔHUs 株中exsD基因额外的缺失,恢复了T3SS1 相关基因的表达水平和细胞毒性。在张杰等[46]所构建的杀香鱼假单胞菌(Pseudomonas plecoglossicida)exsA突变株对大黄鱼(Larimichthys crocea)的毒力实验中,与exsA突变株相比,野生株对大黄鱼的毒力提高190 倍;杀香鱼假单胞菌ExsA 正向调控T3SS 相关蛋白的表达。本研究的缺失株ΔexsD毒力相较于野生株升高了3.68 倍,与杀香鱼假单胞菌和副溶血弧菌的毒力实验结果一致。
调控蛋白对T3SS 的调控主要是对效应蛋白的调控[47]。Liu 等[28]研究发现,溶藻弧菌ExsD 对效应蛋白Va1686 和Va1687 起负向调节作用。Zhou等[48]研究表明,TyeA 可调节溶藻弧菌T3SS,可能参与调节效应蛋白的表达,在缺失tyeA基因的情况下,显著上调效应蛋白VopS 和Hop 的mRNA 表达量。本研究中,exsD基因的缺失同样也会增加T3SS效应蛋白Hop 的mRNA 表达量,可能ExsD 与TyeA蛋白一样,通过某种方式来负调控T3SS 相关基因的转录,从而增加溶藻弧菌效应蛋白的表达。可见,溶藻弧菌T3SS ExsD 蛋白有负调控相关效应蛋白的功能,但具体调控机制是否与副溶血弧菌、铜绿假单胞菌相似,还需要进一步探究。本研究可为后续T3SS 的调控机制研究奠定基础。
4 结论
本研究采用同源重组和OverlapPCR 技术成功构建溶藻弧菌HY9901 突变株ΔexsD,分析表明,溶藻弧菌exsD基因的缺失,对溶藻弧菌的遗传稳定性、生长速度影响不显著;但导致其泳动能力、对斑马鱼的致病性极显著上升,胞外蛋白酶活性和24 h 形成生物膜的能力显著上升,对丁胺卡那、庆大霉素、多西环素、新霉素、氯霉素五种抗生素药物敏感度从耐药上升至中等敏感,上调了T3SS 效应蛋白Hop 的表达。

