西北太平洋富山武装乌贼和相拟钩腕乌贼的空间分布及生物学特征
连晋欣 ,臧 娜 ,陈新军,2,3,4,5 ,瞿俊跃 ,操亮亮 ,花传祥,2,3,4,5 ,林东明 ,2,3,4,5
(1.上海海洋大学海洋科学学院// 2.大洋渔业资源可持续开发省部共建教育部重点实验室// 3.国家远洋渔业工程技术研究中心//4.农业农村部大洋渔业开发重点实验室// 5.农业农村部大洋渔业资源环境科学观测实验站,上海 201306)
富山武装乌贼(Enoploteuthis chunii)和相拟钩腕乌贼(Abralia similis)为鞘亚纲(Coleoidea)枪形目(Teuthoidea)开眼亚目(Oegopsida)武装乌贼科(Enoploteuthidae)种类;前者隶属武装乌贼属(Enoploteuthis),后者隶属钩腕乌贼属(Abralia)。富山武装乌贼广泛分布在菲律宾外海、中国东海、日本海、日本中部、南部海域和黑潮-亲潮汇合海域,以日本大陆架及其邻近水域资源较为丰富[1-3]。相拟钩腕乌贼的分布更为广泛,自汤加南部外海、巴布亚新几内亚外海至西北太平洋均有分布[3-5]。两者均为大洋性中上层种类,体型较小,富山武装乌贼最大胴长为100 mm,相拟钩腕乌贼最大胴长则为40 mm 左右[3]。
鞘亚纲头足类生命周期短、终生一次繁殖,在海洋生态系统中既是贪婪的机会型捕食者,也是各种大型鱼类、海洋哺乳类动物和鸟类等的重要食物来源[6-7]。同时,这些种类生长速度快、世代更替亦快[6],部分种类资源量非常可观,已经被联合国粮农组织定义为未来最有开发潜力的渔业资源种类之一[8-9]。目前,鲜有研究报道富山武装乌贼和相拟钩腕乌贼的资源生物量,同时富山武装乌贼通常是日本萤乌贼(Watasenia scintillans)渔业的重要兼捕对象[3],并且富山武装乌贼和相拟钩腕乌贼均是太平洋蓝鳍金枪鱼(Thunnus orientalis)[10]、大眼金枪鱼(Thunnus obesus)[11]和大青鲨(Prionace glauca)[12]等海洋生物的重要食物组成。此外,对富山武装乌贼和相拟钩腕乌贼的生物学认知仅有报道对其仔稚鱼的辨识[1,4]。为此,本研究通过对“淞航”号远洋综合调查船执行“2019 年度中国近海及西北太平洋中上层渔业资源与环境要素调查航次”任务在西北太平洋采集的富山武装乌贼和相拟钩腕乌贼样本的多度及体型的空间分布差异、体质量与胴长关系及体征变化等进行研究分析,以期认知它们的生物生态学特性,为掌握西北太平洋枪乌贼类种群分布及其生物学特性提供资料参考。
1 材料与方法
1.1 采样海域和采样时间
富山武装乌贼和相拟钩腕乌贼样本,来自“淞航”号远洋综合调查船“2019 年度中国近海及西北太平洋中上层渔业资源与环境要素调查航次”期间在西北太平洋采集的海洋生物样本。样本采集时间为2019 年9 月5-9 日,采样网具为调查船上的四片式中层拖网,主尺度434 m × 97.1 m(44.98 m),网口水平扩张约30 m、垂直扩张约30 m,采集海域为34.72-38.76 °N、148.04-150.22 °E(图1),每个站点拖网时长约120 min。共采集富山武装乌贼92 尾,相拟钩腕乌贼57 尾(表1)。样本经调查船实验室-80 ℃冷冻保存后,运回岸上实验室进一步处理分析。

表1 富山武装乌贼和相拟钩腕乌贼的胴长、体质量Table 1 Mantle length and body weight of Enoploteuthis chunii and Abralia similis
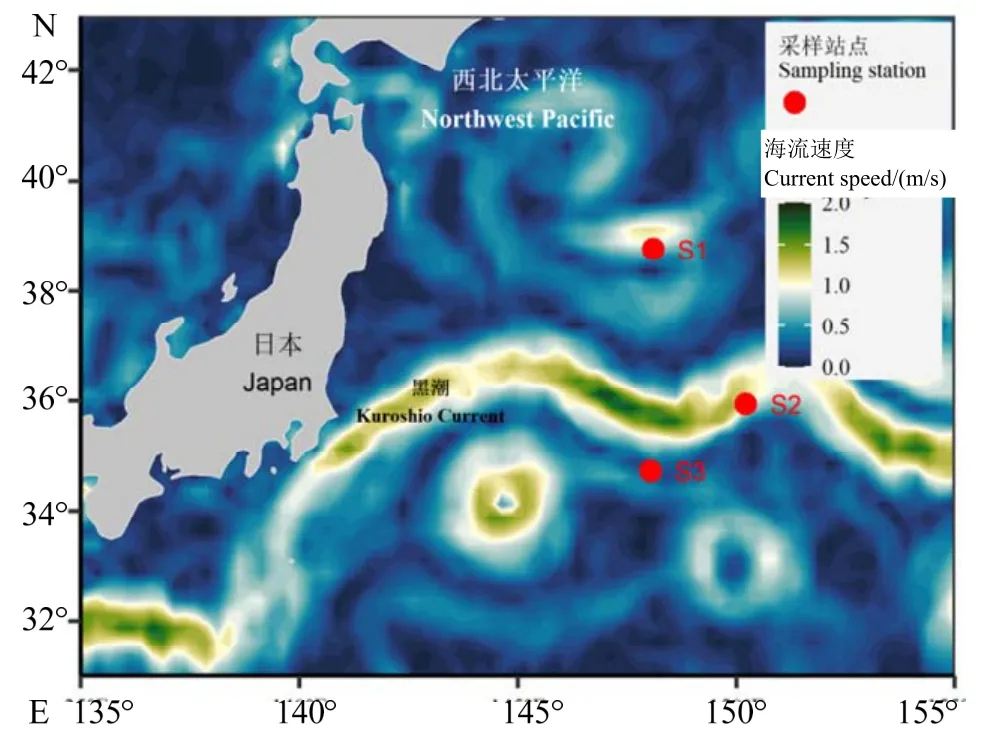
图1 西北太平洋海域采样站点Fig.1 The sampling stations in the northwestern Pacific Ocean
1.2 体质量、胴长测定
富山武装乌贼和相拟钩腕乌贼样本在实验室常温解冻后,进行生物学数据测定。分类特征参考JEREB 等[3]和陈新军等[13]对富山武装乌贼和相拟钩腕乌贼分类描述。生物学测定内容包括胴长(mantel length,ML)、体质量(body mass,BM)、性腺成熟度。胴长测量精确至1 mm;体质量测量精确至1 mg。性腺成熟度划分标准参考国际海洋考察理事会(International Council for the Exploration of the Sea,ICES)对枪形目种类的划分标准,共划分为I~V 期。其中,I 期为未发育期,II 期为开始发育期,III 期为生理性发育成熟期,IV 期为功能性成熟产卵期,V 期为衰败退化期。经观察分析,富山武装乌贼样本性腺发育均为I~II 期,相拟钩腕乌贼仅6 尾样本处于III 期,其余均为I~II 期。因此,在数据分析中将不考虑样本的性腺发育成熟度。
1.3 数据处理
1) 从美国NOAA 海洋监测门户网站下载采样海域的海表温(Sea surface temperature,SST;数据库 ID:CRW_sst_v1_0)和叶绿素 a 浓度(Chlorophyll a Concentration,Chla;数据库ID:aqua_chla_1d_ 2018_0)等水文环境数据,数据精度为0.05° × 0.05°,时间精度为1 d。考虑到样本采样站点可能与水文环境数据站点不一一对应,为此,以采样站点为中心点,对其距离最近4 点(上、下、左、右)的海表温、叶绿素a 浓度取平均值作为采样站点的SST、Chla。随后,计算每个采样站点在2019 年9 月5-9 日的SST、Chla 的范围及平均值。
2) 利用卡方检验方法(χ2),分析富山武装乌贼和相拟钩腕乌贼在不同采样站点的样本多度。计算分析富山武装乌贼和相拟钩腕乌贼的平均胴长、平均体质量。采用频率分布法分析两者的胴长组成,胴长组距为5 mm;计算优势胴长分布及其所占的比例。
3) 用幂函数拟合分析体质量与胴长的函数关系。根据体质量和胴长(BW-ML)的幂函数关系,求取残差并标准化。标准化残差值基于个体水平但独立于个体大小,反映个体体况特征,可作为个体的体征指标(body condition index,CI)[14-15]:负值表示体征不佳,正值表示体征良好。
4) 利用Pearson 相关性分别分析富山武装乌贼和相拟钩腕乌贼的体征与其体质量的相关性,探究体征随个体生长的变化。利用t检验方法,分析不同采样站点之间两者的体征差异性。
数据以平均值±标准差(Mean ± SD)表示,运用R 统计平台进行数据分析。Pearson 相关性、卡方检验、t检验等差异性显著水平为α=0.05。
2 结果
2.1 采样站点水文特征及样本多度分布
站点的位置分布显示,站点S1 处于黑潮的北面,站点S2 处于黑潮之上,而站点S3 则位于黑潮南面(图1)。站点S1 海表温为(25.53 ± 0.14)℃(25.10~ 25.72 ℃),叶绿素a 质量浓度为(0.11 ±0.01)mg/m3(0.01~ 0.15 mg/m3);站点S2 海表温为(28.47 ± 0.10)℃(28.29~ 28.67 ℃),叶绿素a 质量浓度为(0.08 ± 0.02)mg/m3(0.05~ 0.14 mg/m3);站点S3 海表温为(28.81 ± 0.03)℃(28.71~ 28.84 ℃),叶绿素a 质量浓度为(0.07 ± 0.01)mg/m3(0.05~ 0.08 mg/m3)(图2)。

图2 富山武装乌贼和相拟钩腕乌贼的多度分布及采样海域的海表温和叶绿素a 浓度分布Fig.2 The abundance distribution of Enoploteuthis chunii and Abralia similis among the sampling stations and the sea surface temperature and cholorophyll-a concentration in the survey area
分析显示,富山武装乌贼样本来自于站点S1和S2,且以站点S1 最为丰富(χ2=59.52,P< 0.05);相拟钩腕乌贼样本来自站点S1、S2 和S3,以站点S1 最为丰富(χ2=39.89,P< 0.05)。其中,富山武装乌贼和相拟钩腕乌贼两者在站点S1 的合计样本数为124 尾,各为83 尾和41 尾;在站点S2 的合计样本数为21 尾,各为9 尾和12 尾;在站点S3的样本数为4 尾,为相拟钩腕乌贼(图2)。
2.2 胴长和体质量组成
富山武装乌贼样本的胴长范围为11~ 49 mm,平均胴长为(27.8 ± 6.5)mm;体质量范围为276~5 775 mg,平均体质量为(2 539.8 ± 1 141.3)mg(表1)。不同的采样站点之间,胴长、体质量均存在显著差异(胴长,F=13.33,P< 0.05;体质量,F=30.28,P< 0.05),以采样站点S1 的个体体型较大,采样站点S2 的个体体型次之。相拟钩腕乌贼样本的胴长范围为10~36 mm,平均胴长为(20.5 ± 5.4)mm;体质量范围为345~ 2 761 mg,平均体质量为(1 152.3± 600.9)mg(表1)。相拟钩腕乌贼胴长、体质量亦在采样站点S1 处最大(胴长,F=4.04,P=0.02;体质量,F=5.28,P< 0.05),采样站点S3 的个体体型次之,采样站点S2 的个体体型最小。
胴长的频度分布法分析显示,富山武装乌贼和相拟钩腕乌贼的胴长均为单峰值区间分布(图3)。其中富山武装乌贼样本优势胴长组为20~ 35 mm,占样本总数的84.78%。相拟钩腕乌贼样本优势胴长组为15~ 25 mm,占样本总数的66.67%。

图3 富山武装乌贼和相拟钩腕乌贼的胴长分布Fig.3 The distribution of mantle length of Enoploteuthis chunii and Abralia similis
2.3 体质量与胴长关系
富山武装乌贼体质量(y)与胴长(x)的幂函数关系式为y=13.86 ×x1.54(r2=0.43,n=92,图4(a));相拟钩腕乌贼体质量(y)与胴长(x)的幂函数关系式为y=4.56 ×x1.81(r2=0.81,n=58,图4(b))。t检验显示,富山武装乌贼、相拟钩腕乌贼个体的体质量-胴长关系的b值均小于匀速生长假设的b=3,且与匀速生长假设存在显著差异(富山武装乌贼:t=-7.88,P< 0.05;相拟钩腕乌贼:t=-9.29,P< 0.05)。
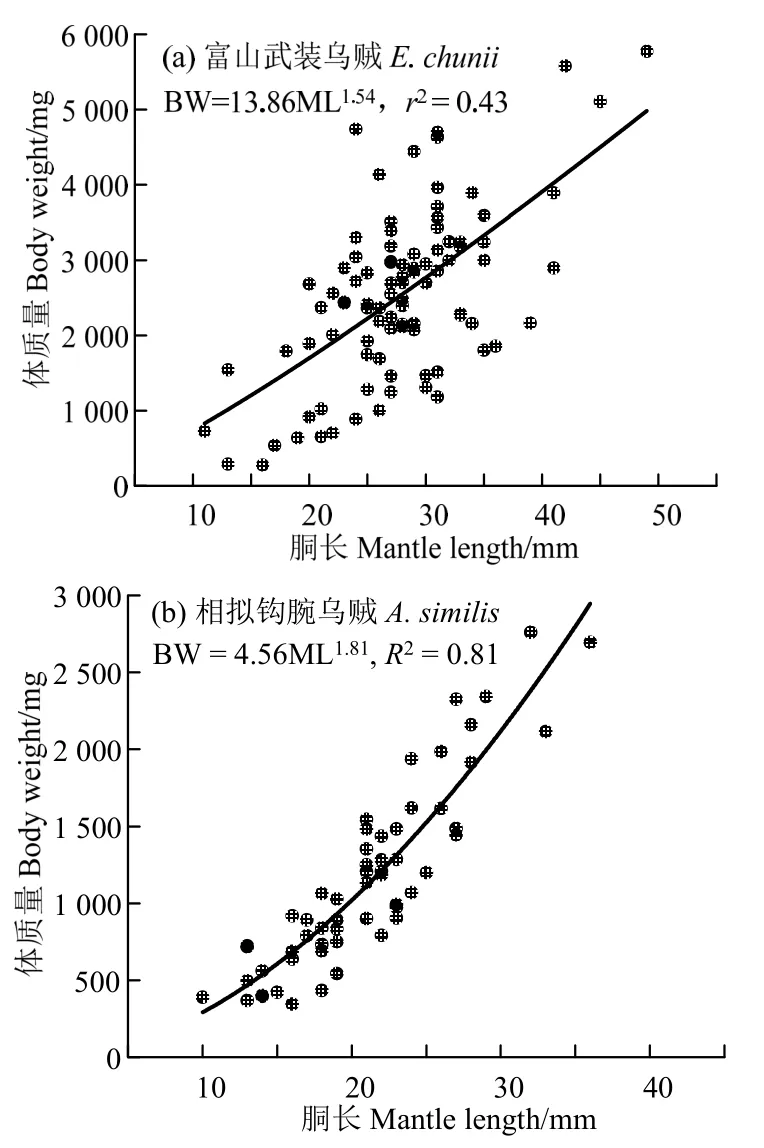
图4 富山武装乌贼和相拟钩腕乌贼的体质量与胴长关系Fig.4 Relationship between body weight and mantle length for Enoploteuthis chunii and Abralia similis
2.4 体征生长
Pearson 相关性分析显示,富山武装乌贼体征与体质量呈显著的正相关关系(图5(a);R=0.78,P< 0.05)。相类似,相拟钩腕乌贼个体的体征与其体质量则呈显著的正相关关系(图5(b);R=0.44;P< 0.05)。

图5 富山武装乌贼和相拟钩腕乌贼体征指标与体质量关系Fig.5 Body condition regression on body weight for Enoploteuthis chunii and Abralia similis
此外,富山武装乌贼在不同采样站点之间的体征存在显著性差异(F=13.89,P< 0.05)。其中,在采样站点S1 处平均体征为正值,质量较佳;在采样站点S2 处平均体征为负值,质量较差(图6)。同样,相拟钩腕乌贼在不同采样站点之间体征质量亦存在显著差异(F=3.11,P< 0.05)。其中,在采样站点S1 处体征质量较好,平均体征为正值;在采样站点S2、S3 处平均体征均为负值,体征质量较差(图6)。

图6 富山武装乌贼和相拟钩腕乌贼体征的采样站点分布Fig.6 Body condition distribution by sampling stations for Enoploteuthis chunii and Abralia similis
3 讨论
在西北太平洋,黑潮和亲潮作为著名的西边界流,影响着该海域及邻近海域的气候、生态系统,以及渔业活动[16]。亲潮为海域带来丰富的营养物质,并在亲潮-黑潮交汇海域形成重要的海洋生物索饵育肥场,拥有资源丰富且多样的海洋生物种类;黑潮水温较高,在其流经海域及邻近海域为海洋生物提供适宜的越冬及产卵孵化场[17]。本研究结果显示,位于黑潮以北的黑潮-亲潮过渡区上采样站点具有较低水温、较高的叶绿素a 浓度;在此站点,富山武装乌贼和相拟钩腕乌贼的分布最为丰富,而在黑潮水域及其南部水域采样站点的样本数量则偏少。该结果与其它海洋生物种类在黑潮-亲潮过渡区资源量丰富的结论相一致[17]。同时研究发现,不同采样站点之间的富山武装乌贼和相拟钩腕乌贼体型(胴长和体质量)均存在显著性差异,且两者均以黑潮以北黑潮-亲潮过渡区上的个体体型最大,黑潮水域和南部水域的体型则较小。因为本次采集的富山武装乌贼和相拟钩腕乌贼均处于性腺发育前期,所以这些结果表明两者均可能利用黑潮-亲潮过渡区作为索饵育肥场。
富山武装乌贼和相拟钩腕乌贼的体质量与胴长关系呈显著的幂函数关系,结果与其它头足类体质量-胴长的幂函数关系相一致[18-20]。然而,富山武装乌贼体质量-胴长的幂函数关系的拟合r2偏低。这可能是函数拟合中没有进行富山武装乌贼雌性、雄性样本区分,且雌性和雄性个体的体质量-胴长生长存在较大差异所导致,具体原因仍需在后续调查中加强雌性和雄性个体生长发育的研究。类似于鱼类质量-体长幂函数关系,头足类鞘亚纲种类体质量-胴长幂函数关系的亦可以反映其生长发育不均匀性特点[20]。这种生长发育的不均匀性往往是由于体质量和胴长不均匀增长所致,表现出正异速生长、负异速生长,或者匀速生长,在体质量-胴长幂函数关系式(BM=a× MLb)上则分别表示为b> 3,b<3 和b=3[21]。本实验富山武装乌贼和相拟钩腕乌贼的体质量-胴长幂函数关系式b值分别为1.54 和1.81,均显著小于b=3 的假设,说明这两者的生长发育为负异速生长。通常,鱼类在幼鱼阶段多呈强的异速生长,b值小于3,随着个体生长,异速性逐渐减弱,生长发育趋向均匀[21]。因此,两者体质量-胴长幂函数关系式b值显著小于3的结果与其处于性腺成熟度I~II 期的发育时期(见“材料与方法”)是相一致的,表明这些个体正处于生长发育阶段。
基于残差分析的体征显示,富山武装乌贼、相拟钩腕乌贼个体的体征与体质量呈显著正相关关系,表明两者的适合度与其体质量增长密切相关。通常,头足类肌肉组织是最大的能量存储单元[20,22-23],并在生殖投入过程中起着重要的角色作用[18,24]。比如,强壮桑椹乌贼(Onykia ingens)在生长发育过程中持续积累组织能量,保持较佳体征,繁殖产卵时则较快速转化肌肉组织能量用于配子的发生成熟,与此同时个体体征下降显著[18,25];阿根廷滑柔鱼和茎柔鱼生长发育过程也存在类似的体征变化情况,但是在繁殖产卵过程中保持一定的体征水平以完成多个批次的排卵活动[20,24]。因而,富山武装乌贼和相拟钩腕乌贼的体征与体质量的正相关关系,也一定程度上佐证了这两者正处于组织能量积累的生长发育时期。
此外,富山武装乌贼和相拟钩腕乌贼的体征在不同采样站点之间存在显著性差异,均以黑潮-亲潮过渡区上采集的样本个体体征为较佳,黑潮水域及其南部海域上采集的样本个体体征则较差(图1、6)。一般地,大洋性头足类的体征状况较大程度取决于其摄食能力[26]和栖息海域的食物丰富度[27]。比如,Pecl 等[28]发现海域生产力影响莱氏拟乌贼(Sepioteuthis australis)的体征状况,随之影响个体的捕食能力。Portner 等[29]也曾报道栖息在加利福尼亚海湾的茎柔鱼种群,体征较好、体型较大的个体往往出现在加利福尼亚海湾生产力较好的季节,并且以捕食营养层级较高的灯笼鱼类为主。西北太平洋黑潮-亲潮过渡区生产力高、饵料生物丰富,是海洋生物种类重要的索饵育肥场所[17]。因此,来自黑潮-亲潮过渡区的富山武装乌贼和相拟钩腕乌贼具有较佳体征应该与其较高海域生产力密切相关,并且这些个体较大的体型也为其具备较好捕食能力和环境适应能力提供了条件基础。同时,黑潮-亲潮过渡区海域较低水温也可能是原因之一,使得富山武装乌贼和相拟钩腕乌贼具有较低代谢速率、较多组织能量积累以支持生长发育。然而,这些个体体征具有较大的波动变化,并且尚未可知其摄食强度,后续仍需要加强样本采集和分析加以确证。
综上所述,本次调查的富山武装乌贼和相拟钩腕乌贼均以亲潮-黑潮过渡区的分布最为丰富,且个体体型也最大。两者体质量与胴长符合幂函数关系,拟合b值小于匀速生长b=3 的假设。此外,富山武装乌贼和相拟钩腕乌贼的体征均与其体质量呈显著的正相关关系,在饵料生物丰富的亲潮-黑潮过渡区两者均具有较佳体征。这些结果表明,本次采集的富山武装乌贼和相拟钩腕乌贼均处于负异速生长的生长发育期,两者利用黑潮-亲潮过渡区作为索饵育肥场。然而,本航次作业时间相对短、样本采集有限,后续仍需加强西北太平洋海洋生物资源的多航次、多季节的科学考察调查,深入开展这些种类的年龄生长、繁殖产卵和摄食生态等研究,为掌握西北太平洋大洋性枪乌贼类的种群分布及其生物学特性提供资料基础。
本研究调查和样本收集过程中,得到了“淞航”号远洋综合调查船长、全体船员、实验技术人员,以及参与调查的师生和自然资源部第三海洋研究所研究人员的大力支持,在此深表谢忱!

