罗非鱼SRA4 基因重组表达、亚细胞定位及组织分布
黄子威,汪志文,黎 源,夏洪丽,简纪常,鲁义善
(1.广东海洋大学水产学院// 2.广东省水产经济动物病原生物学及流行病学重点实验室// 3.广东省水产经济动物病害控制重点实验室,广东 湛江 524088;4.广东海洋大学深圳研究院// 5.广东省水生动物健康评估工程技术研究中心,广东 深圳 518000)
罗非鱼(Oreochromis)为慈鲷科罗非鱼属鱼类,原产非洲约旦,属热带性鱼类,有生长快、食性杂、疾病少、适应性强等特点[1],其肌肉富含蛋白质,多种维生素及微量元素,且肉嫩味美,深受人们喜爱[2]。但是随着养殖规模的扩大,病害频发,给罗非鱼产业造成了巨大的经济损失[3]。
A 类清道夫受体(SCARA)已在大黄鱼(Larimichtys crocea)、斑马鱼 (Danio rerio)、绿河鲀(Tetraodon nigroviridis)、鲤 (Cyprinus carpio)、斑点叉尾鮰(Ictalurus punctatus)等鱼类中被鉴定[4-7]。SCARA由巨噬细胞清道夫受体1(SCARA1)、有胶原结构的巨噬细胞受体(SCARA2)、细胞应激反应蛋白(SCARA3)、C型凝集素清道夫受体(COLEC12)和A类清道夫受体成员5(SCARA5)等5 个成员组成,其中A清道夫受体4(SCARA4)是唯一有C型凝集素 (CLECT) 结构域的蛋白[4]。SCARA4 参与巨噬细胞炎症反应,参与机体识别、清除病原细菌的免疫反应。但目前对于清道夫受体的研究主要集中于哺乳动物上,鱼类中的研究相对较少。而硬骨鱼中SCARA4 结构与功能与高等脊椎动物不尽相同[5,8-11],研究鱼类SCARA4 对鱼类病害防治有重要意义。已在虹鳟 (Oncorhynchus mykiss)[12]、鲤[8]和斑马鱼[5]中鉴定出SCARA4,并证实SCARA4 在抵抗病原入侵发挥重要作用[5,8]。目前,以水产动物为对象的研究报道相对较少,尚未见罗非鱼清道夫受体SCARA4 相关报道。本研究对罗非鱼SRA4基因(On-SRA4)进行克隆鉴定、亚细胞定位及定量分析,为获得rOn-SRA4 蛋白,进一步研究罗非鱼清道夫受体rOn-SRA4 奠定基础。
1 材料与方法
1.1 材料
实验用尼罗罗非鱼(Oreochromis niloticus)购自广东湛江东海岛研究基地,规格为(100±10) g。于水温 (28±2)℃,光照周期12 h/d,24 h循环水系统中暂养4 周后备用。无乳链球菌 (Streptococcus agalctiae) ZQ0910、HEK293T细胞均取自广东省水产经济动物病原生物学及流行病学重点实验室。
主要试剂:qPCR试剂盒 (TransStart Green qPCR SuperMix)、RNA提取试剂盒 (TransZol Up Plus RNAKit) 购自北京全式金公司,Premix ExTaq、克隆质粒Transt-T1 载体、DNA Marker、Quick限制性内切酶和反转录试剂盒 (Reverse Transcriptase M-MLV)购于TaKaRa 公司 (大连),DNA凝胶回收纯化试剂盒 (Thermo Scientific GeneJET) 和RNAlater购于Thermo公司;E.Z.N.A.Endo-Free plasmid DNA mini kit 试剂盒购于北京索莱宝科技有限公司。DH5α购自武汉转导生物实验室,引物由生工生物股份有限公司合成。
1.2 方法
1.2.1尼罗罗非鱼总RNA提取及cDNA合成 取健康罗非鱼6 尾,剖取鳃、脑、肌肉、中肠、头肾、脾、肝、胸腺、皮肤组织,尾静脉取血。按照全式金公司的TransZol Up Plus RNA Kit 说明书提取所有罗非鱼组织RNA,再参照反转录试剂盒Reverse Transcriptase M-MLV 说明书进行反转录,检测On-SRA4的组织分布。
1.2.2尼罗罗非鱼On-SRA4基因片段的扩增 从NCBI数据库获得On-SRA4基因序列,以罗非鱼头肾cDNA为模板,利用引物F与R (表1) 扩增获得On-SRA4编码区序列。PCR反应体系 (20 μL):PremixTaq10 μL,ddH2O 7.5 μL,cDNA模板0.5 μL,上下游引物各1 μL。PCR产物经凝胶电泳检测、目的条带切胶回收,连接至pMD-18T,转化至Trans5a感受态细胞。挑取单菌落进行菌落PCR检测,阳性菌送至生工生物工程股份有限公司广州测序部测序。

表1 引物名称及序列Table 1 Primers and their sequences
1.2.3On-SRA4胞外段原核表达载体构建 对测序正确的菌液和pET28a(+)提取质粒,将质粒在 37 ℃下双酶切15 min,纯化回收酶切后的目的片段。将回收的目的片段与载体片段用T4 连接酶于 4 ℃下连接12 h。将连接产物转入大肠杆菌DH5α 感受态,方法同1.3.2。采用T7(F)、T7(R) 进行菌落PCR鉴定,选取阳性克隆菌测序。对测序吻合的菌液提取质粒,并将提取的质粒转入大肠杆菌BL21 感受态。
1.2.4rOn-SRA4 的诱导表达 对构建的PET28a-OnSRA4 表达载体原核菌种12 h,活化,待菌液OD600nm值为0.6 时,取部分菌液于超净台瓶,加入异丙基硫代半乳糖苷(IPTG)至终浓度 1 mmol/L,另1 瓶不加IPTG,两瓶菌液均于摇床37 ℃、160 r/min条件下诱导5 h。收集诱导、未诱导菌液各2 mL,以12 000 r/min离心,弃上清液,沉淀用PBS重悬2 次,加入PBS重悬菌液50 μL,蛋白上样缓冲液10 μL,混匀。于100 ℃水中煮沸5 min,离心,取上清液(全菌蛋白)进行SDS-PAGE 电泳检测。
1.2.5尼罗罗非鱼On-SRA4生物信息学分析 用InterProScan (http://www.ebi.ac.uk/Tools/pfa/iprscan/)预测结构域,ExPASy (http://web.expasy.org/protparam/)分析理化性质。用SignalP 4.1 Server (http://www.cbs.dtu.dk/services/SignalP/)预测信号肽;利用在线软件SOPMA (https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)和SWISS-MODEL (http://www.expasy.org) 模拟二级结构和三维结构。用程序ClustalX对rOn-SRA4 氨基酸序列进行多重比对。用MEGA10.0 软件构建系统进化树。
1.2.6尼罗罗非鱼亚细胞定位分析 构建pDsRed-Mon-N1-SRA4 真核表达载体,限制性酶切位点为NotI与BamH。按E.Z.N.A.Endo-Free plasmid DNA mini kit试剂盒说明书提取真核表达去内毒素质粒。将HEK-293T细胞接种至24 孔板,培养18 h,分别转染质粒pDsRed-Mon-N1 和重组质粒pDsRed-Mon-N1-SRA4。孵育48 h,经PBS(pH=7)洗涤2 次,用体积分数4%多聚甲醛固定,PBS(pH=7)洗涤2 次。滴加1 μg/mL 4′,6-二脒基-2-苯基吲哚 (DAPI) 进行细胞核染色。用PBS(pH=7)清洗2 次,加入抗荧光猝灭封片剂封片,用激光共聚焦显微镜观察、拍照。
1.2.7尼罗罗非鱼攻毒实验 攻毒实验参照Han等[13]方法。取健康尼罗罗非鱼,随机分为3 组,每组21 尾,分别腹腔注射0.1 mL的1×107mL-1的灭活无乳链球菌、0.2 mg/mL的Poly I:C、无菌磷酸盐缓冲液 (PBS,pH=7,对照)。在0、6、12、24、48、72、96 h时分别取罗非鱼3 尾,剖取脾脏、胸腺、肠道和头肾,迅速放入RNAlater中,于–80 ℃冰箱中保存。按照全式金公司的TransZol Up Plus RNA Kit 说明书提取所有组织RNA,再参照反转录试剂盒Reverse Transcriptase M-MLV说明书进行反转录。
1.2.8尼罗罗非鱼On-SRA4表达分析 根据On-SRA4基因全长序列的保守区,用Primer Premier 5.0 设计引物qRT-SRA4-475F、qRT-SRA4-563R,对照组β-actin蛋白为管家基因。qRT-PCR反应体系(10 μL):引物 (10 μmol/L) 各0.5 μL,Mix 5 μL,ddH2O 2.5 μL,cDNA 0.5 μL。反应条件:95 ℃ 4 min;95 ℃20 s、56 ℃ 20 s、72 ℃ 20 s,40 个循环;95 ℃ 15 s。使用Light Cycler96 实验仪器,结果用2-ΔΔCt法计算,用GraphPad Prism 8 软件进行单因素方差分析。
2 结果与分析
2.1 罗非鱼On-SRA4 的克隆与序列分析
罗非鱼SRA4基因命名为On-SRA4(GenBank登录号:MZ031929),编码区序列全长2 289 bp,可编码762 个氨基酸(图1)。

图1 罗非鱼On-SRA4 及其推导的氨基酸序列Fig.1 Tilapia On-SRA4 and its deduced amino acid sequence
2.2 罗非鱼rOn-SRA4 氨基酸序列理化性质分析
理化性质分析表明,rOn-SRA4 蛋白可编码762个氨基酸,分子式为C3566H5678N1050O1156S34,其中甘氨酸 (Gly) 含量最高,占比10.2%,其次为异亮氨酸(Leu)(7.6%),带正电荷氨基酸为97 个,带负电荷氨基酸为80 个,理论分子质量为82.84 ku,等电点为5.37。不稳定指数为39.09,为不稳定蛋白,该基因编码蛋白质的理论亲疏水性(GRAVY)平均水平为 -0.675(图2),该蛋白质为亲水蛋白。蛋白跨膜结构分析发现,rOn-SRA4 蛋白在40~ 62位氨基酸存在一跨膜结构域(图3)。Signal P 5.0预测结果显示,该序列不存在信号肽。

图2 rOn-SRA4 蛋白亲水/疏水性预测Fig.2 Prediction of hydrophilicity/hydrophobicity of rOn-SRA4 protein
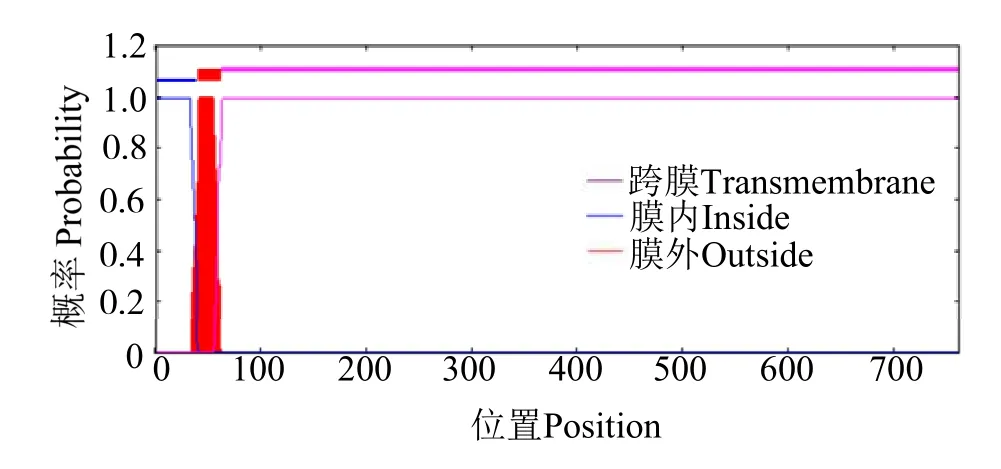
图3 rOn-SRA4 蛋白跨膜结构域预测分析Fig.3 Prediction of transmembrane domain of rOn-SRA4 protein
2.3 rOn-SRA4 蛋白质保守结构域与空间结构预测
图4(A)显示,rOn-SRA4 蛋白分别在第60~ 259位、174~ 437 位、456~ 518 和626~ 752 位存在典型的SMC结构域、SMC-PROK-A结构域、Collagen结构域和CLECT结构域,表明克隆的On-SRA4基因编码蛋白属于CLECT 超家族成员,二级结构预测结果(图4(B))显示,α螺旋在多肽链中为53.02%,无规则卷曲为35.43%,延伸链为7.74%,β转角为3.81%。该蛋白形三维结构呈简单三级结构(图4(C))。
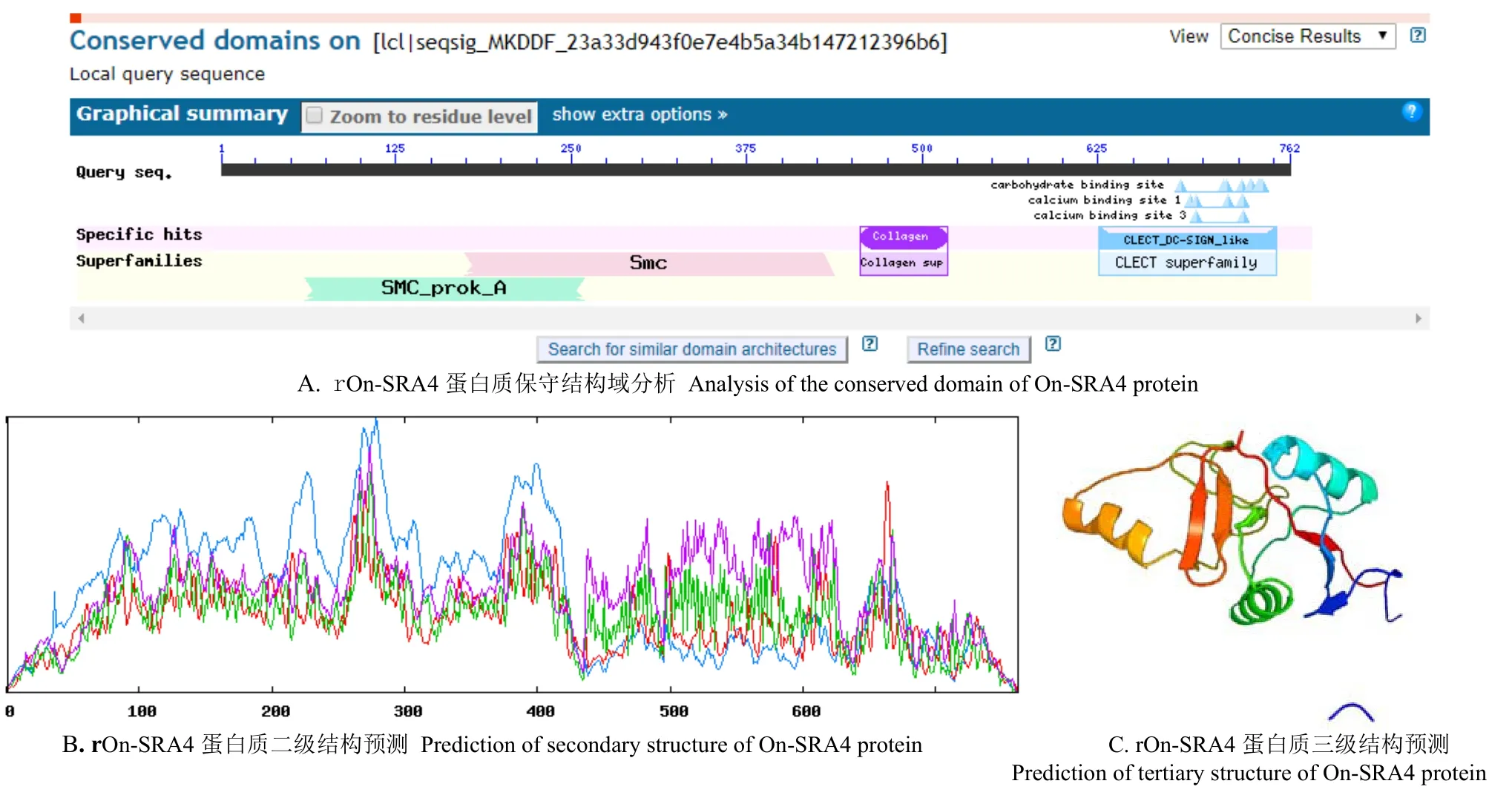
图4 rOn-SRA4 蛋白质保守结构域预测与空间结构分析Fig.4 Prediction of conserved domain and analysis of spatial structure of rOn-SRA4 protein
2.4 rOn-SRA4 蛋白序列表达特性与相关性分析
On-SRA4编码的氨基酸序列与NCBI数据库中其他物种rOn-SRA4 氨基酸序列的同源比对结果表明,rOn-SRA4 与布氏新亮丽鲷(Neolamprologus brichardi)、斑马拟丽鱼(Maylandia zebra)同源性较高,相似度分别为97.6%、96.7%,与尖吻鲈(Lates calcarifer)、大西洋鲑(Salmo salar)同源性较低,相似度分别为79.19%、58.6%,与现代人(Homo sapiens)同源性最低,相似度为49.3%(图5)。比对发现,rOn-SRA4 在鱼类中相对保守。

图5 罗非鱼rOn-SRA4 与其他物种rOn-SRA4 氨基酸序列比对Fig.5 Amino acid sequence alignment between tilapia rOn-SRA4 and other species

续图5(Continued)
2.5 rOn-SRA4 蛋白序列的进化分析
构建的系统进化树 (1 000 倍bootstrap) 表明,罗非鱼rOn-SRA4 与尖吻鲈(Lates calcarifer)聚为一支,亲缘关系最为接近,而在进化关系上远离哺乳动物(图6)。
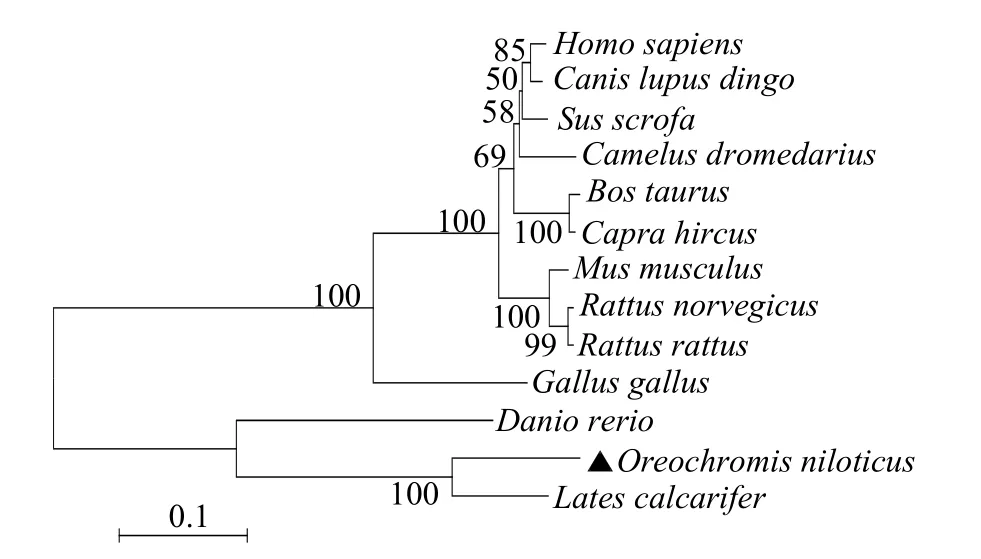
图6 N-J 法构建rOn-SRA4 氨基酸系统进化树Fig.6 Phylogenetic tree of rOn-SRA4 by neighbour-joining method
2.6 罗非鱼rOn-SRA4 亚细胞定位分析
亚细胞定位结果如图 7,在转染空质粒pDsRed-Mon-N1 的HEK-293T细胞中,Red红色荧光在全细胞分布,而融合蛋白Red-Mon-SRA4 的红色荧光在细胞核、细胞质上呈点状分布,表明罗非鱼rOn-SRA4 主要定位于细胞核与细胞质。

图7 罗非鱼rOn-SRA4 亚细胞定位Fig.7 Subcellular localization of rOn-SRA4 in tilapia
2.7 罗非鱼On-SRA4 基因组织表达分析
图8 表明,On-SRA4在罗非鱼各组织中均有表达,在血液中表达量最高,其次是肠道、肌肉、皮肤、肝脏、胸腺,而头肾、脑、鳃、脾脏表达量较低。

图8 罗非鱼On-SRA4 的组织表达Fig.8 Expression of On-SRA4 in different tissues of tilapia
2.8 罗非鱼On-SRA4 时序表达
2.8.1罗非鱼免疫后On-SRA4的表达 用灭活的无乳链球菌刺激健康罗非鱼,罗非鱼On-SRA4基因在肠道、胸腺、脾脏、头肾的表达呈显著性上调,呈现时序性表达,头肾、脾脏的表达量在96 h 达到最高 (P< 0.01),其余时间表达量较低,肠道表达量在48 h 达到最高 (P< 0.01),胸腺表达量在24 h达到最高 (P< 0.01)(图9)。

图9 无乳链球菌感染后罗非鱼On-SRA4 在各个组织中的时序表达Fig.9 Time-sequence expression of On-SRA4 in various tissues oftilapia infected with Streptococcus agalactiae
2.8.2Poly I:C病毒类似物刺激后罗非鱼On-SRA4的表达变化 图10 显示,Poly I:C病毒类似物刺激后,罗非鱼SRA4基因在肠道、胸腺、脾脏、头肾的表达量均显著上调,在肠道中刺激24 h时表达量最高;脾脏、胸腺均在6 h达到最高,随后降低;在头肾中

图10 Poly I:C病毒类似物感染后罗非鱼On-SRA4 在各个组织中的时序表达Fig.10 Time-sequence expression of On-SRA4 in various tissues of tilapia infected with Poly I:C
24 h表达量最高(P<0.01),其余时间表达量较低。
2.9 rOn-SRA4 原核表达鉴定
图11 可见,未诱导的rOn-SRA4 在80 ku处未出现明显条带,经IPTG诱导后在约80 ku处出现条带,与预测蛋白质大小一致,表明该蛋白诱导表达获得成功,rOn-SRA4 在上清中表达量较低,主要在包涵体中表达。蛋白印迹实验显示,该蛋白质为目标蛋白。
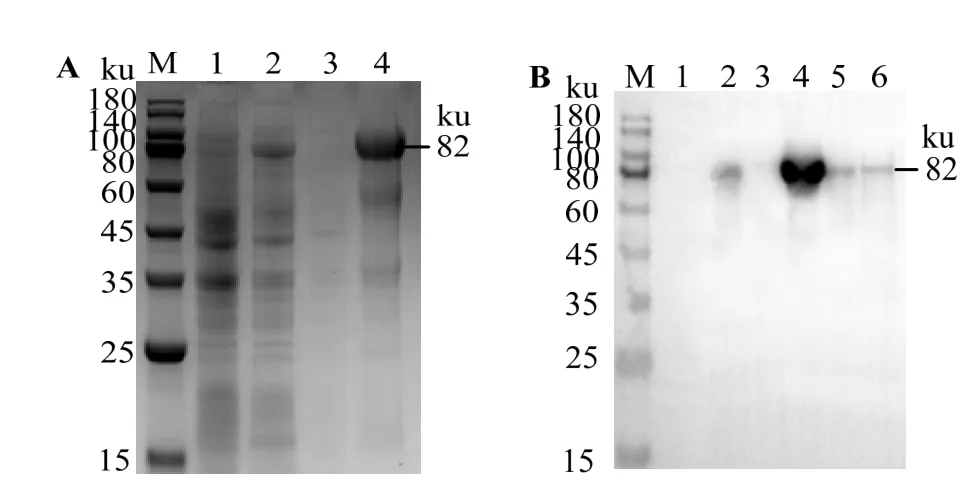
图11 重组蛋白rOn-SRA4 原核表达鉴定Fig.11 Prokaryotic expression identification of the recombinant protein rOn-SRA4
3 讨论
本研究克隆的罗非鱼SRA4(On-SRA4)序列编码区长2 289 bp,可编码762 个氨基酸,理论分子质量为82.84 ku,与人类SRA4大小接近。On-SRA4为亲水蛋白,在第456~ 518 位氨基酸有A类清道夫受体特有的胶原样结构域,在第626~ 752 位氨基酸有与人、鸡等类似的CLECT结构域[4,14]。人类SRA4 的CLECT结构域(607~ 732 位氨基酸)在结构上与罗非鱼高度相似,可识别、吞噬低密度脂蛋白等带负电荷大分子物质或大肠杆菌等病原微生物[15]。与人类不同的是,rOn-SRA4 有染色体ATP酶结构域(SMC),该结构与细胞增殖调控相关。亚细胞定位显示,rOn-SRA4 主要在293T细胞核、细胞质上呈现点状分布。因此,rOn-SRA4 主要定位于细胞核和细胞质上,在进化上相对保守,可能有识别、吞噬病原微生物及调控细胞周期的功能。
在哺乳动物中,SRA4主要表达于吞噬细胞、血管内皮细胞[16-18],可识别某些真菌、细菌并介导吞噬反应[18-19],是诱导先天免疫和炎症反应中不可或缺的受体之一[20]。鱼类SRA4有先天免疫[6,11]、清除病原体[9,11,12,21]及在非特异性细胞毒性细胞[22]表面表达的功能。在斑马鱼中,SRA4在血管母细胞中表达,参与血小管和血管生成[5]。本研究中,On-SRA4在健康罗非鱼所有组织中均有表达,但主要在血液和肠中表达。罗非鱼血液中含红细胞、吞噬细胞等多种免疫细胞。吞噬细胞主要发挥吞噬病原作用。罗非鱼红细胞转录组中含有大量模式识别受体,炎症因子、受体,抗原提呈、处理分子等[23]免疫基因,是发挥免疫作用的重要组成部分。因此,推测On-SRA4与斑马鱼cl-p1(SRA4) 一样在血管母细胞中表达,在血液中发挥识别、吞噬病原的作用。
鱼类的免疫器官与组织主要有胸腺、肾脏、脾脏[24]。本研究中,健康罗非鱼在灭活无乳链球菌刺激后,肠道、脾脏、头肾、胸腺On-SRA4表达量均显著上调,表明On-SRA4可被无乳链球菌所诱导,在罗非鱼免疫抗感染过程发挥作用。同时,健康罗非鱼在Poly I:C 病毒类似物刺激后,肠道、脾脏、头肾、胸腺的On-SRA4表达量均显著上调,脾脏中的表达量在刺激后6 h 即达最高值。脾脏、肠道和头肾在罗非鱼免疫中发挥重要作用,同时脾脏是T细胞分化成熟场所,因此,On-SRA4可被病毒类似物诱导表达,在罗非鱼抗病毒感染过程中发挥作用。
原核蛋白表达系统有在短时间内获得大量重组蛋白等优点,因而广泛应用于各种研究[25]。本研究用大肠杆菌原核表达系统,在1 mmol/L IPTG,37 ℃、160 r/min 条件下诱导5 h,成功诱导了rOn-SRA4 的表达,该蛋白主要表达于包涵体中。因膜蛋白在原核载体中表达多呈现为不溶性包涵体,需进一步优化表达条件,获取该蛋白制作多克隆抗体及进行体外细菌感染实验,以探究其识别、吞噬病原微生物及调控细胞周期的功能。
4 结论
对罗非鱼On-SRA4进行重组表达、亚细胞定位及组织分布分析,发现On-SRA4主要定位于细胞质与细胞核,在鱼类中较为保守,在各组织中均有表达,血液中表达量最高,无乳链球菌与病毒类似物刺激均可引起罗非鱼On-SRA4表达量上调。因此,On-SRA4参与病原引起的免疫反应,是罗非鱼抵抗病原的相关基因。原核表达系统为后续该蛋白的功能研究奠定基础。

