承德地区无偿献血者人类免疫缺陷病毒血清学和核酸检测的相关性
刘明丽 金凤梅 周静江 曹宇霏 马清杰 王尉 刘哲 陈利娜 阎泽君
人类免疫缺陷病毒(human immunodeficiency virus,HIV)是一种严重威胁人类安全的病原体,能特异性攻击人体免疫系统(特别T淋巴系统),造成人体免疫系统不可逆性缺陷,诱发各种机会性感染及肿瘤发生率,严重影响患者身心健康和生命安全[1,2]。其常见传播途径包括性接触传播、血液传播、母婴传播,血液传播是HIV传播的主要途径,如何降低输血传染性残余风险、保障输血使用安全,是全社会共同关注的问题[3]。因HIV检测“窗口期”较长、病毒变异、免疫静默感染等因素的影响,酶联免疫吸附试验(enzyme linded immunosorbent assays,ELISA)检测有“弱阳性标本”漏检的风险[4,5]。核酸检测(nucleic acid test,NAT)通过扩增靶核酸或其携带的特异性DNA或RNA片段,可将极微量的核酸转化为直观的光电等可视信号,能有效缩短病毒检测“窗口期”,提高检测效能[6,7]。ELISA、NAT联合筛查已成为我国采供血机构HIV的筛查策略,能够提高HIV检出率、减少血液资源浪费、保障输血安全[8,9]。本文通过回顾性分析2018至2019年承德市中心血站77 886例无偿献血者血液样本相关检测数据,以蛋白印迹法(westem blot,WB)为“金标准”,探讨ELISA、NAT在检测HIV中的应用价值,旨在为基层中心血站HIV检测提供参考。
1 对象与方法
1.1 调查对象 回顾性分析2018至2019年承德市中心血站77 886例无偿献血者血液样本相关检测数据,所有献血者健康体检符合中华人民共和国卫生和计划生育委员会等《BG18467-2011献血者健康检查要求》[10]标准。男46 594例,女31 292例;年龄21~56岁,平均(35.64±6.12)岁。其中初次献血者49 675例,≥2次献血者28 211例。
1.2 标本采集 每位献血者采集3管5 ml血液标本,4 h内3 000 r/min离心10 min取血清,保存于2℃~8℃下,72 h完成相关检测。
1.3 试剂与仪器 (1)第3代ELISA检测试剂盒购自英科新创(厦门)科技有限公司,第4代ELISA检测试剂盒购自北京万泰生物药业股份有限公司,NAT检测试剂上海科华生物工程有限公司;WB试剂盒购自新加坡MP生物医学亚太私人公司。(2)离心机:德国Sigma公司Sigma-6K15型;全自动加样仪:瑞士HAMILTON公司STAR 8CH型;全自动酶免分析系统:瑞士MAMILTON公司FAME24/20、FAME24/30、深圳爱康Uranus AE 280;核酸检测系统:瑞士HAMILTON公司STAR提取系统、ABI7500扩增仪。
1.4 检测方法 (1)血清学检测:采用第3代、第4代ELISA进行HIV抗原或抗体检测,两种ELISA检测试剂均呈无反应性则判定该标本为ELISA无反应性。任意1种试剂呈阳性反应,采用该试剂进行双孔复试,双孔复试均有阳性反应或单孔有阳性反应,则判定为ELISA反应性;如2种试剂均呈阳性反应性则判定为ELISA反应性。(2)病毒核酸检测:采用PCR-荧光法进行核酸检测,检测模式采用混样-折分模式或单样本检测。如混样出现反应性则进行拆分检测,若仍有反应性且ELISA有反应,则送至承德市疾病预防控制中心进行WB确认,若仍有反应性且ELISA无反应性,则进行追踪检测。
1.5 统计学分析 应用SPSS 20.0统计软件,所有计数资料以频数或率表示,采用χ2检验或秩和检验,P<0.05为差异有统计学意义。
2 结果
2.1 ELISA、NAT检测反应性及WB确证结果分析 77 886份样本中,第3代ELISA单试剂反应性35例,反应率0.45‰;第4代ILISA单试剂反应性41例,反应率0.57‰;第3、4代ELISA双试剂反应性28例,反应率0.36‰;NAT反应31例,反应率0.40‰;WE确证29例,确证率0.37‰。见表1。

表1 2018至2019年无偿献血者ELISA、NAT检测反应及WB确证结果 例(‰)
2.2 NAT反应性与ELISA检测单双反应性符合率分析 NAT与第3代、4代ELISA单试剂与双试剂反应性有良好的阳性及阴性符合率。见表2。
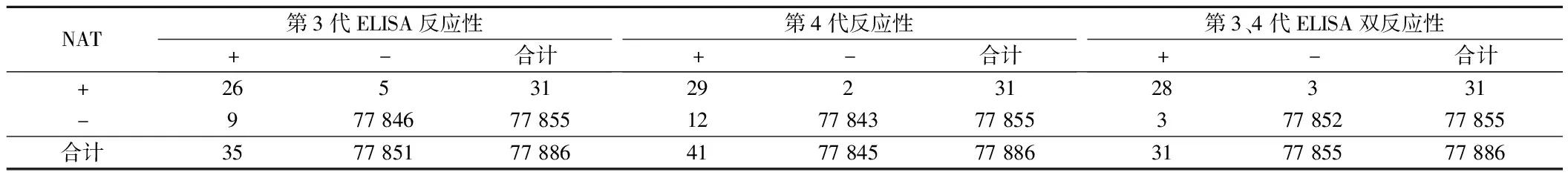
表2 NAT反应性与与ELISA检测单反应性、双反应比较 例
2.3 NAT反应与ELISA检测总反应性分析 107例反应性样本中,NAT检出31例,ELISA检出104份。其中NAT在ELIAS无反应性样本中检出3例,WB确认2例,ELIAS检测HIV残余风险为1:38943。NAT(+)ELISA(+)、NAT(+)ELISA(-)检出率高于ELISA(+)NAT(-)检出率(χ2=89.204,33.739,P<0.05)。见表3、4。
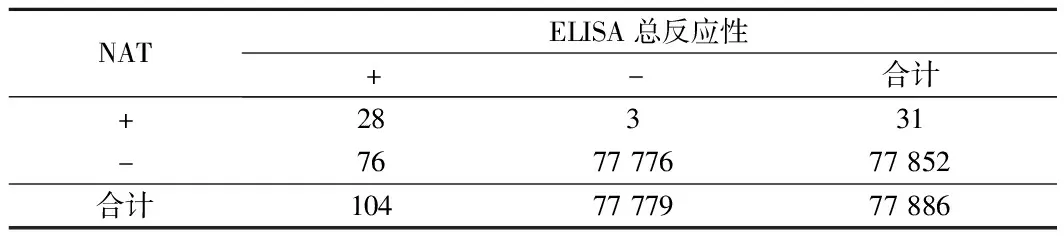
表3 NAT反应性与ELISA检测总反应性比较 例
2.4 ELISA单反应性及NAT反应性检测效果分析 以WB确证结果为“金标准”,第3代ELISA单反应灵敏度、特异度分为为82.7586%、99.9859%,第4代ELISA单反应灵敏度、特异度分别为86.2069%、99.9794%,NAT反应性灵敏度、特异度分别为96.5517%、99.9961%。NAT反应性灵敏度高于第3代ELISA单反应灵敏度(χ2=4.062,P<0.05),特异度高于第3代、第4代反应特异度(χ2=5.401,8.896,P<0.05)。见表5。

表4 NAT与ELISA检测反应者验证结果 例
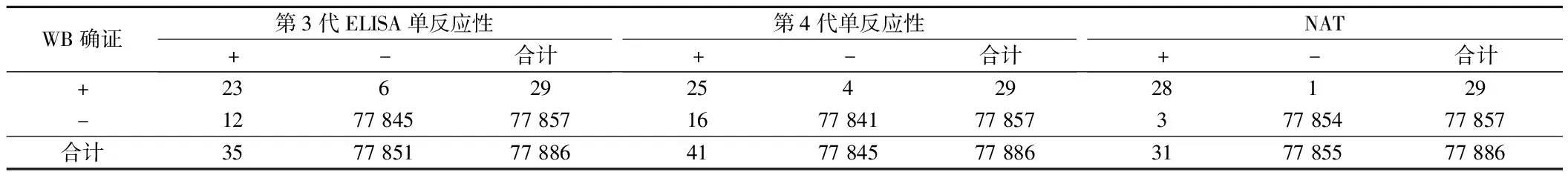
表5 ELISA单反应性与NAT反应性检测效果
3 讨论
我国无偿献血人数和采血量已保持连续23年增长,2018年献血人次高达1 500万[11],如何保证血液安全特别是血液本身质量的安全,是全社会共同关注的问题。血液传播是各类传染病感染的一种重要途径,输血也成为传染病传播的一种特殊方式。加强无偿献血者血液筛查力度,能够有效防范因输血罹患传染病的风险[12]。我国《血站技术操作规程(2019版)》[13]检测策略明确要求,HIV感染标志物应至少各进行1次核酸、血清学检测,抗HIV阴性血液才可以应用于临床。
ELISA为免疫学经典检测实验,将可溶性抗原或抗体结合到聚苯乙烯等固相载体表面,借助抗原抗体特异性免疫反应,进行定性定量检测。ELISA是血液HIV感染常用筛查方法,广泛应用于我国各级中心血站血液检测中。其特点是检测快速、灵敏度较高、费用较低。尽管ELISA技术已经发展到第四代,但检测HIV抗体“窗口期”仍为22 d[14,15]。ELISA检测目标为血液中病毒抗原,如果病毒仍处于“窗口期”,ELISA难以进行有效检测,HIV“窗口期”较长,ELISA检测易出现漏诊风险[16]。同时病毒滴度、免疫沉默性感染、病毒变异等各种因素的影响,ELISA检测仍存在输血相关感染的风险。本文研究中,77 779份ELIAS无反应性样本中,NAT检出3例,WB确认2例,ELIAS检测HIV残余风险为1∶38 943。低于吴敬林等[17]报道的1∶32 605(广西柳州),高于陈艳萍[18]报道的1∶67 307(深圳地区),可能与不同地区HIV感染情况、献血人群组成、数据采集时间段等因素有关,但能够说明因HIV感染“窗口期”较长,ELISA检测易发生漏检,仍有输血残余风险发生的可能。
NAT也称病毒核酸扩增技术,利用DNA“高温变性、低温复性、中温延伸”的变化规律,95℃变性为单链,60℃左右引物与单链按碱基互补配对,72℃(DNA聚合酶最适反应温度)DNA聚合酶沿磷酸到五碳糖方向合成互补链。可使DNA迅速扩增,极大缩短检测窗口期(22 d缩短为11 d)[19]。利用物理、化学、生物学等方法,直接扩增靶核酸或携带的特异性DNA或RNA片段,使肉眼不可见的极微量核酸转变为直观光电或可视信号,以检测标本中是否存在相应病原体[20]。不论是聚合酶链反应(PCR)、转录介导扩增(TMA)、核酸序列依赖扩增(NASBA),均能够至少缩短HIV感染“窗口期”7 d以上,这样可以筛查早期急性病毒感染的献血者,进一步降低经输血传播疾病的风险[21,22]。而且NAT反应性、ELISA反应性与WB确认有良好的符合关系[23]。本文研究中,NAT(+)ELISA(+)检出符合率92.86%(26/28)、NAT(+)ELISA(-)检出符合率66.67%(2/3)高于ELISA(+)NAT(-)检测符合率1.32%(1/77)(χ2=89.204,33.739,P<0.05)。所得结论也支持上述文献观点。
进一步分析表明,77 886份样本中,第3代ELISA反应性35例,第4代ILISA反应性41例,第3、4代ELISA双反应性28例,NAT反应31例。以WE确证(29例)为金标准,第4代ELISA灵敏度86.2069%略高于第3代ELISA 82.7586%,差异无统计学意义(P>0.05),与何成涛等[24]文献报道基本相似。同时NAT反应性灵敏度96.5517%高于第3代ELISA 82.7586%,特异度99.9961%高于第3代ELISA 99.9859%、第4代ELISA 反应99.9794%(P<0.05)。湛玉武[25]也有类似的文献报道,说明NAT筛查HIV效能优于ELISA。需要指出的,NAT检测对象为RNA,RNA提取与保存是最难控制的环节,操作过程中易受到污染,极其微量的污染就会出现假阳性率和复测无反应性等问题[26,27]。因此建议基层血站在筛查HIV感染中,尽量采用ELISA联合NAT检测,以提高诊断检测准确率。
相关研究表明,NAT与ELISA在血液筛查中有较好的互补性[28,29]。(1)ELISA以病原体抗原、抗体为检测对象,病毒进入体内产生能够检测的抗体需要较长时间,明显延长了检测窗口期。NAT技术以病原体核酸为检测对象,可缩短窗口期漏检误检风险。(2)外周血中病原存在间歇性现象导致病毒载量降低,若低于NAT检出水平,也会导致NAT漏检风险。而窗口期延长病毒感染会增加血液中抗体或抗原体滴度,不会影响ELISA检出水平[30,31]。(3)抗体需要免疫应答才能产生,当机体对病原体刺激无应答反应时,会增加相应抗体ELISA漏检的风险。NAT以病原体核酸为检测对象,不受免疫静默感染的影响[32]。(4)ELISA通过抗原体反应识别“靶目标”,NAT依靠引物与探针识别“靶目标”,二者均难以保证病毒变异的检出率[33]。也就是说,ELISA、NAT在HIV筛查中均由自己的局限性,同时两种方法也有良好的互补性,这也NAT联合ELISA能够提高HIV检出率的理论基础。
本文研究结果表明,NAT反应性、ELISA反应性与WB确证有良好的符合关系,NAT检测能够缩短检测“窗口期”,与ELISA平行检测能够降低HIV残余风险,保障输血使用安全性。需要指出的是,本文仅为单中心回顾性研究,也未对ELISA单反应性、双反应性残余风险的分析,同时也未进行ELISA、NAT联合检测HIV的比较。需要后续扩大样本、进行多中心前瞻性研究,以获取更客观、更有说服力的结论,为基层血站制定血液检测策略提供参考。

