哌拉西林他唑巴坦对类鼻疽伯克霍尔德菌的体外抗菌活性评估*
黄梅会,吴华,周晓君,王旭明
(海南省人民医院 海南医学院附属海南医院检验科,海口 570311)
类鼻疽病是由类鼻疽伯克霍尔德菌(Burkholderiapseudomallei,B.pseudomallei)所致的人畜共患病。该病主要分布于南北纬20°之间的热带和亚热带地区,如东南亚和澳洲北部地区[1]。海南岛是我国南部最大的热带岛屿,与泰国、越南、老挝等类鼻疽病高发国家临近,其高温潮湿的热带季风气候使海南岛成为B.pseudomallei的主要疫源地。类鼻疽病的临床表现复杂多变,有“似百样病”之称。由于该菌能在吞噬细胞内存活,故引起的慢性感染症状与结核分枝杆菌感染相似,当细菌入血时,可形成菌血症以及内脏脓肿。根据国际治疗指南[2],强化阶段静脉注射头孢他啶或美罗培南至少2周(危重病人需进行长期强化治疗),根除阶段口服抗菌药物(首选药物复方磺胺甲噁唑,其次是阿莫西林克拉维酸或强力霉素)至少3个月。然而,最近有来自世界不同类鼻疽病流行国家(包括邻国印度)的B.pseudomallei对头孢他啶、复方磺胺甲噁唑和阿莫西林克拉维酸耐药的报道[3-4]。哌拉西林他唑巴坦抗菌谱广,注射后组织渗透力强,体液血药浓度分布高的特点,目前临床应用广泛,但鲜见用于B.pseudomallei感染的治疗。其主要原因是目前美国临床实验室标准化委员会(Clinical and Laboratory Standards Institute,CLSI)还没有评估该抗菌药物对B.pseudomallei的敏感性,体外药敏报告上没有该抗菌药物的药敏结果,无法选其进行治疗。另外,经验性治疗又缺乏临床数据的总结。本研究通过对109例住院患者类鼻疽病治疗过程进行回顾,发现2例患者使用哌拉西林他唑巴坦治疗获得成功,引发我们对其体外抗B.pseudomallei活性的关注。目前国内外关于B.pseudomallei对哌拉西林他唑巴坦的研究相对较少。Dutta等[5]发现B.pseudomallei对哌拉西林他唑巴坦均敏感,而赵梅等[6]的结果显示哌拉西林他唑巴坦的敏感性很高,其中21例患者使用了哌拉西林他唑巴坦联合左氧氟沙星抗类鼻疽治疗。基于上述信息,本研究应用E-test药敏法比较收集自海南省人民医院的109株B.pseudomallei对哌拉西林他唑巴坦、美罗培南(EUCAST敏感性判断标准[7])和亚胺培南、强力环素、阿莫西林克拉维酸、四环素、复方磺胺甲噁唑(CLSI敏感性判断标准[8])的最低抑菌浓度(minimum inhibitory concentration,MIC),为临床应用提供理论依据,并为类鼻疽病的治疗提供额外选择。
1 资料与方法
1.1资料
1.1.1菌株来源 收集2010年6月至2018年5月海南省人民医院类鼻疽病确诊患者各类标本中分离培养的B.pseudomallei菌株109株,并进行E-test法药敏试验。其中,70株来源于血液标本,8株来源于痰标本,5株来源于尿标本,26株来源于脓性分泌物标本。
1.1.2抗菌药物 亚胺培南、美罗培南、阿莫西林克拉维酸、头孢他啶、四环素、哌拉西林他唑巴坦、强力霉素及复方磺胺甲噁唑E-test试纸条(温州市康泰生物科技有限公司)。
1.1.3培养基 Mueller-Hinton琼脂培养基(M-H培养基,江门凯林公司),5%哥伦比亚羊血平板(郑州安图生物公司)。
1.1.4主要仪器 Vitek 2 compact(软件版本为VT2.R7.01)细菌分析仪及配套细菌鉴定GN卡、麦氏比浊仪、麦氏管、Vitek MS(法国生物梅里埃公司)。
1.2方法
1.2.1菌株鉴定 所有菌株采用Vitek 2 compact VT2.R7.01版本的GN卡进行初步鉴定,然后利用基质辅助激光解吸电离飞行时间质谱技术复核,最后将菌株送往中国疾病预防控制中心传染病预防控制所采用多位点序列分型[9]进行确认。
1.2.2E-test药敏试验 将109株B.pseudomallei从-80 ℃超低温冰箱中取出并复苏,转种于5%哥伦比亚羊血平板上,置于35 ℃培养箱中培养24 h,再将其配制成0.5麦氏浊度单位浓度菌液,按照CLSI推荐的标准纸片药敏试验涂抹法用棉签蘸取适量菌液,将菌液于不同角度涂布于M-H培养基上(M-H培养基在使用前先置于35 ℃培养箱中培养15 min,使其表面干燥),涂布完成后将试纸条具有锯齿形凹端朝下(此端含有不同药物浓度的药物),垂直插入培养基中,一个9 cm的M-H琼脂平板可放入4条E-test试纸条,4条E-test试纸条按照十字形排列,然后将放入E-test试纸条的M-H培养基置于35 ℃培养箱内培养(16~20 h后取出),最后进行结果判读。根据相关文献报道,该检测方法被证明与金标准微量肉汤稀释法一致[10]。
除哌拉西林他唑巴坦及美罗培南外的其他6种抗菌药物MIC结果遵循美国临床实验室标准化协会(CLSI)2015版发布的M45-A2[8]进行解释。美罗培南遵循2019版EUCAST欧盟药敏试验标准进行解释[7]。获得结果后再分别计算这7种有判断标准抗菌药物的MIC50、MIC90和无判断标准的哌拉西林他唑巴坦的MIC50和MIC90。
1.3质控菌株 质控菌株为大肠埃希菌(ATCC 25922)和铜绿假单胞菌(ATCC 27853),质控结果均符合CLSI规定范围[8]。
2 结果
2.1MIC分布 亚胺培南的MIC值主要分布在0.25~0.5 μg/mL,美罗培南的MIC值主要分布在0.5~1.0 μg/mL,头孢他啶的MIC值主要分布在1.0~2.0 μg/mL,阿莫西林克拉维酸的MIC值主要分布在2.0~4.0 μg/mL,四环素的MIC值主要分布在1.0~4.0 μg/mL,哌拉西林他唑巴坦的MIC值主要分布在0.25~0.5 μg/mL,强力霉素的MIC值主要分布在0.25~1.0 μg/mL,复方磺胺甲噁唑的MIC值主要分布在0.5~2.0 μg/mL。见表1。

表1 109株类鼻疽伯克霍尔德菌对8种抗菌药物MIC分布及累积率
2.2药敏试验结果判读 哌拉西林他唑巴坦在CLSI上无判断折点。根据CLSI敏感性判断标准,所有菌株对亚胺培南、头孢他啶及阿莫西林克拉维酸全部敏感;四环素有103株B.pseudomallei的MIC值≤4.0 μg/mL,为敏感,5株MIC值=8.0 μg/mL,为中介,1株MIC值≥16.0 μg/mL,为耐药;强力霉素有108株B.pseudomallei的MIC值≤4.0 μg/mL,为敏感,1株MIC值≥16.0 μg/mL,为耐药;复方磺胺甲噁唑有104株B.pseudomallei的MIC值≤2.0 μg/mL,为敏感,5株≥4.0 μg/mL,为耐药。根据EUCAST欧盟药敏试验标准,美罗培南有106株B.pseudomallei的MIC值≤2.0 μg/mL,为敏感,3株MIC值为8.0 μg/mL,为耐药;哌拉西林他唑巴坦有107株B.pseudomalleiMIC值≤0.5 μg/mL,2株为1 μg/mL。通过与CLSI药物敏感性标准和EUCAST欧盟药敏试验标准比较,获得109株B.pseudomallei对有判断折点的7种抗菌药物的敏感性结果,并通过计算获得这8种抗菌药物对B.pseudomallei的MIC50和MIC90。见表2。

表2 类鼻疽伯克霍尔德菌对7种抗菌药的药物敏感度和对8种抗菌药的MIC50和MIC90对比
8种抗菌药物的MIC50从小到大依次为哌拉西林他唑巴坦(0.25 μg/mL)<亚胺培南、美罗培南、强力霉素(均为0.5 μg/mL)<复方磺胺甲噁唑、头孢他啶(均为1 μg/mL)<四环素、阿莫西林克拉维酸(均为2 μg/mL),MIC90从小到大则依次为哌拉西林他唑巴坦、亚胺培南(均为0.5 μg/mL)<美罗培南(1 μg/mL)<复方磺胺甲噁唑、头孢他啶、强力霉素(均为2 μg/mL)<四环素、阿莫西林克拉维酸(均为4 μg/mL)。
另外,结合临床常用的哌拉西林他唑巴坦国产剂型及进口剂型的血药浓度峰值(Cmax),计算各剂型的Cmax及其与MIC50、MIC90的比值,结果见表3。
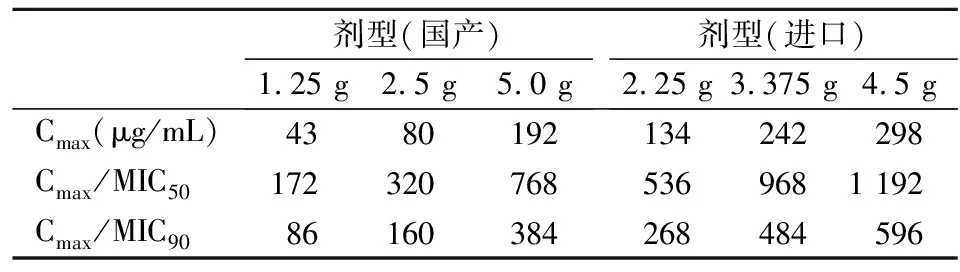
表3 哌拉西林他唑巴坦剂型及血药浓度峰值(Cmax)与其MIC50和MIC90比值
3 讨论
类鼻疽病在东南亚和澳大利亚是一种重要的公共卫生性疾病,在中国主要分布在海南、广东、广西等。文献资料显示该病在墨西哥、中美洲、加勒比海地区等非流行区逐渐增多[11]。有研究发现,B.pseudomallei感染患者在没有及时给予正确抗菌药物治疗时死亡率高达80%,但及时给予正确抗菌药物治疗患者死亡率可降低为14%~40%[12]。因医疗水平、医疗条件的不同,该病死亡率在20%~60%不等[6]。随着早期抗菌药物的使用,死亡率也可降至10%以下[13]。然而,由于B.pseudomallei对多种抗菌药物(如青霉素、氨苄西林、一代和二代头孢、大环内酯类、氨基糖苷类、链霉素、多黏菌素等)天然耐药[2],喹诺酮类抗菌药物虽然在体外具有轻微的抗菌活性,但治疗失败率较高[3]。因此,对于类鼻疽病的治疗,可选用的药物种类有限。目前CLSI对B.pseudomallei有敏感性判读标准的药物仅有复方磺胺甲噁唑、头孢他啶、四环素、强力霉素、阿莫西林克拉维酸和亚胺培南[8]。
为给类鼻疽病的治疗提供更多用药选择,本研究结合7种有敏感性判断标准的抗菌药物和哌拉西林他唑巴坦进行了试验比较。结果发现哌拉西林他唑巴坦的MIC50和MIC90分别为0.25 μg/mL和0.5 μg/mL,MIC50小于其他7种抗菌药物的MIC50,而MIC90除了与亚胺培南的MIC90相等之外,也均小于其他6种抗菌药物的MIC90。该结果说明其体外抗菌活性强于其他所测药物。
哌拉西林是一种广谱半合成β-内酰胺类抗菌药物,通过抑制细菌的隔膜形成和细胞壁的合成发挥杀菌作用,在体外对许多革兰阳性和革兰阴性的需氧菌及厌氧菌具有抗菌活性[14]。他唑巴坦又名三氮甲基青霉烷砜,是多种β-内酰胺酶的强效抑制剂。在哌拉西林他唑巴坦的配方中,他唑巴坦的存在增强并扩展了哌拉西林的抗菌谱,使该药对许多原先对哌拉西林以及对其他β-内酰胺抗菌药物耐药的产β-内酰胺酶细菌有效[14]。哌拉西林他唑巴坦注射后在各种组织和体液中分布广泛,其临床治疗适应症也比较广,如下呼吸道感染、细菌性败血症、妇科感染等。
哌拉西林他唑巴坦对于肠杆菌科细菌在CLSI上已有敏感性判断标准,对于非发酵菌,除了铜绿假单胞菌、鲍曼不动杆菌、流感嗜血杆菌外,其他菌尚无敏感性判断标准。本研究结果提示哌拉西林他唑巴坦对B.pseudomallei的MIC50和MIC90均低于已有判断标准的亚胺培南、头孢他啶、强力霉素、四环素、阿莫西林克拉维酸、复方磺胺甲噁唑和美罗培南,说明其体外抗B.pseudomallei活性强于其他对照药物,结合其在体内药代动力学的特点,发现无论是国产还是进口的多种剂型,其血药浓度峰值都远远超过其MIC50和MIC90值,而一般认为,抗菌药物的血药浓度高于其对目标菌的MIC值4~6倍以上,在体内就有抑菌或杀菌作用。用于分析哌拉西林他唑巴坦对B.pseudomallei的敏感性标准大多参照CLSI中铜绿假单胞菌的MIC敏感折点[5]。Dutta等[5]发现来自孟加拉国的20株B.pseudomallei对哌拉西林他唑巴坦均敏感(参照CLSI中铜绿假单胞菌的MIC敏感折点),其MIC50和MIC90均为2 μg/mL。该报道中的MIC值显著高于本研究结果,但其样本数量可能太少,所有分离株对3种常用抗菌药物(亚胺培南、头孢他啶和阿莫西林克拉维酸)的MIC50和MIC90值均较高(≥2 μg/mL,琼脂稀释法)。另外,董素芳等[15]亦研究了B.pseudomallei对哌拉西林他唑巴坦的敏感性,文中仅提示其参照CLSI标准判定。综上所述,本研究仍具有一定的参考意义,为临床应用哌拉西林他唑巴坦治疗B.pseudomallei感染提供理论依据。
本研究对哌拉西林他唑巴坦体外对B.pseudomallei的MIC浓度进行初步研究,旨在引起人们对B.pseudomallei感染中抗菌药物选择的重视,提高B.pseudomallei感染的治愈率,降低死亡率。实验室应与临床紧密合作,以便获取更多的哌拉西林他唑巴坦治疗B.pseudomallei感染的临床药效学总结,为其治疗用药提供更有力的证据。

