Notch信号调控肺泡上皮细胞自噬在肺炎克雷伯菌感染中的作用机制*
师志云,尹晓丽,王良方,侯晓惠,张玉英,李刚,王菊英,王文,贾伟
(1.宁夏医科大学总医院医学实验中心,银川 750004;2.宁夏临床病原微生物重点实验室,银川 750004;3.宁夏医科大学临床医学院,银川 750004)
细胞自噬是先天免疫反应和适应性免疫反应的重要组成部分,在防御细菌感染中起着重要作用[1-2]。深入研究细菌自噬的机制及其与细胞的相互作用有助于发现细菌感染的新致病机制。肺泡Ⅱ型上皮细胞(alveolar epithelial cells type Ⅱ, AECⅡ)与自噬的功能有相同之处,在肺脏抵御外源微生物感染中也具有重要的免疫调节作用[3]。本课题组前期建立了体外肺炎克雷伯菌感染AECⅡ模型,通过上调或抑制自噬程度进一步证实肺炎克雷伯菌能够诱导AECⅡ A549发生自噬[4]。Notch信号是进化上保守的信号级联,对细胞分化、发育和体内平衡的正常生物学过程至关重要[5]。最新研究表明,Notch信号可作为自噬的底物,参与机体自噬过程[6]。本研究通过抑制细胞自噬及Notch信号,观察肺炎克雷伯菌对肺泡Ⅱ型上皮细胞自噬、Notch信号及炎症因子的影响,探讨Notch信号调控肺泡上皮细胞自噬在肺炎克雷伯菌感染中的作用机制,为进一步研究肺炎克雷伯菌的分子致病机制奠定理论基础,为临床治疗肺炎克雷伯菌提供新的线索。
1 材料与方法
1.1菌株与细胞株 肺炎克雷伯菌标准菌株ATCC 700603(美国ATCC),人肺泡Ⅱ型上皮细胞株A549(中科院细胞库)。
1.2试剂和仪器 TRIzol试剂(美国Invitrogen公司),SYBR Premix Ex Taq(中国TaKaRa公司,RR820A),PrimeScriptTMRT reagent Kit with gDNA Eraser(中国TaKaRa公司,RR047A),RNAiso Plus(中国TaKaRa公司,9108),Human INF-γ ELISA试剂盒(CSB-E04577h)、Human TNF-α ELISA试剂盒(CSB-E04740h)(中国cusabio公司),Human IL-1β ELISA试剂盒(美国Invitrogen公司,KHC0011),雷帕霉素(rapa)、3-甲基腺嘌呤(3-MA,美国Sigma公司),γ-分泌酶抑制剂(DAPT,美国Sellect公司),LC3抗体及β-actin抗体(英国Abcam公司)。Stepone plus荧光定量PCR(美国ABI公司),SDS-PAGE电泳仪、湿法转膜仪(美国Bio-Rad公司),Tanon5200化学发光检测系统(中国Tanon公司)。
1.3细胞培养 A549细胞贴壁生长至80%~90%时,去除DMEM培养基,加入PBS洗1~2次,去除PBS后,加入1 mL胰酶消化1~3 min后,加入3 mL完全培养基中和胰酶终止消化,将消化的细胞转移至15 mL离心管中,1 000 r/min离心5 min。弃上清液,加入3 mL培养基重悬细胞,1∶3传代至培养皿中培养。
1.4实验分组 A549细胞贴壁生长至80%~90%时,以1×108个/孔接种于6孔培养板中。肺炎克雷伯菌以3个感染时间点(24 h、48 h、72 h)及细菌、细胞感染复数(multiplicity of infection,MOI)比100∶1感染A549细胞,分为4组:A549对照组,A549+肺炎克雷伯菌-24 h,A549+肺炎克雷伯菌-48 h,A549+肺炎克雷伯菌-72 h,每组3个样本,分别在24 h、48 h、72 h感染点应用自噬抑制剂3-MA(终浓度5 mmol/L)和γ-分泌酶抑制剂DAPT(终浓度10 μmol/L)处理肺炎克雷伯菌感染的A549细胞,收集各组A549细胞用于荧光定量PCR、western-blot及ELISA检测。
1.5荧光定量PCR检测LC3 Ⅱ及Notch1 mRNA含量[4]使用TRlzol试剂从A549细胞提取总RNA,加入焦碳酸二乙酯(DEPC)50 μL溶解,测定RNA纯度和浓度。使用逆转录试剂盒及SYBR Premix Ex Taq进行逆转录及PCR分析。以GAPDH为内参,引物由上海生工生物公司合成,LC3:F:5′-GCGCTACAAGGGTGAGAAG-3′,R:5′-CCGGATGATCTTGACCAACTC-3′;Notch1:F:5′-AGGCAATCCGAGGACTATGA-3′,R:5′-CTCAGAACGCACTCGTTGAT-3′;GAPDH:F:5′-CTTTGGTATCGTGGAAGGACTC-3′,R:5′-AGTAGAGGCAGGGATGATGT-3′。反应条件:预变性95 ℃ 10 min;95 ℃ 5 s,60 ℃ 1 min,40个循环,并绘制熔解曲线。2-ΔΔCt计算分析mRNA相对表达水平变化。
1.6western blot检测LC3 Ⅱ及Notch1蛋白质表达水平[4]抽取4组肺泡Ⅱ型上皮细胞A549总蛋白,BCA法测蛋白质浓度后-80 ℃保存。调整各组总蛋白浓度使每孔上样量一致,10%SDS-聚丙烯酰胺凝胶垂直电泳分离后通过半干电转仪将蛋白质转到PVDF膜,50 g/L脱脂奶粉封闭2 h,TBST洗膜3次,每次5 min;一抗4 ℃过夜,TBST洗膜4次,每次5 min;温育二抗,37 ℃摇床1 h,TBST洗膜4次,每次5 min;化学发光,曝光,定影;凝胶成像仪进行图像处理,采用Quantity-one软件分析目的条带的累积光密值(IOD值),以内参GAPDH作为参照。
1.7ELISA检测细胞因子INF-γ、TNF-α及IL-1β水平 吸取4组细胞上清液置于EP管中,12 000 r/min、4 ℃离心10 min。按照ELISA试剂盒说明书进行操作,INF-γ、TNF-α及IL-1β检测下限分别为6.25 pg/mL、7.8 pg/mL、1 pg/mL。

2 结果
2.1肺炎克雷伯菌感染肺泡Ⅱ型上皮细胞对细胞自噬、Notch信号及细胞因子的影响
2.1.1荧光定量PCR及western blot检测 LC3、Notch1 mRNA及蛋白质的表达与未感染肺炎克雷伯菌的A549细胞相比,感染组(24 h、48 h和72 h)肺炎克雷伯菌促进A549细胞自噬蛋白LC3 mRNA和蛋白质表达量显著增高(P<0.05);同时促进Notch信号,即Notch1 mRNA和蛋白质表达量显著增高(P<0.05)。随着时间延长,LC3和Notch1 mRNA和蛋白质表达量逐渐增加,见表1、图1。

表1 作用不同时间的肺炎克雷伯菌对A549细胞LC3和Notch1 mRNA的表达影响

图1 作用不同时间的肺炎克雷伯菌对A549 细胞LC3和Notch1的表达影响
2.1.2ELISA检测 INF-γ、TNF-α及IL-1β的含量与未感染肺炎克雷伯菌的A549细胞相比,感染组(24 h,48 h和72 h)A549细胞上清中IL-1β、TNF-α、INF-γ含量显著增高(P<0.05)。随着时间延长,3个因子的含量有逐渐上升趋势,见表2。

表2 作用不同时间的肺炎克雷伯菌对A549细胞上清中IL-1β、TNF-α、INF-γ含量变化(pg/mL)
2.2抑制自噬对肺泡Ⅱ型上皮细胞Notch信号及细胞因子的影响
2.2.1荧光定量PCR及western blot检测LC3、Notch1 mRNA及蛋白质的表达 用3-MA 抑制细胞自噬,肺炎克雷伯菌对A549细胞的LC3和Notch1的mRNA表达均有显著下降(P<0.05),即抑制细胞自噬可影响Notch信号Notch1 mRNA的表达。与对照组比较,Notch1 和LC3表达量随着肺炎克雷伯菌处理时间增加而增加,3-MA处理后其表达量下降(P<0.05)。见表3、图2。

图2 A549细胞用肺炎克雷伯菌和3MA处理后Notch1和LC3蛋白的表达影响

表3 3-MA对A549细胞中LC3和Notch1 mRNA及蛋白表达的影响
注:*,与Ctrl比较,P<0.05;#,与KPN-24 h比较,P<0.05;&,与KPN-48 h比较,P<0.05;^,与KPN-72 h比较,P<0.05。
2.2.2ELISA检测INF-γ、TNF-α及IL-1β的含量 与对照组比较,A549细胞IL-1β、TNF-α、INF-γ含量随着肺炎克雷伯菌处理时间增加而显著增加(P<0.05),3-MA处理后其含量下降。见表4。

表4 3-MA对A549细胞上清中IL-1β、TNF-α、INF-γ含量变化(pg/mL)
2.3抑制Notch信号对肺泡Ⅱ型上皮细胞自噬及细胞因子的影响
2.3.1荧光定量PCR及western blot检测 LC3、Notch1 mRNA及蛋白质的表达应用DAPT 抑制细胞Notch信号,肺炎克雷伯菌对A549细胞的LC3和Notch1的mRNA表达均有显著下降(P<0.05)。与对照组比较,Notch1表达量随着肺炎克雷伯菌处理时间增加而增加,DAPT处理后其表达量下降(P<0.05);LC3随着处理时间增加而表达量增加,DAPT处理后在48 h前其表达量下降,72 h表达量在DAPT处理后略有上升。见表5、图3。

图3 A549细胞用肺炎克雷伯菌和DAPT处理后Notch1和LC3的表达影响

表5 DAPT对A549细胞中LC3和Notch1 mRNA及蛋白表达的影响
注:*,与Ctrl比较,P<0.05;#,与KPN-24 h比较,P<0.05;&,与KPN-48 h比较,P<0.05;^,与KPN-72 h比较,P<0.05。
2.3.2ELISA 检测INF-γ、TNF-α及IL-1β的含量与对照组比较,A549细胞IL-1β、TNF-α、INF-γ含量随着肺炎克雷伯菌处理时间增加而显著增加(P<0.05),DAPT处理后其含量下降,见表6。
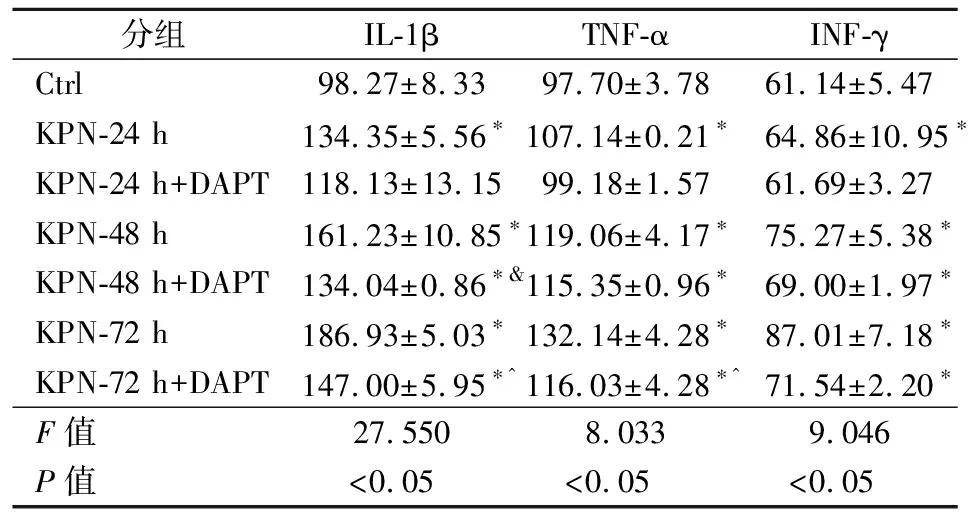
表6 DAPT对A549细胞上清中IL-1β、TNF-α,INF-γ含量变化(pg/mL)
3 讨论
肺炎克雷伯菌是一种胞外菌,可以黏附并侵入多种哺乳动物细胞系,包括肺泡上皮细胞和巨噬细胞,并能在感染的宿主细胞内获取必需的营养物质而存活。研究证实,Notch信号通路在胎肺发育、AECⅡ的增殖和分化过程中呈时序性表达,推测Notch信号可能在决定AECⅡ细胞行为中起重要作用[7]。研究表明,Notch1 信号通路与其他细胞信号通路,如Akt、Ras、NF-κB、Wnt、EGFR、PDGF 等[8-9],可互为激活,在调控肿瘤细胞的增殖与凋亡中发挥重要作用。目前国内外文献都研究了Notch信号在巨噬细胞免疫反应中起的重要作用及Notch信号精细调节肺发育及肺上皮细胞的增殖、分化。然而,对于Notch信号在肺脏感染肺炎克雷伯菌的过程中,其所在肺泡Ⅱ型上皮细胞是否也对先天免疫发挥调控作用知之甚少。
前期结果表明,体外肺炎克雷伯菌能够诱导肺泡Ⅱ型上皮细胞A549发生自噬[4],但具体的分子机制有待研究。本研究结果显示,利用体外肺炎克雷伯菌感染人肺泡Ⅱ型上皮细胞A549模型,感染组A549细胞在感染后24 h、48 h和72 h能明显上调自噬相关蛋白LC3及Notch信号中Notch1的表达,且随着感染时间的延长,LC3、Notch1表达量逐渐增加,表明肺炎克雷伯菌能够激活Notch信号通路,诱导肺泡Ⅱ型上皮细胞自噬,进一步说明肺炎克雷伯菌可能通过Notch信号通路参与肺泡上皮细胞自噬,为研究肺炎克雷伯菌致病的分子机制奠定基础。
自噬在调节炎症介质中具有重要作用,并影响细胞因子的产生[10]。如布鲁杆菌感染期间,LC3依赖的自噬途径抑制布鲁氏菌病患者的单核细胞中IL-1β、IL-6、IL-10和TNF-α的产生[11]。有研究表明,细胞因子也能影响自噬产生。辅助性T细胞Th1细胞因子(如 IFN-γ、TNF-α、IL-1等)已被证明能够诱导自噬的产生;而经典的Th2细胞因子(如IL-4、IL-10和IL-13)则对自噬具有抑制作用[12]。本研究结果发现,肺炎克雷伯菌感染A549细胞后促进细胞因子IL-1β、TNF-α、INF-γ的产生,随着时间(24 h、48 h和72 h)延长,3个因子的含量逐渐上升,表明自噬、Notch信号与炎症介质(细胞因子)在肺炎克雷伯菌感染肺泡Ⅱ型上皮细胞中可能存在相互促进关系,为肺炎克雷伯菌感染的治疗提供一个新的思路。
本研究在肺炎克雷伯菌感染A549细胞24 h、48 h、72 h后,分别应用自噬抑制剂3-MA和γ-分泌酶抑制剂DAPT处理细胞,结果发现3-MA抑制细胞自噬可以显著下调A549细胞自噬相关蛋白LC3、Notch1的表达及炎症因子的产生,同时DAPT抑制Notch信号可以显著下调Notch1、LC3的表达及炎症因子的产生,表明LC3、Notch1及细胞因子IL-1β、TNF-α、INF-γ变化趋势相同,进一步阐述Notch信号与肺泡上皮细胞自噬相互作用的分子机制及自噬作为宿主天然免疫机制在抵抗肺炎克雷伯菌的感染过程作用的分子机制,有助于指导临床治疗和预防肺炎克雷伯菌感染提供理论依据和新思路,在开发新药和改进疫苗等方面有重要的指导意义。

