葡萄糖调节蛋白78影响乳腺癌细胞株MCF-7的黏附及迁移能力的研究
王作胜 王芳 张秀秀
(日照市中心医院肿瘤科,山东 日照 276800)
肿瘤的转移主要是通过直接浸润、淋巴及血液循环中的循环肿瘤细胞三种途径实现。肿瘤细胞同质性粘附降低,从原发灶脱离,之后与细胞外基质( Extracell-ular Matrix,ECM)发生异质性粘附,并导致其受到破坏或降解,同时肿瘤细胞与ECM大分子相互作用,形成肿瘤进入细胞并且形成逃避免疫系统的通道。基质金属蛋白酶(matrix Metallo-proteinases,MMPs)是ECM降解代谢的主要酶类,其中,基质金属蛋白酶-2(matrix metalloproteinase-2,MMP-2)和基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)与肿瘤的侵袭转移最密切[1-2]。葡萄糖调节蛋白78(glucose regulated protein78,GRP78)是参与内质网新生肽聚集、调节内质网钙稳态、抗内质网相关性细胞凋亡,也是未折叠蛋白反应(UPR)的核心调节因子,在肿瘤的增殖、凋亡以及侵袭转移中发挥重要的作用[3-5]。本研究主要探讨乳腺癌细胞株MCF-7的黏附及迁移能力与GRP78的关系及调控机理。
1 材料与方法
1.1材料 乳腺癌细胞MCF-7,江苏凯基生物技术股份有限公司;RPMI 1640培养基、胎牛血清、胰蛋白酶,Hyclone公司;Lipofectamine 2000、G418、500U/mL青/链霉素,美国Invitrogen公司;明胶,碧云天(上海)生物技术有限公司;pEGFP-N1-GRP78及pEGFP-N1质粒,上海吉凯基因化学技术有限公司;Matrigel胶,前尘(上海)生物制剂有限公司;GRP78、MMP-2、MMP-2抗体及二抗,均来自美国CST公司。
1.2方法
1.2.1MCT-7细胞的培养及转染 用RPMI1640+10% FBS+100 U/ mL青霉素—链霉素培养基置于37℃,5% CO2培养箱中培养,48 h后吸弃培养基,加入PBS洗3次后,加入1 mL 0.25%胰蛋白酶置于培养箱中30 s,消化,加入10%FBS终止消化。加入培养基重悬细胞,调节细胞浓度至6×105个接种于直径40 mm的培养皿,每皿加2 mL培养基。24 h后,细胞融合到80%~90%时,按照Lipofectamine2000说明书将pEGFP-N1空载体、pEGFP-N1-GRP78质粒转染到MCF-7细胞中。72 h后,吸弃原有培养基并更换为含有400 μg/mLG418培养基,以此筛选可以在G418培养基中生存的细胞。
1.2.2细胞黏附试验 将浓度为12.6 g/L的 Matrigel母液用PBS稀释成50 mg/L,100 μL/孔加入六孔板中,对照孔中加入等体积的1%BSA于37℃培养箱中孵育2 h,弃上清,4℃保存备用。分别收集生长状态良好且处于对数生长期的MCF-7/UT、MCF-7/N1、MCF-7/GRP78细胞,调整细胞浓度至1×109个/L后接种于6孔板中,设3个平行复孔/组,置于培养箱中培养2 h后,吸弃培养基,PBS洗2次,消化后加入PBS充分重悬细胞,并进行细胞计数,3个复孔细胞计数的平均值作为本组的黏附细胞总数,计算黏附率。黏附率(%)=粘附细胞总数/总细胞数×100%。
1.2.3细胞划痕试验 将消化下来的细胞用培养基重悬,并接种于直径40 mm培养皿中,加入RPMI1640+10%FBS培养基培养基2 mL/皿,置于37℃,5%CO2培养想中过夜培养约10 h,第2天置于倒置显微镜下观察细胞生长情况,若融合成单层细胞,取10 μL得移液枪头平整得在培养皿上划一直线,并马上更换为RPMI1640+1% FBS培养基,分别于0、48 h后吸弃培养基,并在显微镜下观察细胞的迁移情况。用Imagetool软件计算迁徙率。迁徙率(%)=[(初始划痕宽度值-现划痕宽度值)]/初始划痕宽度值×100%。
1.2.4Western blot检测 RIPA+1 nmol/L PMSF裂解液裂解收集的三种细胞,提取细胞总蛋白,用BCA法测定总蛋白浓度,用TBS稀释样品至相同浓度,制作电泳样品,并进行凝胶电泳,电泳完成后半干转膜仪转膜,1% BSA封闭,根据不同的分子量裁膜,分别加 GRP78、MMP2、 MMP9一抗,4℃过夜孵育,TBST洗涤3次,5 min/次,加入二抗,室温孵育1 h,TBST洗涤3次,5 min/次,洗涤结束后,置于Bio-Rad凝胶成像仪中进行显色操作。Gel-Pro analyzer检测条带灰度值。
2 结 果
2.1转染后各细胞中GRP78的表达情况 与其他两组细胞(MCF-7/UT与MCF-7/N1)对比,GRP78在MCF-7/GRP78细胞中的表达水平更高(P<0.05),MCF-7/UT与 MCF-7/N1细胞中GRP78的表达水平差异无统计学意义(P>0.05)。见图1。
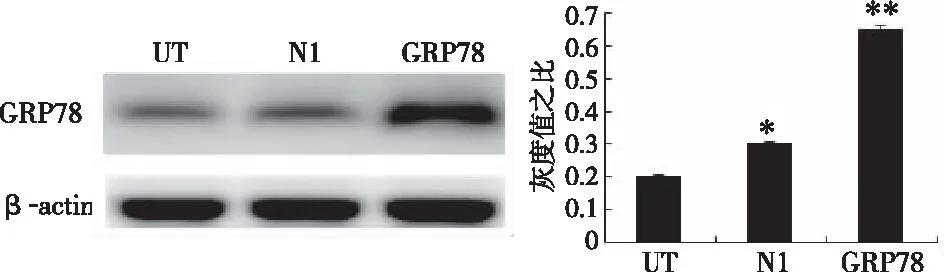
图1 不同细胞中GRP78的表达(*P<0.05,**P>0.05)
2.2GRP78对细胞黏附能力的影响 MCF-7/UT、MCF-7/N1、MCF-7/GRP78三种细胞的迁移率(%)分别为:(32.1±1.75)、(31.99±1.01)、(45.80±1.5)。培养2 h后MCF-7/GRP78细胞的黏附率比另两种细胞明显增强,而MCF-7/UT、MCF-7/N1细胞黏附率并无明显变化。见图2。
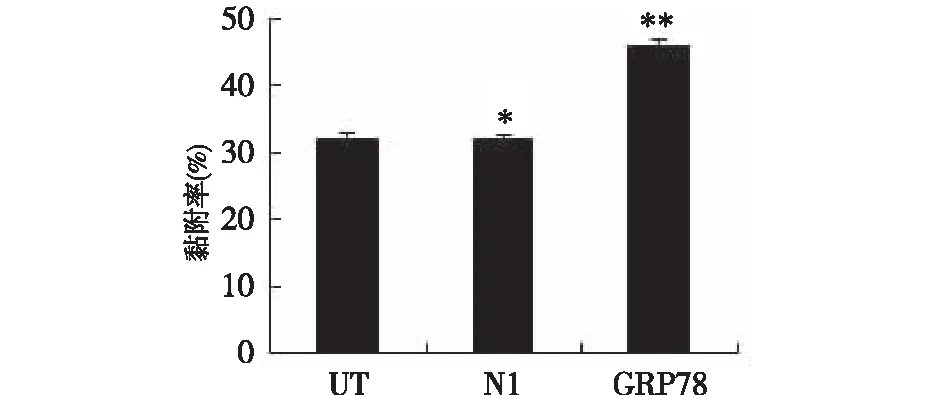
图2 不同细胞黏附率的大小(*P<0.05,**P>0.05)
2.3GRP78对细胞迁移能力的影响 MCF-7/UT、MCF-7/N1、MCF-7/GRP78在培养48 h后的迁移率分别为:(0.55±0.14)、(0.62±0.23)、(0.94±0.30),由此得出MCF-7/GRP78细胞迁移能力更强。而MCF-7、MCF-7/N1细胞48 h后的迁移能力无明显变化。见图3。
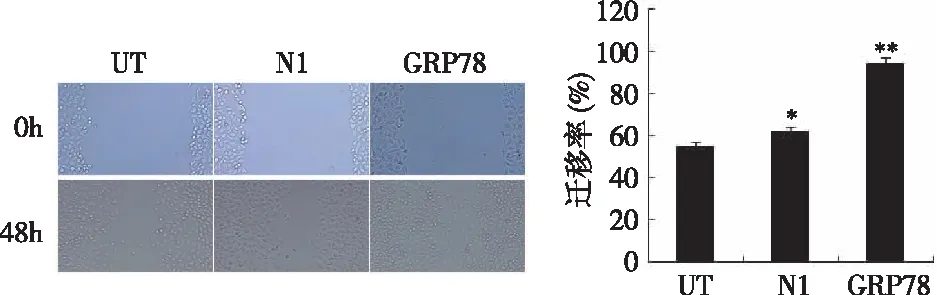
图3 不同细胞迁移率的大小(×100,*P<0.05,**P>0.05)
2.4Western blot检测 MCF-7/GRP78细胞中MMP2、MMP9表达水平明显升高(P<0.05);MCF-7/UT与MCF-7/N1细胞中MMP2、MMP9表达水平差异无统计学意义(P>0.05)。见图4。
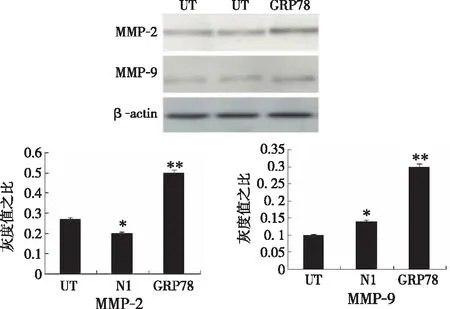
图4 不同细胞MMP-2、MMP-9的表达水平(*P<0.05,**P>0.05)
3 讨 论
乳腺癌作为女性健康“第二大杀手”,外科手术、放疗及化疗依然是治疗的常规手段,这两种方法对患者来说身心都饱受折磨。另外晚期患者往往会发生肿瘤转移,常规的治疗方法并不能从根本上阻止癌细胞的浸润及转移。肿瘤的侵袭转移是一个多种机制参与的复杂过程,其影响因素至今尚未明确。MMPs作为一类金属离子依赖的蛋白水解酶家族,其几乎能降解细胞外基质中所有的蛋白成分,从而阻断肿瘤侵袭的屏障,在调节细胞增殖、黏附、迁移、血管生成、细胞凋亡和宿主防御等方面起重要作用,在肿瘤侵袭转移中的作用逐渐受到重视,被认为是该过程中的主要水解酶类之一[6]。目前发现人类的MMPs是由28个成员组成,参与许多不同的生理病理过程[7]。其中MMP-2和MMP-9起到了显著的作用,研究[8-9]表明当细胞恶变时,MMP-2和MMP-9表达量会升高,这两种细胞因子以酶原形式分泌,须水解后功能才能激活,激活后对阻挡癌细胞浸润的组织屏障进行降解破坏,加速肿瘤细胞的侵袭转移,而阻断MMPs的功能后乳腺癌的侵袭则受到抑制,因此MMP-2、MMP-9与乳腺癌的侵袭转移关系密切[10-11]。
为了进一步探讨GRP78在乳腺癌细胞对正常细胞进行侵袭转移时的作用机制,我们通过构建GRP78真核表达载体并将构建好的质粒转染至MCF-7细胞中,并通过细胞黏附实验及划痕实验评估未经处理的MCF-7细胞、转染空质粒的细胞MCF-7-pEGFP-N1及转染GRP78真核表达载体的细胞MCF-7-pEGFP-GRP78三种细胞的黏附及迁移能力;WesternBlot计算三种细胞中MMP-2、MMP-9的蛋白表达水平。结果发现GRP78的表达量提高后,MCF-7细胞黏附、迁移能力及MMP-2、MMP-9的蛋白表达水平均明显升高。证实GRP78能够通过提高MMP-2及MMP-9的表达进而加速乳腺癌细胞的黏附及迁移。

