低氧环境中PADI4促进破骨细胞分化和骨吸收功能的研究
叶蓓,成宇,司玉莹,陆柳,宗明,范列英
(同济大学附属东方医院 检验科,上海 200120)
类风湿关节炎(rheumatoid arthritis, RA)是一种慢性自身免疫性疾病,其病理机制主要是成纤维样滑膜细胞(fibroblast-like synoviocyte,FLS)和巨噬细胞异常增多,导致滑膜组织增生、血管翳形成以及软骨和软骨下骨侵袭性破坏[1]。破骨细胞是引起骨侵蚀的主要细胞。多种促炎因子如巨噬细胞集落刺激因子(macrophage colony-stimulating factor,M-CSF)和核因子κB受体活化因子配体(receptor activator of nuclear factor-κB ligand,RANKL)等均能诱导巨噬细胞向破骨细胞分化[2-3]。抗环瓜氨酸肽抗体是诊断RA的特异性血清标志物,其分子靶点是瓜氨酸蛋白[4]。在Ca2+存在下,肽酰基精氨酸脱亚胺酶(peptidyl arginine deiminase,PADI)可将肽基精氨酸转化为瓜氨酸,即蛋白质瓜氨酸化。本课题组前期研究发现,PADI4在RA患者外周血单核细胞和滑膜组织中显著高表达,且能抑制FLS凋亡,促进其增殖、活化,从而参与RA的发生与发展[5-6]。然而,PADI4在RA巨噬细胞中的作用及调控机制尚不清楚。本研究拟通过分析低氧环境下巨噬细胞中PADI4的表达情况及其对破骨细胞分化和功能的影响,进一步探讨PADI4在RA发病机制中的作用。
1 材料与方法
1.1 材料与试剂
1.1.1 细胞来源 小鼠单核巨噬细胞白血病细胞RAW264.7购于中国科学院上海细胞库。
1.2 方法
1.2.1 RAW264.7细胞培养 RAW264.7细胞用含10%FBS、1%青链霉素双抗的DMEM高糖培养液培养,培养条件为5% CO2、21%O2、37 ℃常氧培养和5% CO2、3%O2、37 ℃低氧培养。
1.2.2 体外诱导破骨细胞 将RAW264.7细胞以3×104个/孔的密度接种于24孔板,加入含有50 ng/mL M-CSF和50 ng/mL RANKL的完全DMEM高糖培养液孵育7 d,每3 d换液1次。
1.2.3 RAW264.7细胞中PADI4表达的抑制 在诱导破骨细胞前将RAW264.7细胞接种于24孔板稳定24 h。分别设立常氧-空白组、常氧-M-CSF+RANKL组、常氧-M-CSF+RANKL+Cl-amidine组、常氧-M-CSF+RANKL+siRNA组、低氧-空白组、低氧-M-CSF+RANKL组、低氧-M-CSF+RANKL+Cl-amidine组和低氧-M-CSF+RANKL+siRNA组。PADI4抑制剂Cl-amidine使用浓度为50 μmol/L。本课题组前期构建好的PADI4-siRNA-MSN[7]使用量为30 μL/孔。每3 d换液1次,诱导7 d。
1.2.4 qRT-PCR检测 按照qRT-PCR说明书配置20 μL反应体系,使用PCR仪扩增。反应条件:95 °C变性30 s,95 °C 5 s,60 °C 34 s,二步法扩增40 个循环。另外,溶解曲线分析:95 ℃15 s,60 ℃ 30 s,95 ℃ 15 s,解离时间为4 s。采用2-ΔΔCt计算目的基因相对表达量。
1.2.5 Western blotting检测 各组诱导7 d后用RIPA裂解细胞,离心收集上清液,经蛋白质定量后,加入上样缓冲液,100 ℃煮10 min后进行SDS-PAGE,转膜,脱脂牛奶封闭1 h,一抗4 ℃孵育过夜,之后用辣根过氧化物酶标记的二抗室温孵育1.5 h,PBST洗膜,最后用ECL显影。
1.2.6 TRAP染色 将RAW264.7细胞诱导6 d后用PBS洗涤,加入1 mL 4%多聚甲醛37 ℃避光固定25 min,PBS洗涤3 次,加入TRAP染色液1 mL,37 ℃孵育45 min,超纯水洗涤,在光镜下进行观察。含3 个及3 个以上细胞核且呈TRAP染色阳性的酒红色多核巨噬细胞为破骨细胞。
1.2.7 TRAP活性检测 将RAW264.7细胞接种于12孔板,诱导6 d后裂解细胞,取上清液,经蛋白质定量后,按照抗TRAP检测试剂盒说明书对TRAP活性进行定量检测。
1.2.8 体外骨吸收试验 将RAW264.7细胞以2×103个/孔的密度接种于置有牛骨片的96孔板,诱导7 d后进行甲苯胺蓝染色。用2.5%戊二醛固定液固定7 min,经0.25 mol/L氢氧化铵超声清洗后用梯度乙醇脱水,1%甲苯胺蓝染液室温染色3 min,蒸馏水洗涤。在光镜下进行观察,随机选取5个200倍视野计数,用Image Pro Plus软件分析牛骨片上的骨吸收陷窝数及相对面积。
2 结果
2.1 低氧环境对破骨细胞形成的影响在常氧和低氧环境下M-CSF和RANKL诱导RAW264.7细胞向破骨细胞分化,对细胞进行TRAP染色并计数阳性细胞数量。结果显示,低氧-M-CSF+RANKL组TRAP阳性细胞数为(7.33±1.37)个/HP,常氧-M-CSF+RANKL组TRAP阳性细胞数为(3.33±1.63)个/HP,低氧环境中TRAP阳性细胞数显著增加(P<0.01,图1A、B)。低氧-M-CSF+RANKL组的TRAP活性显著增加(P<0.001,图1C)。
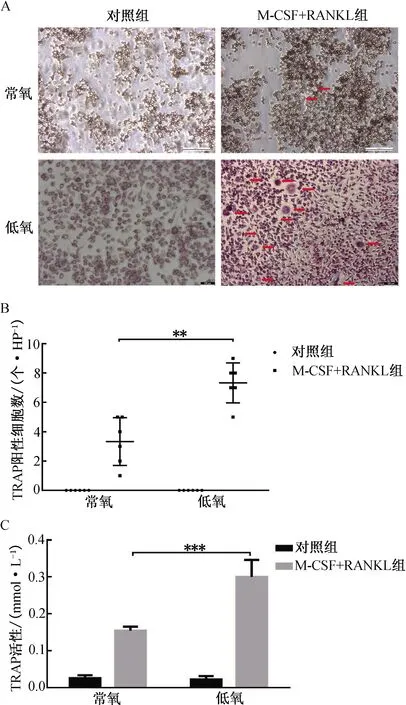
注:A.TRAP染色(×200);B.TRAP阳性细胞量化;C.TRAP活性检测。**P<0.01,***P<0.001。图1 不同氧浓度下破骨细胞分化情况
2.2 低氧环境对骨吸收的影响将RAW264.7细胞诱导7 d,用1%甲苯胺蓝染色后计数骨吸收陷窝数量。结果显示,破骨细胞在牛骨片上形成蓝紫色椭圆形、圆形等多种形态,边界较清楚,底部纤维纹路隐约可辨的骨陷窝(图2)。低氧-M-CSF+RANKL组破骨细胞骨吸收陷窝数显著多于常氧-M-CSF+RANKL组(P<0.05,表1)。

图2 M-CSF和RANKL诱导RAW264.7细胞后牛骨片的甲苯胺蓝染色(×200)

表1 各组骨吸收陷窝数及相对面积的比较
2.3 低氧环境对TRAP和PADI4mRNA表达的影响用M-CSF和RANKL诱导RAW264.7细胞7 d,分别在第3、5、7天抽提细胞中的RNA,反转录成cDNA后用qRT-PCR检测TRAP和PADI4 mRNA表达水平。结果显示,低氧-M-CSF+RANKL组TRAP和PADI4 mRNA相对表达水平较常氧-M-CSF+RANKL组显著升高(P<0.05,图3)。
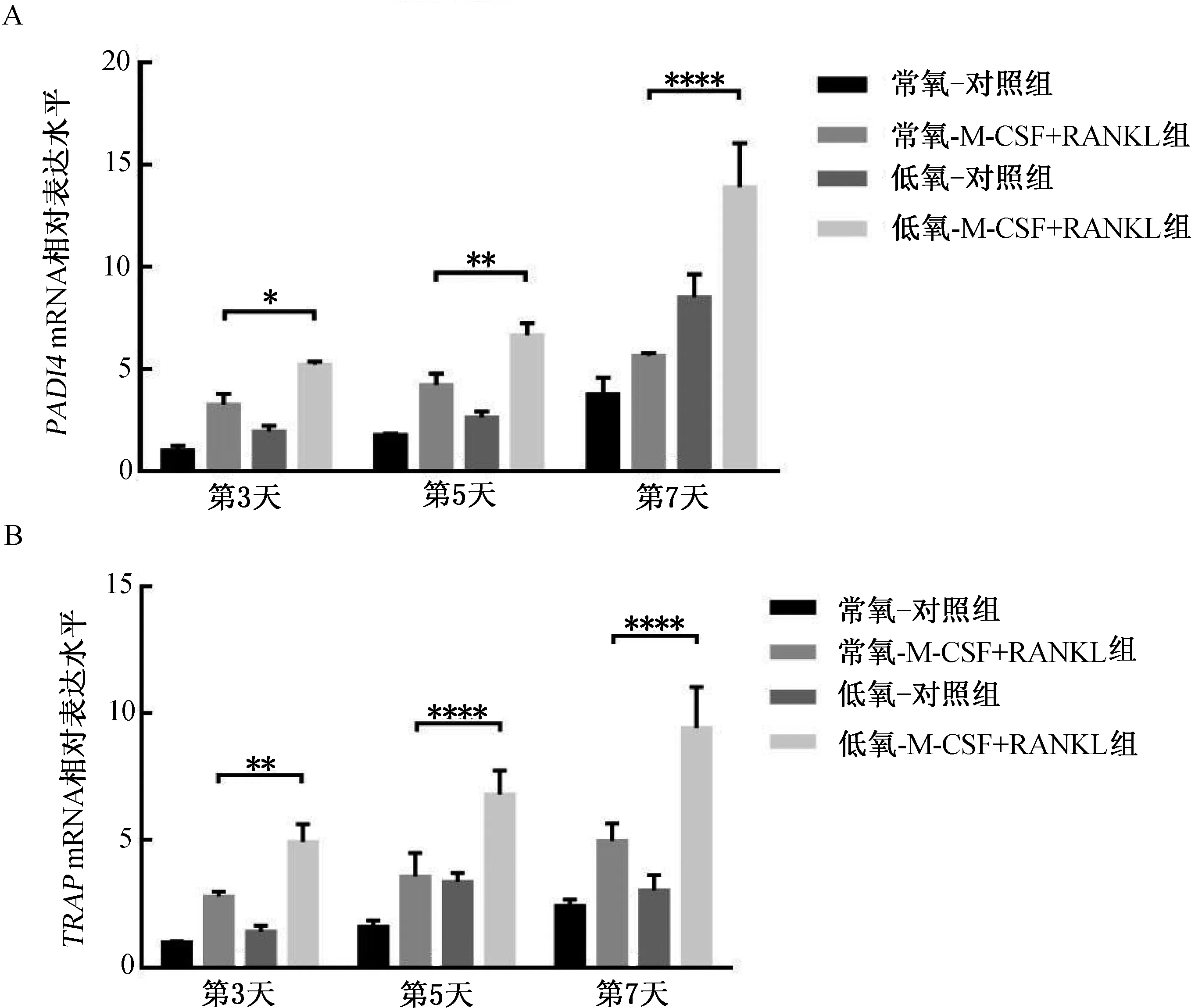
注:*P<0.05,**P<0.01,****P<0.000 1。图3 低氧环境对TRAP和PADI4 mRNA表达的影响
2.4 抑制巨噬细胞中PADI4的表达对TRAPmRNA及其蛋白表达的影响qRT-PCR检测结果显示,与低氧-M-CSF+RANKL组比较,低氧-M-CSF+RANKL+Cl-amidine组和低氧-M-CSF+RANKL+siRNA组的破骨细胞标志物TRAPmRNA相对表达水平降低(P<0.05)。Western blotting结果显示,与低氧-M-CSF+RANKL组比较,低氧-M-CSF+RANKL+Cl-amidine组和低氧-M-CSF+RANKL+siRNA组的TRAP蛋白表达量显著降低(P<0.05)。详见图4。

注:A、B.各组在常氧、低氧环境下PADI4 mRNA的量化;C、D.各组在常氧、低氧环境下TRAP mRNA的量化;E、F.Western blotting分别检测PADI4 、TRAP蛋白的表达。*P<0.05,**P<0.01,***P<0.001,****P<0.000 1。图4 抑制巨噬细胞中PADI4的表达对TRAP mRNA及其蛋白表达的影响
2.5 抑制巨噬细胞中PADI4的表达对破骨细胞分化的影响采用Cl-amidine和PADI4-siRNA抑制RAW264.7细胞中PADI4的表达。结果显示,抑制RAW264.7细胞中PADI4的表达后,低氧-M-CSF+RANKL+Cl-amidine组和低氧-M-CSF+RANKL+siRNA组的TRAP阳性细胞数较低氧-M-CSF+RANKL组显著减少(P<0.000 1,图5A、B)。TRAP活性试验进一步显示,低氧-M-CSF+RANKL+Cl-amidine组和低氧-M-CSF+RANKL+siRNA组TRAP活性较低氧-M-CSF+RANKL组显著降低(P<0.05,图5C)。
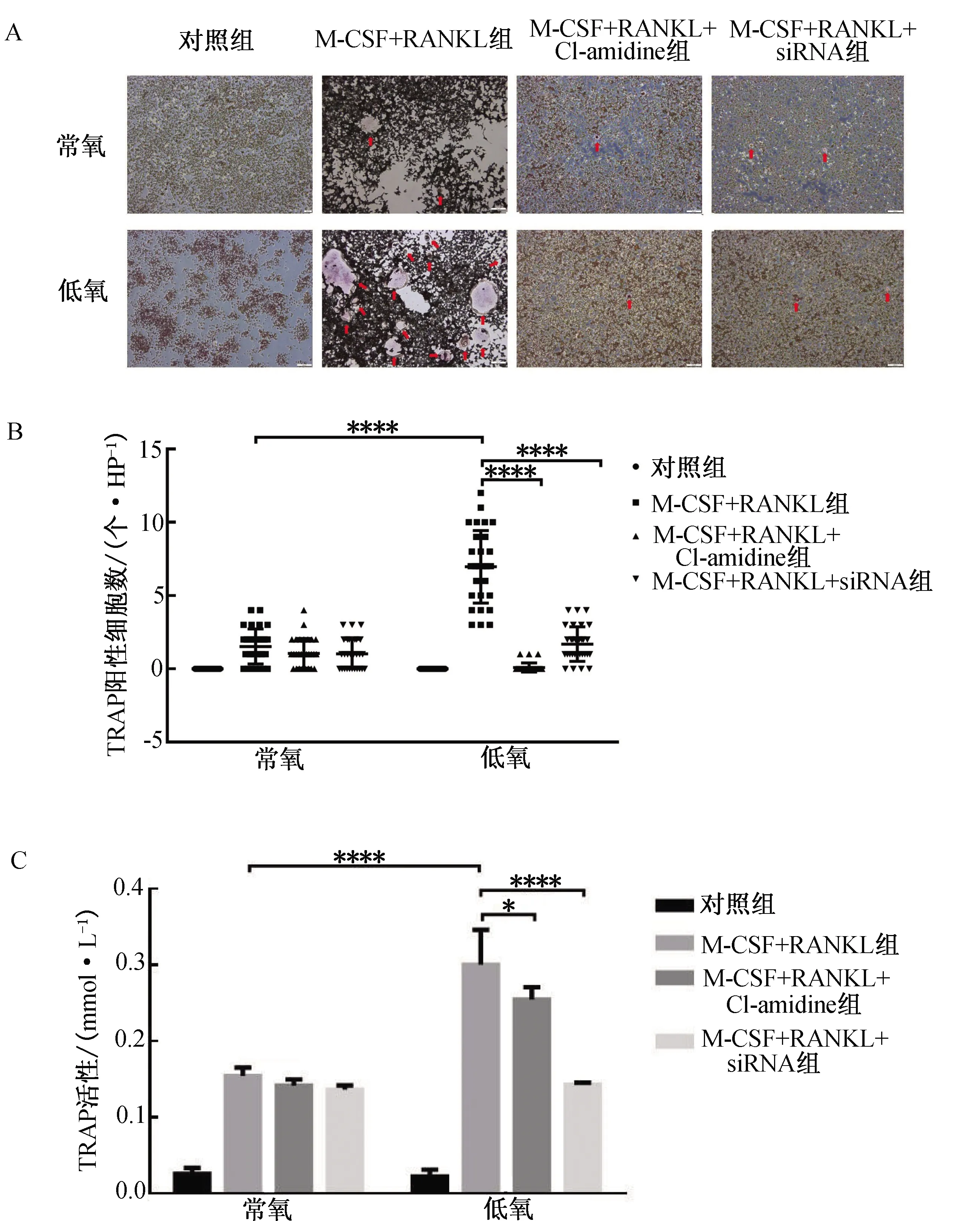
注:A.TRAP染色(×100);B.TRAP阳性细胞量化;C.TRAP活性检测。*P<0.05,****P<0.000 1。图5 抑制巨噬细胞中PADI4的表达对破骨细胞分化的影响
2.6 抑制巨噬细胞中PADI4的表达对骨吸收的影响抑制PADI4的表达后进行1%甲苯胺蓝染色。结果显示,低氧-M-CSF+RANKL+Cl-amidine组和低氧-M-CSF+RANKL+siRNA组骨吸收陷窝数较低氧-M-CSF+RANKL组显著减少(P<0.05),低氧-M-CSF+RANKL+Cl-amidine组和低氧-M-CSF+RANKL+siRNA组骨吸收陷窝相对面积较低氧-M-CSF+RANKL组显著降低(P<0.05,表2)。
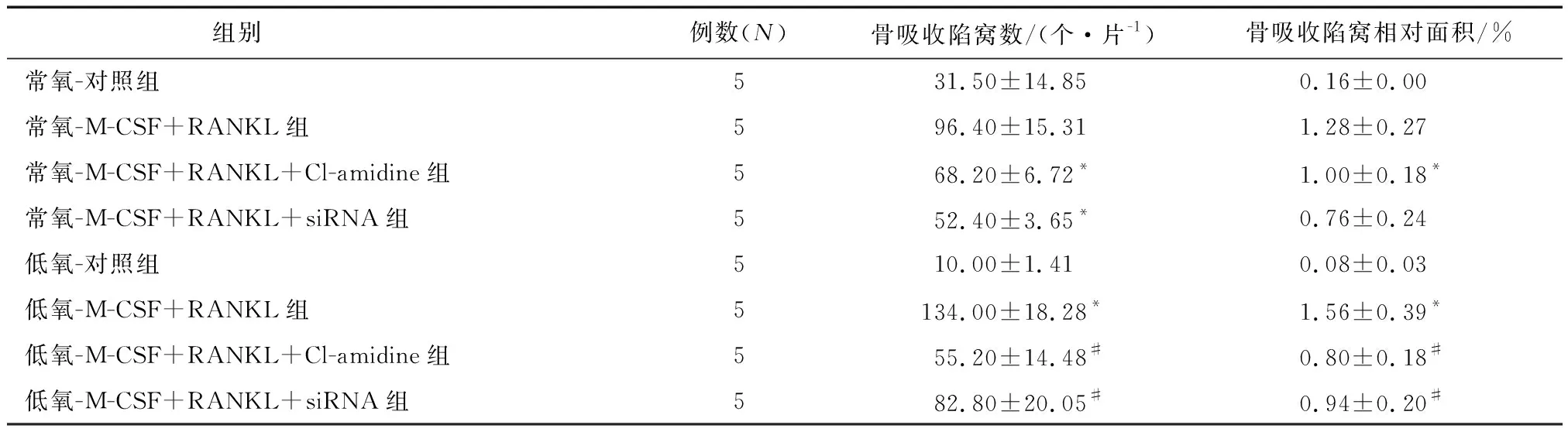
表2 各组骨吸收陷窝数及相对面积的比较
3 讨论
RA是一种常见的慢性自身免疫性疾病,其病理特点是持续的关节炎症反应导致骨代谢失衡,引起进行性关节软骨及软骨下骨破坏。超过60%的RA患者出现骨侵蚀,严重影响RA患者的预后[8]。目前,导致RA骨侵蚀的具体机制尚不清楚。众多学者认为,其可能与骨代谢失衡有关。RA滑膜组织中巨噬细胞和FLS异常增多,导致滑膜异常增厚和血管翳形成,从而进一步活化血管翳旁破骨细胞,抑制成骨细胞的形成,导致骨代谢平衡被破坏[4-5]。本课题组前期研究发现,RA-FLS的RANKL表达增加,而RANK-RANKL-骨保护素(osteoprotegerin, OPG)信号通路是调节破骨细胞分化成熟的主要信号通路。M-CSF和RANKL是诱导破骨细胞分化的2个重要的细胞因子,可诱导单核/巨噬细胞向破骨细胞分化[3]。
RA患者滑膜处于2%~4% O2浓度的低氧环境[9]。低氧环境对破骨细胞的分化和成熟的影响仍然存在争议。Muzylak等[10]研究发现,氧浓度是调节猫体内破骨细胞形成的重要因子,低氧能促进破骨细胞生成及破骨细胞骨吸收。Wang等[11]研究发现,与正常雌性大鼠相比,低氧可以改变去卵巢的雌性大鼠骨微环境,抑制成骨细胞分化,促进破骨细胞形成,从而减少骨形成,增加骨吸收,加速骨侵蚀。然而,Ma等[12]研究发现,低氧环境能通过调节JNK和IκBα的磷酸化抑制破骨细胞分化和骨吸收。Gorissen等[13]也发现,与常氧环境相比,在低氧环境下破骨形成减少。本研究为了更加符合RA患者的关节微环境,采用恒定低氧,且尽量减少常氧环境中更换培养液的时间。结果显示,与常氧环境相比,低氧环境中破骨细胞的分化和骨吸收增加,说明低氧能够促进RAW264.7细胞向破骨细胞分化,增强TRAP活性,促进破骨细胞骨吸收。破骨细胞标志基因TRAPmRNA的表达水平也与之相一致。
本研究发现,低氧环境下PADI4 mRNA表达水平增加,且与破骨细胞标志基因TRAPmRNA表达协同升高。PADI4是PADI的一个亚型,在Ca2+存在的情况下催化肽链上的精氨酸残基转化为瓜氨酸残基。众多研究发现,在RA外周血和滑膜组织高表达的PADI4参与了RA的发生和发展[14]。为了进一步研究PADI4在调控巨噬细胞向破骨细胞分化过程中是否起关键作用,本研究采用2种不同方法抑制细胞中PADI4的表达,包括PADI4抑制剂Cl-amidine和PADI4-siRNA-MSN。经验证2种方法均成功抑制了RAW264.7细胞中PADI4的表达。研究结果显示,低氧环境下抑制巨噬细胞PADI4的表达能够显著抑制巨噬细胞向破骨细胞分化和破骨细胞骨吸收。然而,常氧环境下抑制PADI4的表达对诱导巨噬细胞向破骨细胞分化无明显影响。因此推测,在低氧环境下巨噬细胞中高表达的PADI4可能参与了破骨细胞的分化和骨吸收。这与一些体内试验的研究结果相一致。如抗PADI4抗体阳性患者的骨侵蚀程度显著高于阴性患者[15];在RA小鼠模型中抗瓜氨酸化抗体会加剧关节组织的损伤[16]。这些均可能与PADI4促进破骨细胞形成相关。在后续的研究中本课题组将进一步进行探讨。
综上所述,本研究证实低氧环境可以显著促进巨噬细胞向破骨细胞分化和骨吸收,PADI4可能在其中扮演着重要的角色,从而在RA关节骨质破坏过程中起重要的作用。

