超高效液相色谱-串联质谱法快速测定水稻中的13种植物激素含量
张庆,李诚至,林钰涓,于晓章
(桂林理工大学环境科学与工程学院,广西桂林 541006)
植物激素是植物产生的痕量的并对植物生长发育起至关重要作用的信号分子物质[1-3]。吲哚乙酸(IAA)、脱落酸(ABA)、赤霉素3(GA3)参与了植物从种子休眠、萌发、营养生长到生殖生长,以及成熟和衰老的整个生命过程,茉莉酸(JA)、水杨酸(SA)是2 种主要的胁迫激素,受到胁迫的调控,在植物的胁迫耐受性和抗逆性中发挥着重要作用[4-6]。但是,植物激素在大多数组织中的含量很低[7,8],通常在10-6~10-9g 之间,性质不稳定,与其共存的成分非常复杂,检测时容易受到干扰。同时有些植物材料非常珍贵,材料量少,因此要求检测的方法必须简便、快速、灵敏、专一[9-11]。
目前植物激素的使用不当或滥用现象导致的食品安全问题日益增多[3],从食品安全的角度来看,建立一种实用准确的水稻中植物激素残留分析方法显得非常必要。目前,植物激素的测定主要采用色谱/质谱联用技术[12-18]。气相色谱(GC)/质谱(MS)联用在灵敏度问题上能满足植物激素的测定要求,但样品需要纯化、浓缩和衍生化处理,增加了样品前处理步骤[19,20]。超高效液相色谱(UPLC)-串联质谱(MS/MS)具有高灵敏度和高选择性,可以满足植物粗提液中植物激素的定量测定,同时还很大程度上简化了样品前处理程序。
目前,基于液相色谱(LC)-串联质谱(MS/MS)联用方法对植物激素的分析,大多集中在生长素(IAA)、赤霉素3(GA3)、脱落酸(ABA)、茉莉酸(JA)和水杨酸(SA)等几种植物激素,存在可检测的植物激素种类偏少等问题[2,4,7]。本实验采用超高效液相色谱-串联质谱法,建立一种同时测定水稻中赤霉素3(GA3)、赤霉素1(GA1)、异戊烯基腺嘌呤(IPA)、水杨酸(SA)、吲哚乙酸(IAA)、脱落酸(ABA)、茉莉酸(JA)、赤霉素7(GA7)、赤霉素4(GA4)、茉莉酸异亮氨酸(JA-ILe)、油菜素甾酮(CS)、12 氧代植物二烯酸(12-OPDA)和香蒲甾醇(TY)等13 种植物激素含量的分析方法,为水稻中植物激素的分析提供参考。
1 实验部分
1.1 仪器与试剂
Agilent 1290 超高液相色谱仪串联AB SCIEX 5500 Qtrap 质谱仪。美国MET QL-866 涡旋混匀仪(13111-V-220)。冷冻离心机(H1650-W)。色谱柱Waters,ACQUITY UPLC BEH C18(2.1 mm×100 mm,i.d.1.7 µm)。甲酸购自Fluka,乙腈、甲醇购自Merck。所有植物激素的标准品均购自Olchemim。实验用水均为Milli-Q plus 去离子水。
1.2 标准物质的配制
准确称取1.0 mg 的赤霉素3、赤霉素1、异戊烯基腺嘌呤、水杨酸、吲哚乙酸、脱落酸、茉莉酸、赤霉素7、赤霉素4、茉莉酸异亮氨酸、油菜素甾酮、12氧代植物二烯酸和香蒲甾醇溶解在甲醇溶液中,配制成浓度为1 mg/mL 的单标储备溶液。取适量的单标准储备溶液,配制成混合标准储备溶液。其中,各植物激素浓度为1 μg/mL。将上述溶液用甲醇逐级稀释,用于绘制标准工作曲线。
1.3 色谱质谱条件
色谱条件:流动相,A 液为0.04%甲酸-水溶液,B 液为0.04%甲酸-乙腈溶液。样品置于4℃自动进样器中,柱温45℃,流速为400 μL/min,进样量4 μL。梯度洗脱设置如下:0~10 min,B 液从2%线性变化到98%,A 液相应的从98%线性变化到2%;10~11.1 min,B 液从98%线性变化至2%,A 液相应的从2%线性变化到98%;11.1~13 min,B 液维持在2%,A 液相应的维持在98%。
质谱条件:电喷雾电离子源(ESI),扫描方式为负离子扫描多反应监测模式(MRM)。ESI 条件如下:Source Temperature(离子源温度):500℃;Ion Source Gas1(辅助加热气1):45;Ion Source Gas2(辅助加热气2):45;Curtain Gas(气帘气):30;Ion Sapary Voltage Floating(电喷雾电压):-4500 V。
1.4 植物激素的提取
植物激素的提取参考文献[21,22]。具体实验方法如下,将水稻叶片组织样品液氮研磨,取100 mg 样品于2 mL 离心管中,加入1 mL 甲醇-乙腈-水溶液(40:40:20,V/V),震荡混匀2 min;4℃避光抽提12 h,14000 r/min 离心10 min,取上清液800 μL,氮气吹干,用200 μL 甲醇-水溶液(50:50,V/V)定溶,14000 r/min 离心10 min,取上清液进样分析。
2 结果与讨论
2.1 定容溶剂选择
实验比较了水、甲醇-水(50:50,V/V)、甲醇、乙腈、甲醇-乙腈(50:50,V/V)和乙腈-水(50:50,V/V)6 种定容溶液的对植物激素峰形、响应强度以及出峰时间的影响[21,22],结果分别如图1a、1b、1c、1d、1e 和1f 所示。结果表明,纯水作为定容溶剂,部分目标分析物(3 号峰异戊烯基腺嘌呤和10 号峰茉莉酸异亮氨酸)响应强度较低(图1a)。甲醇作为定容溶剂,出峰时间较早的目标分析物如赤霉素3、赤霉素1等的色谱峰出现明显分叉(图1c)。含有乙腈的溶液[乙腈-水(50:50,V/V)、乙腈和甲醇-乙腈(50:50,V/V)],出峰时间普遍较长(图1d、1e 和1f),并且吲哚乙酸、12 氧代植物二烯酸、香蒲甾醇峰形拖尾严重。定容溶剂选择甲醇-水(50:50,V/V)时目标分析物的响应强度较高,且目标分析物峰形均较好(图1b)。综合考虑,本文以甲醇-水(50:50,V/V)为定容溶剂。
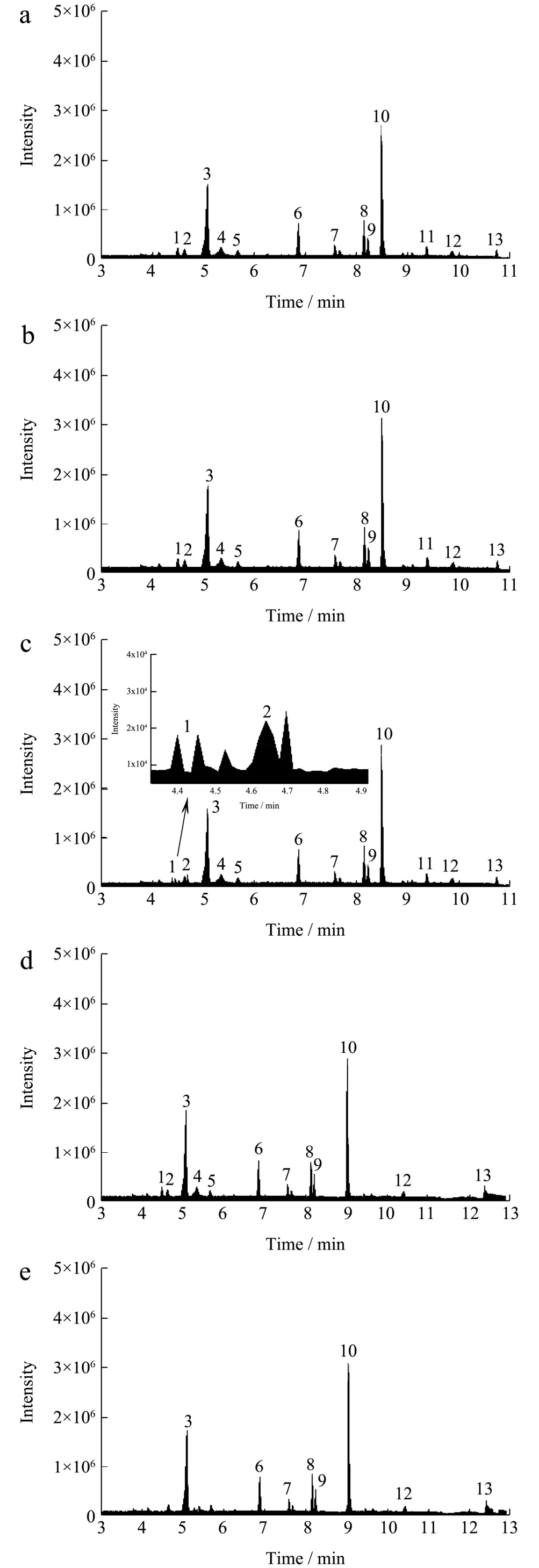

图1 不同定容溶剂时13 种植物激素的总离子流图 Fig.1 Total ion chromatogram (TIC) of thirteen plant hormones at different solvents
2.2 色谱柱的选择
对于植物激素这类弱极性物质,实验选择Waters ACQUITY UPLC BEH C18 色谱柱。ACQUITY UPLC BEH C18 色谱柱具备pH=1~12 范围内的化学稳定性,能够影响可电离化合物的保留性、选择性和灵敏性,同时还能在低pH 和高pH 条件下保持优异的柱稳定性。
2.3 色谱条件优化
考察了流动相对分离的影响,直接以乙腈-水溶液作为流动相时,13 种植物激素的混合标准样品不能完全分离,色谱峰拖尾严重。甲酸可以抑制样品基质的电离,改善色谱峰的拖尾现象,因此流动相中需要加入甲酸。
实验对流动相中甲酸的用量(0.01%、0.02%、0.03%、0.04%、0.05%)进行了考察,发现甲酸含量为0.04%时分离效果最佳,既保证了13 种植物激素混合标样的有效分离,又改善了拖尾现象。因此最终确定流动相A 为甲酸-水溶液(0.04:99.6),B 为甲酸-乙腈溶液(0.04:99.6),并采用梯度洗脱方式进行洗脱。
2.4 质谱条件优化
植物激素的检测有采用正离子模式,也有采用负离子模式[12,13]。在正离子模式下,部分物质产生了[M+Na]+、[M+K]+的离子峰。其中,[M+Na]+和[M+K]+可能是水中的Na+,K+引起的。在负离子模式ESI(-)下,13 种植物激素都产生了响应较强的[M-H]-。综合考虑,本实验选择负离子模式[ESI(-)]。其次,优化化合物的子离子和碰撞能量,选择丰度较高的两个子离子作为化合物的特征离子对,并对电喷雾电压、离子源温度、碰撞气、扫描驻留时间,去簇电压及碰撞电压等参数优化,确定出最佳的质谱参数。所有植物激素的质谱参数见表1。最佳色谱质谱条件下的13 种植物激素总离子流图如图1b 所示。

表1 13 种植物激素的质谱参数 Table 1 The mass spectrum of thirteen plant hormones
2.5 线性关系和检出限
标准物质储备液用甲醇稀释配制成10 μg/mL 标准溶液,然后再稀释至ng/mL 标准工作液系列。以上述色谱质谱条件,对系列标准工作液进行分析,以植物激素浓度为x 轴,所对应的峰面积为y 轴,绘制标准曲线,并进行线性回归,得到回归方程和相关系数(R2),以信噪比(S/N)为3 确定化合物的检出限(LOD),具体见表2。线性范围在1~500 ng/mL 之间,R2均大于0.9980,LOD 最低至0.310 ng/mL。

表2 13 种植物激素的线性方程、相关系数、检出限(LOD)Table 2 Linearity,correlation coefficient (R2) and detection limits of thirteen plant hormones
2.6 回收率和精密度
在处理的样品中添加标准混合溶液,制备1、50、100 ng/mL 三个浓度加标水平的样品,每个浓度水平设3 个平行样品。用本方法进行测定,平均回收率和相对标准偏差见表3。添加3 个不同浓度(1、50、100 ng/mL)的植物激素标准溶液,13 种植物激素的平均加标回收率为81.90%~118.80%,RSD 均小于8.12%,方法的准确度和精密度均符合检测要求。各植物激素在保留时间区域内无干扰,故本方法具有较好的选择性。

表3 回收率与相对标准偏差试验结果 Table 3 Recovery and relative standard deviation (RSD) of thirteen plant hormones (n=3)
2.7 实际样品分析
研究选取湘早籼45 号、汕优63 号和桂朝2 号三个品种的水稻样品。将测得的植物激素的峰面积代入上述工作曲线中,经过换算,得到相应的水稻中植物激素含量,如表4 所示。从表4 中可以看出,三个品 种水稻中GA3 和ABA 含量较多,研究表明GA3 和植物生长、细胞伸长相关并且促进代谢,而ABA 对植物成花的诱导和发育具有重要调控作用[21]。此外,GA4 是具有生物活性的赤霉素,能够促进茎的生长[21];GA7 可以打破某些种子的休眠,提高结实率[22];JA-ILe 可以增强植物遭遇损伤或者虫鸟取食后产生局部防御反应能力[22];CS 是一种能促进植物茎杆伸长和细胞分裂的高活性物质,亦可防御环境胁迫[23,24]。最后,通过比较可以看出,不同品种的水稻中植物激素含量有些差异。

表4 水稻样品中的13 种植物激素含量 Table 4 The content of thirteen plant hormones in rice samples
2.8 方法对比分析
将本研究所得的结果与文献中的检测方法检出限进行了对比,结果如表5 所示。从表5 中我们可以看出,本研究建立的多种激素测定方法大部分都比文献中所报道的检测方法检出限更低,并且检出的植物激素种类更多。关于GA1、IPA、GA4、GA7、JA-ILe、CS、12-OPDA 和TY 含量测定的方法文献中鲜有报道。本研究建立的测定方法,能够很好地应用于GA1、IPA、GA4、GA7、JA-ILe、CS、12-OPDA 和TY 等植物激素含量的检测。

表5 植物激素测定方法的检出限对比 Table 5 Detection limit comparsion of plant hormones
3 结论
本研究建立了超高效液相色谱-串联质谱法同时测定水稻组织中赤霉素3,赤霉素1,异戊烯基腺嘌呤,水杨酸,吲哚乙酸,脱落酸,茉莉酸,赤霉素7,赤霉素4,茉莉酸异亮氨酸,油菜素甾酮,12 氧代植物二烯酸和香蒲甾醇的方法。该方法简便快速,能够满足水稻中植物激素含量的要求,具有一定的实际应用价值。这将对深入研究水稻生长与发育过程、揭示水稻响应生物与非生物环境机制、提高水稻产量和品质以及鉴定植物激素残留限量等方面具有重要的实际应用与参考价值。

