肉桂精油气相熏蒸金黄色葡萄球菌的抗菌机理
段雪娟,韩雅莉,刘泽璇,张潼,徐雨锬,黄煜强,吴克刚*
(1.广东工业大学轻工化工学院,广东广州 510006)(2.广东工业大学生物医药学院,广东广州 510006)(3.通标标准技术服务有限公司广州分公司,广东广州 510663)
精油是从植物的分泌组织中提取的具有一定生物活性的挥发性油状物质,其生理活性包括消炎抗菌,抗癌抗氧化、抗病毒以及镇静镇痛等。而肉桂精油是从肉桂树皮、树枝或树叶中提取的具有广谱抑菌性能的挥发性物质,呈淡黄色至深棕色。其中主要成分是肉桂醛,具有抗菌、抗病毒、抗肿瘤等作用[1]。金黄色葡萄球菌是一种能导致多种疾病的兼性厌氧革兰氏阳性菌,能够感染人类和动物,是最主要的人畜共患细菌病原体之一[2,3]。其生长对营养的要求不高,致病力强,因此人受其感染的途径和方式很多,引起食物中毒、皮肤和软组织感染、部分炎症。由于精油对致病菌有抑制以及杀灭的作用,近年来在抑菌方面得到了广泛的应用和研究。蒋书歌等[4]制备柑橘精油纳米乳液抑制金黄色葡萄球菌,特别对乳液稳定性以及不同柑橘精油成分的差异的抑菌能力作了对比实验。李咏梅等[5]总结了以肉桂、丁香为代表的6 种南药的抑菌活性成分分析以及作为食品抗菌剂的应用前景。Azi Mouna 等[6]人研究了阿尔及利亚紫檀精油对金黄色葡萄球菌、白色念珠菌等6 种致病菌的抑菌活性并分析其潜在药用价值。
植物精油抗菌机理的研究包括精油对致病菌的抑菌机理以及各种有效成分对致病菌的抗菌研究[7,8],大部分的抑菌研究均属直接接触抗菌的范畴,而关于气相抗菌机理的相关研究很少。本文主要通过分析肉桂精油气相熏蒸金黄色葡萄球菌的抑菌机理,以金黄色葡萄球菌为微生物模型,通过透射电镜观察肉桂精油气相熏蒸处理对菌体超微结构的影响,通过电导率、OD260的测定检测肉桂精油气相熏蒸对菌体细胞膜渗透作用的影响,通过荧光光谱、傅里叶变换红外光谱等探究肉桂精油对金黄色葡萄球菌菌体蛋白的影响,从而探究肉桂精油对金黄色葡萄球菌的杀菌机理,为开发以植物精油为原料的新型植物消毒杀菌剂提供理论基础。
1 材料与方法
1.1 实验材料与试剂
金黄色葡萄球菌(Staphylococcus aureus,ATCC65389),实验室提供;肉桂精油(99%),广东工业大学香飘三创众创平台提供;营养琼脂,广东环凯微生物科技有限公司;铜网,海德创业生物科技有限公司;其他试剂均为分析纯;实验用水均为去离子水。
1.2 实验仪器与设备
紫外分光光度计(TU-1950),北京普析通用仪器公司;电导率仪(DDSJ-308A),上海仪电科学仪器股份有限公司;透射电子显微镜(HT7700),日本日立公司;电子天平(TP-114),北京赛多利斯科学仪器有限公司;高压蒸汽灭菌锅(YXQ-70A),上海博讯;培养箱(LRH-70F),上海一恒;超净工作台(SW-CJ-2F),上海申安医疗器械厂;真空冷冻干燥机,宁波新芝;荧光光谱仪(FluoroMax-4),美国HORIBA Jobin Yvon 公司;傅里叶变换红外光谱仪(Nicolet 6700),赛默飞世尔科技。
1.3 实验方法
1.3.1 菌种的活化及配制菌悬液
取金黄色葡萄球菌菌种接种于营养琼脂,经过24 h 的活化后,划线培养使得单个菌落在营养琼脂平板上分离,取单个菌落用灭菌后的去离子水稀释成0.5麦氏单位的菌悬液,备用。
1.3.2 肉桂精油气相熏蒸金黄色葡萄球菌活性的测定
将50 μL 上述菌悬液加入到已冷却至室温的营养琼脂培养基上,用涂布棒涂匀,待菌液完全吸收后将培养板倒置,取不同浓度的肉桂精油(丙二醇稀释)0.40 mL 滴加在各培养皿的皿盖中央,封口膜密封并于37℃的培养箱中倒置培养24 h,观察平板上菌体的生长情况。将完全不长菌的平板所对应的最低浓度作为最低抑菌浓度(minimum inhibitory concentration,MIC)。在完全不长菌的平板上用6 mm 无菌打孔器打取直径为6 mm 菌块转移到新鲜的营养琼脂平板中央,放入37℃培养箱中继续培养24 h,观察抑菌效果,测量菌落直径。每个浓度梯度3 个平板,取平均值。并做空白对比。菌圈仍然不长菌的平板对应的最低浓度为最低杀菌浓度(minimum bactericidal concentration,MBC)。
1.3.3 肉桂精油气相熏蒸金黄色葡萄球菌透射电镜(TEM)实验
取正常培养和经肉桂精油处理(浓度0.25 μL/mL、1.00 μL/mL,处理24 h)的金黄色葡萄球菌含菌平板,刮少量菌体于1.50 mL 的离心管中,加入200~400 μL的2.5%戊二醛溶液覆盖住菌体,放在4℃的冰箱里冷藏固定4~6 h,固定后,用PBS 缓冲液洗3 次,洗一次离心一次,离心参数为:10000 r/min,3 min,最后弃去上清液。再依次加入200 μL 的30%、50%、70%、95%和100%的乙醇溶液进行10 min 梯度洗脱,然后再次离心弃上清液,用无水乙醇使菌体分散重悬,滴加1~2 滴于铜网上,使其自然干燥。
透射电子显微镜采用80 kV 加速电压观察菌体,并拍照。
1.3.4 肉桂精油气相熏蒸金黄色葡萄球菌对其电导率值的影响
1.3.4.1 不同精油浓度对金黄色葡萄球菌电导率的影响
将金黄色葡萄球菌在37℃培养24 h 后,吸取0.40 mL 不同浓度的精油至皿盖,使得平板空间内浓度分别达到0.0625 μL/mL、0.125 μL/mL、0.25 μL/mL、0.5 μL/mL、1 μL/mL,同时做空白对比。熏蒸24 h,用无菌蒸馏水洗脱平板菌落,制成菌悬液,将各菌液调OD600nm至1.0±0.01,用电导率仪测其电导率值。每个浓度做三次平行,取其平均值。
1.3.4.2 不同气相熏蒸时间对金黄色葡萄球菌电导率的影响
将金黄色葡萄球菌在37℃培养24 h 后,吸取0.40 mL 肉桂精油至皿盖,使得平板空间内浓度达到0.5 μL/mL,熏蒸处理时间分别为0.5 h、1 h、1.5 h、2 h、2.5 h、3 h,同时作空白对比。用无菌蒸馏水洗脱平板菌落,制成菌悬液,将各菌液调OD600nm至1.0±0.01,用电导率仪测其电导率值。每个处理时间做三次平行,取其平均值。
1.3.5 肉桂精油气相熏蒸金黄色葡萄球菌对其核酸的影响
1.3.5.1 不同精油浓度熏蒸对金黄色葡萄球菌核酸的影响
将金黄色葡萄球菌在37℃培养24 h 后,将配成不同浓度的精油吸取0.40 mL 至皿盖,使得平板空间内浓度达到0.0625 μL/mL、0.125 μL/mL、0.25 μL/mL、0.5 μL/mL、1 μL/mL,同时做空白对比。熏蒸24 h,用无菌蒸馏水洗脱平板菌落,制成菌悬液,将各菌液调OD600nm至1.0±0.01,离心后取上清液3 mL,测其260 nm 处的吸光度。每个浓度做三次平行,取其平均值。
1.3.5.2 不同气相熏蒸时间对金黄色葡萄球菌核酸的影响
将金黄色葡萄球菌在37℃培养24 h 后,吸取0.40 mL 肉桂精油至皿盖,使得平板空间内浓度达到0.5 μL/mL,熏蒸处理时间为0 h、0.5 h、1 h、1.5 h、2 h、2.5 h、3 h,用无菌蒸馏水洗脱平板菌落,制成菌悬液,将各菌液调OD600nm至1.0±0.01,离心后取上清液3 mL,测其260 nm 处的吸光度。每个浓度做三次平行,取其平均值。
1.3.6 肉桂精油气相熏蒸对金黄色葡萄球菌蛋白质二级结构的影响
参照文献[9],取不同浓度肉桂精油处理的含菌平板,用10 mL 0.05 mol/L pH 7.2 的PBS 缓冲液收集菌体,4℃ 10000 r/min 离心10 min,弃上清液;用PBS缓冲液洗涤2 次,4℃ 10000 r/min离心10 min,弃上清液,真空冷冻干燥。取少量菌体粉末与KBr 压片,用Nicolet 6700 傅里叶变换红外光谱仪在400~4000 cm-1光谱范围内,首先对压片样品进行扫描,再对背景进行扫描,获取FT-IR 谱图,仪器分辨率为2 cm-1,扫描次数为16 次。
谱图处理:用OMNIC 软件将得到的FT-IR 光谱图转换成吸光度模式,并对其进行基线校正、自动平滑、纵坐标归一化处理,使其标准化和归一化,以提高信噪比。并在OMNIC 中取酰胺Ⅰ带特征峰的图谱(1600~1700 cm-1)保存为数据模式。将所得酰胺Ⅰ带特征峰的图谱数据用Origin 软件生成折线图,取其二阶导数,在Peakfit 软件中校正基线,用二阶导数拟合,多次拟合使残差最小,根据峰面积计算各二级结构的变化和比率。
1.3.7 肉桂精油气相熏蒸对金黄色葡萄球菌蛋白质三级结构的影响
将金黄色葡萄球菌在37℃培养24 h 后,将配成不同浓度的精油吸取0.40 mL 至皿盖,使得平板空间内浓度达到0.0625 μL/mL、0.125 μL/mL、0.25 μL/mL、0.5 μL/mL、1 μL/mL,同时做空白对比。熏蒸24 h,用10 mL 0.05 mol/L pH 7.2 的PBS 缓冲液洗脱平板菌落,4℃ 10000 r/min 离心10 min。弃去上清液,用PBS缓冲液悬浮菌体将各菌悬液调OD620nm至0.4±0.02,用荧光分光光度计测量菌悬液中氨基酸残基发出的荧光值。在300~500 nm 内扫描样品的发射光谱,激发光谱和发射光谱光栅的缝宽为5 nm。
1.3.8 数据处理
每个样品重复3 次实验,使用Origin 8.1 软件对试验数据进行分析及作图,其中电导率、OD260nm值等以平均值±标准差表示。利用Omnic、Origin 8.1 软件对红外数据进行分析处理,并利用Peakfit 软件处理及作图。
2 结果与讨论
2.1 肉桂精油对金黄色葡萄球菌气相抗菌活性的研究
根据实验方法,用1.5×108CFU/mL 的大肠杆菌菌悬液50 μL 涂布平板,将肉桂精油以丙二醇稀释,加在培养皿皿盖上,使其在培养皿空间的精油组分浓度依次为:1、0.5、0.25、0.125、0.0625 μL/mL,于37℃培养24 h,观察平板长菌情况如下表1 所示。

表1 肉桂精油对金黄色葡萄球菌的气相抑制作用 Table 1 Vapor-phase antibacterial effect of EOL on S.aureus
由实验结果可知,肉桂精油气相熏蒸金黄色葡萄球菌的最低抑菌浓度(MIC)为0.25 μL/mL。用无菌的打孔器在平板上打取直径为6 mm 的菌块,菌斑朝下放入另一新鲜平板中央。于37℃下培养24 h,发现肉桂精油浓度0.25 μL/ml 对应的菌块长到6.5 mm,而肉桂精油浓度0.5 μL/mL 及以上浓度对应的菌块依然是6 mm,由此可知,肉桂精油气相熏蒸金黄色葡萄球菌的最低杀菌浓度(MBC)为0.50 μL/mL。
2.2 肉桂精油气相熏蒸金黄色葡萄球菌透射电镜(TEM)研究
气熏处理前的金黄色葡萄球菌如图1a 所示,呈正常的形态结构,菌体为圆球状,表面饱满光滑,细胞外部屏障—细胞壁、细胞膜等结构完整,细胞内细胞质分布均匀。图1b、图1c 为不同精油浓度处理下的金黄色葡萄球菌的形态结构。由图可知,经过精油气熏后的金黄色葡萄球菌形态发生变化,精油浓度越高,细胞皱缩程度越大,结构层次模糊不清,细胞皱缩,细胞内容物也发生收缩,菌体的细胞膜破损或溶解,使得细菌内容物发生外漏。Zhang Chenghui 等[10]发现丁香精油能破坏李斯特菌致密的生物膜结构;Zhao Meimei 等[11]通过透射电镜观察到从黑茶中提取的酚类化合物中的花青素-3-O-葡萄糖苷对金黄色葡萄球菌生物膜有损伤,造成碱性磷酸酶、乳酸脱氢酶、蛋白质和DNA 渗漏,可见,植物提取物在一定程度上可破坏细菌细胞膜并造成内容物外泄。

图1 不同浓度肉桂精油熏蒸处理的金黄色葡萄球菌透射电镜图 Fig.1 TEM microgragh of S.aureus treated with different concentration EOL
2.3 肉桂精油气相熏蒸对金黄色葡萄球菌电导率值的影响
菌体细胞膜受到破损后,细胞内的部分离子K+、Na+等进入外界液体中,离子从高浓度到低浓度环境的细胞进出方式为协助扩散,需要载体蛋白配合通过细胞膜到达菌液环境。离子进入外界液体后,造成外界液体电解质含量增加,电导率值提高,因此,可以通过电导率的改变进一步分析菌体细胞膜通透性的变化[12],不同浓度肉桂精油熏蒸(24 h)和不同时间熏蒸(0.5 μL/mL)菌液的电导率变化如图2 所示。
如图2a 所示,不同浓度的肉桂精油对金黄色葡萄球菌进行气相熏蒸后,随着浓度的增高,电导率的变化趋势是先增高后降低再升高最后趋于平缓。在精油浓度为0~0.0625 μL/mL 时,经过精油熏蒸后菌体的细胞膜通透性提高,电导率从444 μs/cm 提高至523.5 μs/cm,此时载体蛋白未发生变性,离子从胞内到达菌液环境的速率提高,电导率值升高;在精油浓度0.0625~0.25 μL/mL 范围内,电导率值有所下降,最低到达439 μs/cm,这可能是因为随着精油浓度的提高,使载体蛋白发生了变性,限制了协助扩散的进行,因此离子透过细胞膜受到阻碍,电导率值降低;随后的精油达到一定浓度时,细胞膜破损程度较大,胞内离子直接流出,电导率再次升高,从439 μs/cm 升高至559.5 μs/cm。最后电导率趋于稳定,可能是因为细胞膜通透性达到最高,菌体死亡[13],细胞内容物大量进入菌悬液中,电导率达到相对平衡。

图2 (a)不同精油浓度下菌液的电导率;(b)不同精油熏蒸时间下菌液的电导率 Fig.2 (a) Effect of different EOL concentration on alternation of electric conductivity;(b) Effect of different fumigation time on alternation of electric conductivity
由图2b 可知,在0~3 h 的处理时间内,随着肉桂精油对金黄色葡萄球菌气相熏蒸处理时间的增加,电导率总体上是先上升后下降,且有明显的变化趋势。经过气熏处理与未处理的337.5 μs/cm 相比,电导率均有所升高,在439~650.5 μs/cm 的范围内变化,这表示尽管不同的处理时间细胞膜的改变程度不同,但在0~3 h范围内经过气熏处理后细胞膜的通透性确实提高,其中,在气熏2 h 时,电导率最高,达到650.5 μs/cm,说明此时细胞膜的通透性最高。这可能是因为,刚开始肉桂精油对金黄色葡萄球菌进行气熏时,需要时间吸附于细胞膜上,与细胞膜上的脂质磷脂层慢慢互溶,通透性逐渐增加,从而使得使得胞内离子渗出,电导率升高。2 h 后,精油分子达到平衡,慢慢向细胞膜内部扩散,堵住离子通道,使得电导率降低。
2.4 肉桂精油气相熏蒸对金黄色葡萄球菌核酸的影响
菌体细胞膜渗透性发生改变时,导致细胞内含有的生物大分子核酸等发生泄露,因此可通过核酸的泄露情况间接反映细胞膜通透性的改变,进而判断细菌的存活状态。有研究表明,DNA、RNA 能够强力吸收260 nm 处的紫外可见光,被称为260 nm 吸收物质,因此可通过紫外吸收法检测菌液离心后上清液中OD260nm处吸光度的变化值进一步判断菌体核酸的泄露程度[13,14]。
由图3 可知,经过肉桂精油熏蒸后金黄色葡萄球菌菌液的OD260值明显增高,且随着肉桂精油浓度的提高和气熏时间的延长,菌液的吸光值愈高,其中精油浓度对吸光值影响十分明显。

图3 (a)不同精油浓度下菌液的OD260;(b)不同精油熏蒸时间下菌液的OD260 Fig.3 (a) Effect of different EOL concentration on alternation of OD260;(b) Effect of different fumigation time on alternation of OD260
由图3a 所示,肉桂精油处理浓度为0、0.0625、0.125、0.25 μL/mL 时OD260值分别为0.285、0.778、0.88 和1.007,在浓度小于0.25 μL/mL 时,随着肉桂精油浓度的增大OD260值增加缓慢,到肉桂精油处理浓度为0.5~1 μL/mL 范围时,OD260值增长迅猛,且有持续上升的趋势。这可能是因为精油浓度低于0.25 μL/mL 时,细菌通过熏蒸只是抑制了生长,对细胞膜的影响比较小,随着浓度增大,精油对细胞的破坏趋于杀灭,对细胞膜的破坏也不断加重,因此细胞大分子核酸泄露加剧,OD260值也越来越大。该结果与申素霞[13]研究发现肉桂醛可损伤黄曲霉细胞生物质膜,使其孢子提取液的OD260值增大相似。由图3b 所示,肉桂精油气熏时间为0~3 h 范围内,随着熏蒸时间的增加,OD260值不断增大。在处理时间1 h 内,OD260值与气熏处理时间的延长呈线性关系,随后增长相对缓慢最终趋于平缓,说明随着时间的延长,菌体大分子核酸泄露程度越来越大,最后趋于平稳。
2.5 肉桂精油对金黄色葡萄球菌二级结构的影响
反应蛋白质二级结构最重要的红外特征是酰胺Ⅰ带(1700~1600 cm-1)、酰胺Ⅱ带(1600~1500 cm-1)。其中酰胺Ⅰ带最能反应蛋白质二级结构的变化。
如图4 所示,随着肉桂精油的加入,金黄色葡萄球菌的谱图形状没有发生显著变化,但其透射率呈现降低的状态。肉桂精油熏蒸后,金黄色葡萄球菌的酰胺Ⅰ带峰值从1545.83 cm-1红移到1545.95 cm-1,酰胺Ⅱ带峰值从1653.25 cm-1红移到1654.51 cm-1,说明肉桂精油小分子与金黄色葡萄球菌发生了相互作用,并引起菌体蛋白的构象变化。
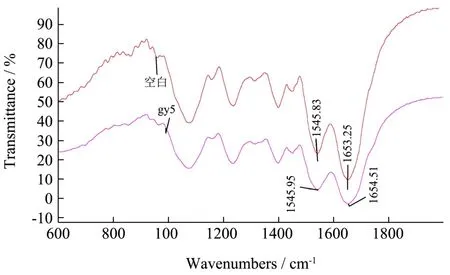
图4 加入肉桂精油前后金黄色葡萄球菌的傅里叶变换红外光谱图 Fig.4 FT-IR spectra of S.aureus without (a) and with (b) EOL
菌体红外光谱的酰胺Ⅰ带(1600~1700 cm-1区域)主要是其氨基酸残基C=O 的伸缩振动吸收,主要由蛋白质的螺旋、折叠、转角、无规则卷曲结构来反映。为了得到肉桂精油对蛋白质二级结构的影响,利用二阶导数拟合对酰胺Ⅰ带进行处理,得到如图5 所示的子峰。以下为各子峰与二级结构的对应关系:1700~1680 cm-1为反平行β-折叠,1680~1660 cm-1为β-转角,1660~1650 cm-1为α-螺旋,1650~1640 cm-1为无规卷曲,1640~1610 cm-1为β-折叠。蛋白质的二级结构中,蛋白质分子的致密性体现在α-螺旋结构,而其他结构如β-折叠、转角、无规则卷曲等反映了蛋白质分子的松散性[15]。计算结果如表2 所示。

表2 肉桂精油对金黄色葡萄球菌作用后的酰胺Ⅰ带红外光谱曲线峰值归属与拟合结果 Table 2 The curve fitting results of IR amide of Ⅰ S.aureus,S.aureus-0.25 μL/mL EOL and S.aureus-1 μL/mL EOL
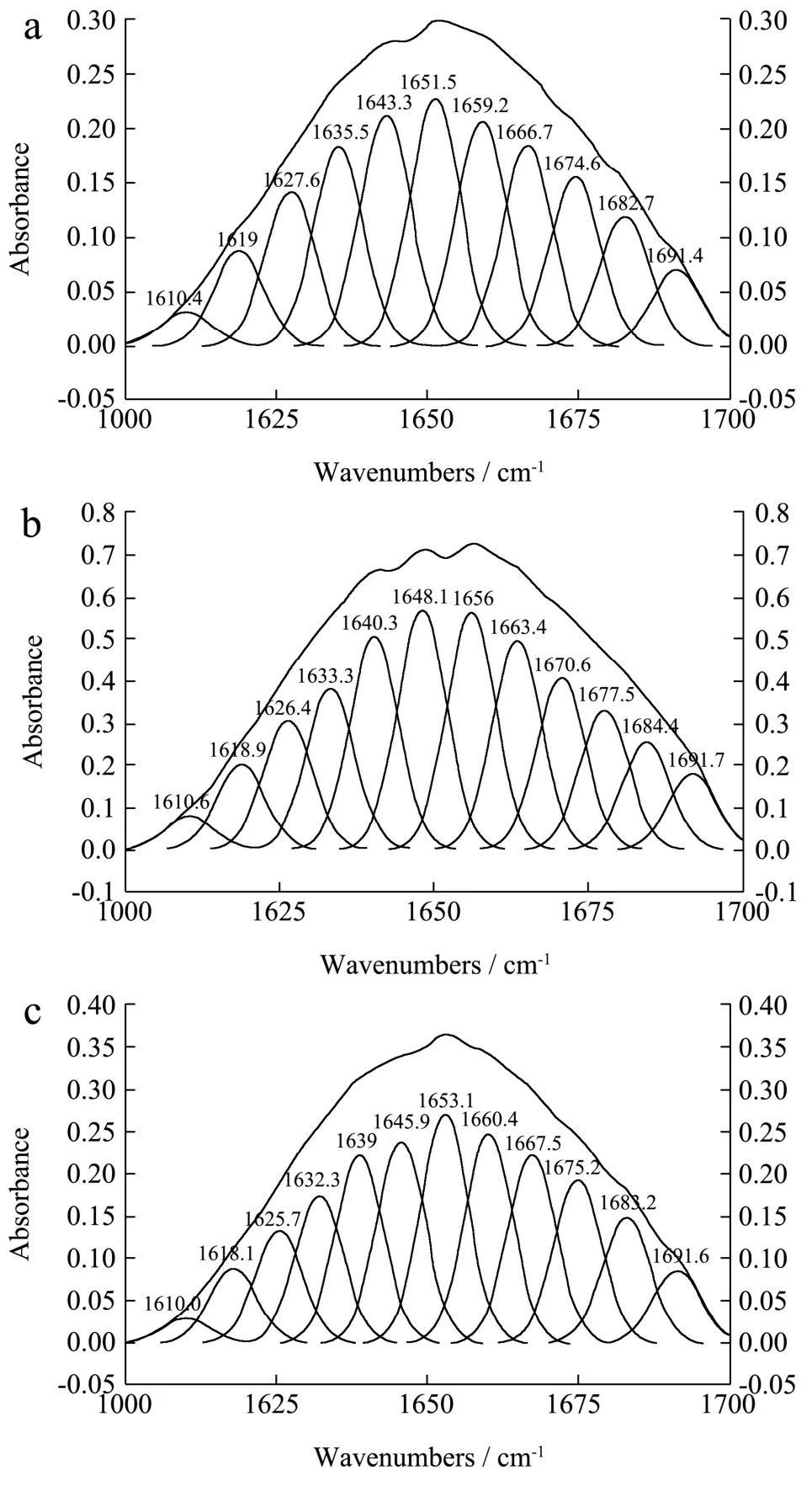
图5 金黄色葡萄球菌酰胺Ⅰ带(1600~1700 cm-1)谱图 Fig.5 Curvefitted results of amide Ⅰ bands of S.aureus treated by EOL with different concentration
从图6c、d、e、f 中可以看出,经过不同浓度的肉桂精油处理后,α-螺旋含量明显下降,降幅在8.7%~23.6%之间;β-折叠的含量随着肉桂精油浓度的增加呈现先增加再下降的变化;加入了肉桂精油的金黄色葡萄球菌β-转角的含量高于对照组,但随着精油浓度的增加含量变化不大。无规则卷曲随着肉桂精油浓度的增加呈现先轻微下降再增加的变化。

图6 金黄色葡萄球菌经过不同浓度的肉桂精油处理后蛋白质二级结构含量的变化 Fig.6 Varying contents of secondary structure of S.aureus treated by EOL with different concentration
经过肉桂精油处理后的菌体蛋白α-螺旋含量大大降低,蛋白质分子的致密性降低,这是肉桂精油与金黄色葡萄球菌体系中的主要相互作用力是氢键和范德华力[16],肉桂精油的加入使分子内部氢键的排列取向发生变化且破坏了菌体蛋白的氢键[17],从而降低了菌体α-螺旋的含量。此外,β-折叠的含量在肉桂精油达到一定浓度后也大幅降低,β-转角则有少量增加且含量稳定,无规则卷曲则有较大幅度的增加,如图6b所示增加了蛋白质二级结构中无序结构的百分比含量,反映了经肉桂精油气相熏蒸后的金黄色葡萄球菌蛋白质分子的松散性。
2.6 不同浓度肉桂精油熏蒸金黄色葡萄球菌对其膜蛋白荧光强度的影响
当抗菌剂与膜蛋白发生反应时,其构象会发生改变,原处于膜蛋白内部的氨基酸发色基团会暴露至细胞膜表面,金黄色葡萄球菌溶液中由于色氨酸、酪氨酸和苯丙氨酸的存在而具有内源荧光[18]。因此通过分子在基态和激发态下转变发出辐射产生的荧光,分析荧光强度和波长峰位的变化,可以判断不同浓度肉桂精油的处理对金黄色葡萄球菌三级蛋白结构的影响。
由图7 可知,经精油气熏后并没有改变金黄色葡萄球菌蛋白的最大发射峰峰位,但菌液荧光强度明显增加,在肉桂精油浓度0~0.125 μL/mL 的范围内,荧光强度随着精油浓度的增加而增加,具有显著性。
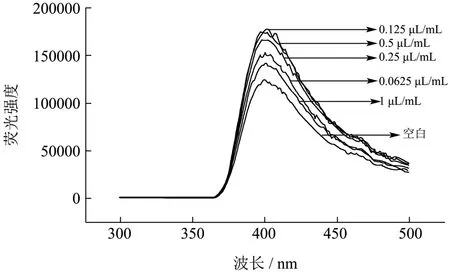
图7 不同浓度精油熏蒸下菌液的荧光强度 Fig.7 Fluorescence emission spectra of S.aureus treated by EOL with different concentration
当浓度达到0.25 μL/mL,荧光强度相对浓度为0.125 μL/mL 时反而降低,这可能是因为该浓度暴露的氨基酸发色基团苯丙氨酸含量相对较多,而苯丙氨酸含有羧基作为吸电子基团使得荧光减弱。在肉桂精油浓度为0.5 μL/mL时,菌液荧光强度相对0.25 μL/mL增加,但低于精油浓度为0.125 μL/mL 的发光强度,这是因为此时菌体一方面正在暴露发色基团,增强荧光吸收,另一方面,由于肉桂精油浓度过大,膜蛋白开始发生卷曲、折叠,使得部分已经外露的生色基团重新被包裹于蛋白大分子中,发生了荧光淬灭现象[17]。当肉桂精油浓度达到1 μL/mL 时,发色基团分子与肉桂精油相互作用、能量转换使得荧光减弱幅度更强,使所得荧光强度仅高于空白组。
3 结论
3.1 本实验通过对金黄色葡萄球菌活性的测定测得肉桂精油气相熏蒸的最低抑菌浓度为0.25 μL/mL,最低杀菌浓度为0.5 μL/mL。研究发现其抗菌机理主要是通过影响细胞膜的通透性,造成菌液电解质增加以及核酸等大分子外泄,随着肉桂精油浓度在0~1 μL/mL 范围内变化,菌液电导率值在439~559.5 μs/cm范围内变化,OD 值在0.285~2.754 内递增变化;当以浓度为0.5 μL/mL 的肉桂精油熏蒸时,随着熏蒸时间在0~3 h 内变化,菌液电导率值337.5~650.5 μs/cm 范围内整体上呈现先增大后减小的变化,OD 值在0.323~1.146 内变化。从透射电镜中可以观察到菌体细胞膜破损,边界变得模糊,从而使内容物外泄的结果,与电导率实验及OD260 所得结论相符。其次,肉桂精油气相熏蒸金黄色葡萄球菌的抗菌机理可能还包括对菌体蛋白质结构的影响。FT-IR 实验表明,在肉桂精油气熏后,蛋白质二级结构体现出了一定程度的松散性,以及通过荧光光谱判断菌体蛋白暴露了发色基团。
3.2 精油作为天然抗菌剂的发展的产物,逐渐成为食品保鲜领域的一种潮流。本实验为研究气相抗菌机制提供了理论基础,同时阐明肉桂精油气相熏蒸对金黄色葡萄球菌的致死机理。结果表明,肉桂精油气相熏蒸对金黄色葡萄球菌具有明显的杀菌作用,能使金黄色葡萄球菌的形态发生明显的变化,影响细胞结构、改变细胞膜通透性从而造成电解质外泄、核酸泄露、暴露氨基酸发色基团等。肉桂精油具有广阔的市场前景,今后应进一步研究肉桂精油在各类食品中的抗菌效果,扩大肉桂精油在食品中的应用。

