牛肉PCR-核酸试纸条快速鉴定方法的建立及试剂盒的研制
姜海瀛,张志杰,王艳双,张莉,高丽君,李明成,4,孙丽媛,张丽华
1(北华大学 医学技术学院,吉林 吉林,132013)2(北华大学 临床学院,吉林 吉林,132013)3(北华大学 医学院,吉林 吉林,132013)4(北华大学 吉林省中药DNA指纹检测技术科技创新中心,吉林 吉林,132013)5(吉林市第三十二中学,吉林 吉林,132013)6(吉林雷宁食品药品检测技术服务有限公司,吉林 吉林,132013)
肉类食品安全已经成为全球关注的公共安全问题,比如“欧洲的马肉风波”[1]、“沃尔玛狐狸肉事件”[2]等。肉类食品质量的好坏尤其是肉食品的真实性直接关系到人民群众健康和生命安全。普通消费者难以通过感官分辨掺假肉食品,执法部门目前也缺乏简便有效快速的实地检测技术手段,对掺假管控乏力。
基于蛋白的检测手段,由于不同组织细胞和不同生长阶段的表达水平不同,易受热加工变性的影响,用于肉类食品的鉴定存在局限性[3-4]。相反,核酸作为生物体的基本遗传物质, 广泛存在于各种组织细胞中即无组织特异性,但在同种生物体内核酸序列具有高度的保守性即具有种属特异性。并且,耐热性更好,结构更稳定,更有利于物种鉴别[5]。
是一种灵敏度高、特异性强、反应快速的检测方法。能够准确、快速、客观地鉴别肉类食品成分的动物来源,已经广泛地用于食品掺假成分的检测[6-7]。本团队利用多重PCR技术可快速高通量鉴定牛肉中常见掺假动物源性成分[8]。核酸试纸条是一种快速的免疫学测定方法[9],具有简单、快速、可视化、低成本等特点。PCR-核酸试纸条法融合二者的特点,目前此技术已经在转基因黑曲霉[10]、艾滋病毒[11]、丙型肝炎病毒[12]、线虫[13]、乙型肝炎病毒[14]、农药残留、兽药残留、兽医疫病的检测[15]中得到应用,适合基层单位就地检测,被认为是食品安全检测最有前途的新技术之一,已成为食品安全检测的主要发展趋势[16-17]。
1 材料与方法
1.1 实验材料
实验样品:牛肉、猪肉、马肉、羊肉、驴肉、鸡肉、鸭肉、狗肉、兔肉等均购于本地超市。实测样本购于本地农贸市场。样品为鲜品,生理盐水洗涤3次,去结缔组织和脂肪,保存在-20 ℃备用。
1.2 仪器与设备
Q6000超微量紫外-可见分光光度计,美国Quawell;T100 PCR仪、UV White-2020D紫外凝胶成像分析仪,美国Bio Rad公司;H-2050R高速冷冻离心机,长沙湘仪离心机仪器有限公司;LX-100手掌型离心机,江苏海门市其林贝尔仪器制造有限公司;DYY-8B稳压稳流电泳仪,北京市六一仪器厂;HH.S精密恒温水浴锅,江苏金坛市医疗仪器厂。
1.3 实验试剂
DL100 bp DNA Marker、λDNA/HindⅢ、2×TaqPCR Master Mix、氨苄青霉素(ampicillin,Amp)、5-溴4-氯-3-吲哚-β-D硫代半乳糖苷(5-bromo-4-chloro-3-indolyl β-D-galactoside,X-Gal)、异丙基β-D硫代吡喃半乳糖苷(isopropyl-beta-D-thiogalactopyranoside,IPTG)、DH5α感受态细胞、DNA凝胶回收试剂盒、pGM-T载体连接试剂盒、质粒DNA小量提取试剂盒,北京天根生化科技有限公司;引物由上海生物工程有限公司合成;一次性核酸试纸条,杭州优思达生物技术有限公司。
1.4 实验方法
1.4.1 基因组DNA的提取及质量鉴定
1.4.1.1 基因组DNA的提取
取肉类样品各100 mg置于1.5 mL离心管中,剪碎;加入P1细胞裂解液500 μL [ 10%十二烷基硫酸钠(sodium dodecyl sulfate,SDS)10 mL,1 mol/L Tris-HCl(pH值7.5) 1 mL,0.5 mol/L EDTA (pH 8.0) 2 mL,NaCl 0.58 g,20 mg/mL 蛋白酶K 1 mL,RNA酶5 μL,加灭菌ddH2O定容至100 mL],振荡混匀,55 ℃ 水浴1 h;加到DNA纯化柱中,12 000 r/min离心3 min,弃去过滤液,加入P2漂洗液600 μL [5 mol/L 乙酸钾26 μL,l mol/L Tris-HCl(pH 7.5) 18 μL,0.5 mol/L EDTA (pH 8.0) 3 μL,无水乙醇480 μL,无菌ddH2O 73 μL ],12 000 r/min离心1 min;弃去过滤液,重复洗涤1次,弃去过滤液,12 000 r/min离心2 min;将DNA纯化柱转移入另一离心管中,加入P3无菌ddH2O 100 μL,室温放置10~20 min后,12 000 r/min离心2 min;离心液即供试品DNA溶液,置-20 ℃保存备用。
1.4.1.2 基因组DNA的质量鉴定
利用琼脂糖凝胶电泳检测基因组DNA的完整性,并且取基因组DNA原溶液1 μL,利用微量核酸蛋白分析仪,分析样品的浓度(A260×50 ng/μL)及纯度(A260/A280)。
1.4.2 基因组DNA进行PCR扩增及结果检测
1.4.2.1 引物的设计与标记
牛肉引物序列来自GB/T 20190—2006[18],分别在引物的5′端进行标记,引物序列如下:上游引物5′(FAM)-ATGCTTAGAAGGGATGA-3′,下游引物5′(Biotin)-TAGGGAGGCTATTACG-3′,扩增片段长度为271 bp,由上海生物工程有限公司合成。
1.4.2.2 PCR反应条件的优化
取牛肉及其他肉类样品基因组DNA溶液、空白对照液各2 μL,加入试剂盒中PCR反应管23 μL反应体系中(其中10 μmol/μL上游引物、下游引物各1 μL,2×TaqPCR Master Mix 12.5 μL,灭菌ddH2O 8.5 μL),总体积25 μL。进行PCR扩增,PCR反应参数为94 ℃预变性5 min,20~30个循环(94 ℃ 30 s,56~59 ℃ 30 s,72 ℃ 30 s),72 ℃延伸5 min。
1.4.2.3 PCR产物检测
取PCR产物5 μL 加到2%(质量分数)琼脂糖凝胶孔中,在1×TBE电泳缓冲液中,100 V电泳40 min后,取凝胶在紫外分析仪上检视并拍照。取PCR产物5 μL滴加到试纸条的样品区,然后插入到含有95 μL展开缓冲液的试管中,2~3 min后即可见检测结果并拍照。
1.4.2.4 结果判定
供试品凝胶电泳图谱中,在与阳性对照品凝胶电泳图谱相应的位置上,在200~300 bp有1条DNA条带,空白对照无条带。供试品核酸试纸条图谱中,在与阳性对照品核酸试纸条图谱相应的位置上,出现2条红色条带,空白对照出现1条红色条带。
1.4.3 牛肉阳性对照品的克隆及序列验证
回收牛肉阳性对照品 PCR产物与pGM-T载体16 ℃过夜连接,转入DH5α感受态细胞,增殖4 h后取菌液30 μL涂布于含Amp、X-Gal和IPTG的LB固体培养基上37 ℃过夜,挑取白色菌落,在含Amp的LB液体培养基中培养过夜,提取质粒DNA进行PCR扩增验证为阳性重组DNA分子,送至上海生工采用正反2个引物双向测序,测序结果与靶基因进行比对分析。扩增区域DNA序列与牛靶基因特异性指纹区段DNA序列完全一致,同源性100%,确定为牛肉DNA阳性对照液。
1.4.4 牛肉DNA检测试剂盒的设计
试剂盒为20次用量,由8部分组成,包括DNA提取、PCR扩增和结果检测(表1)。

表1 自主研发牛肉DNA提取、PCR扩增和结果检测试剂盒的组成及特征Table 1 Composition and characteristics of self-developed beef DNA extraction, PCR amplification and results detection kit
1.4.5 试剂盒的评价
1.4.5.1 特异性
对牛肉正品及其他肉类样品在59 ℃,20个循环条件下进行PCR特异性扩增,核酸试纸条检测试剂的特异性,并用琼脂糖凝胶电泳进行验证。
1.4.5.2 重现性
对牛肉正品及其他肉类样品分别在3个实验室,由3位技术人员检测相同样品,核酸试纸条检测观察试剂的重现性,并用琼脂糖凝胶电泳进行验证。
1.4.5.3 稳定性
试剂盒配制后第3、6、9、12个月进行检测,核酸试纸条检测试剂的稳定性,并用琼脂糖凝胶电泳进行验证。
1.4.5.4 灵敏性
将牛肉正品DNA对照液进行101、102、103、104、105倍稀释,并进行PCR扩增,核酸试纸条检测试剂的灵敏性,并用琼脂糖凝胶电泳进行验证。
1.4.5.5 样品最低检出限
将牛肉正品及其他肉类样品(牛肉100 mg、其他肉类各0 mg,牛肉30 mg、其他肉类各8.75 mg,牛肉20 mg、其他肉类各10 mg,牛肉10 mg、其他肉类各11.25 mg,牛肉5 mg、其他肉类各11.875 mg)进行混合,提取基因组DNA,进行PCR扩增,利用核酸试纸条检测试剂的最低检出率,并用琼脂糖凝胶电泳进行验证。
1.4.6 实际样品检测
使用自主研发的试剂盒对市售9个样品进行检测,核酸试纸条鉴定样品的真伪,并用琼脂糖凝胶电泳进行验证。
2 结果与分析
2.1 基因组DNA的提取及质量鉴定结果
采用自主研发的试剂能够成功的提取出牛肉及其易混品的基因组DNA,经测定纯度为1.7~1.9,质量浓度为200~300 ng/μL。琼脂糖凝胶电泳结果显示,基因组DNA无降解(图1)。
2.2 PCR扩增反应条件的优化及扩增产物检测
如图2所示,利用GB/T 20190—2006中的反应条件,在56 ℃,30个循环进行PCR扩增,琼脂糖凝胶电泳结果显示,牛肉出现1条阳性条带,但是马和羊肉出现非特异性扩增条带,其余阴性对照及空白对照均无条带出现。

M-λDNA/HindⅢ;1-猪肉;2-牛肉;3-马肉;4-羊肉;5-驴肉;6-鸡肉;7-鸭肉;8-狗肉图1 基因组DNA电泳图谱Fig.1 Electrophoretic map of genomic DNA

M-DL100 bp Marker;1-牛肉阳性对照;2-牛肉正品1;3-牛肉正品2;4-猪肉;5-马肉;6-羊肉;7-驴肉;8-鸡肉;9-鸭肉;10-狗肉;11-兔肉;N-空白对照a-退火温度56 ℃,30个循环;b-退火温度57 ℃,25个循环;c-退火温度59 ℃,25个循环;d-退火温度59 ℃,20个循环图2 PCR反应条件筛选图谱Fig.2 Screening map of PCR reaction conditions
在57 ℃,25个循环下进行PCR扩增,琼脂糖凝胶电泳结果显示,只有牛肉样品出现1条阳性条带,其余阴性对照及空白对照均无条带出现。但是核酸试纸条检测结果显示,牛肉样品出现质控线(C线)、检测线(T线)2条红色条带,而马、羊、驴肉样品均出现2条红色条带(C线明显、T线均隐约可见),其余阴性对照及空白对照均出现C线1条红色带。
在59 ℃,25个循环进行PCR扩增,琼脂糖凝胶电泳结果显示,只有牛肉样品出现1条阳性条带,其余阴性对照及空白对照均无条带出现。但是核酸试纸条检测结果显示,牛肉样品出现C线、T线2条红色条带,而此时只有马肉样品出现2条红色条带(C线明显、T线均隐隐约约可见),其余阴性对照及空白对照均出现C线1条红色带。
在59 ℃,20个循环进行PCR扩增,琼脂糖凝胶电泳结果显示,只有牛肉样品出现1条阳性条带,其余阴性对照及空白对照均无条带出现。核酸试纸条检测结果显示,只有牛肉样品出现C线、T线2条红色条带,阴性对照及空白对照均出现C线1条红色带。
因此,PCR反应条件定为59 ℃,20个循环。
2.3 牛肉标准对照液的克隆及序列验证结果
经过分子克隆筛选,可见氨苄阳性平皿出现蓝-白菌落(图3)。挑区白色菌落培养,提取质粒DNA,进行PCR扩增,琼脂糖凝胶电泳结果显示,退火温度59 ℃时,在271 bp有1条特异性DNA条带(图4)。将牛肉质粒DNA送至上海生工进行测序,结果显示扩增区域DNA序列与牛线粒体DNA特异性指纹区段DNA序列完全一致,同源性为100%(图5),将牛肉质粒DNA作为牛肉阳性对照液,装入牛肉PCR-核酸试纸条快速检测试剂盒中。
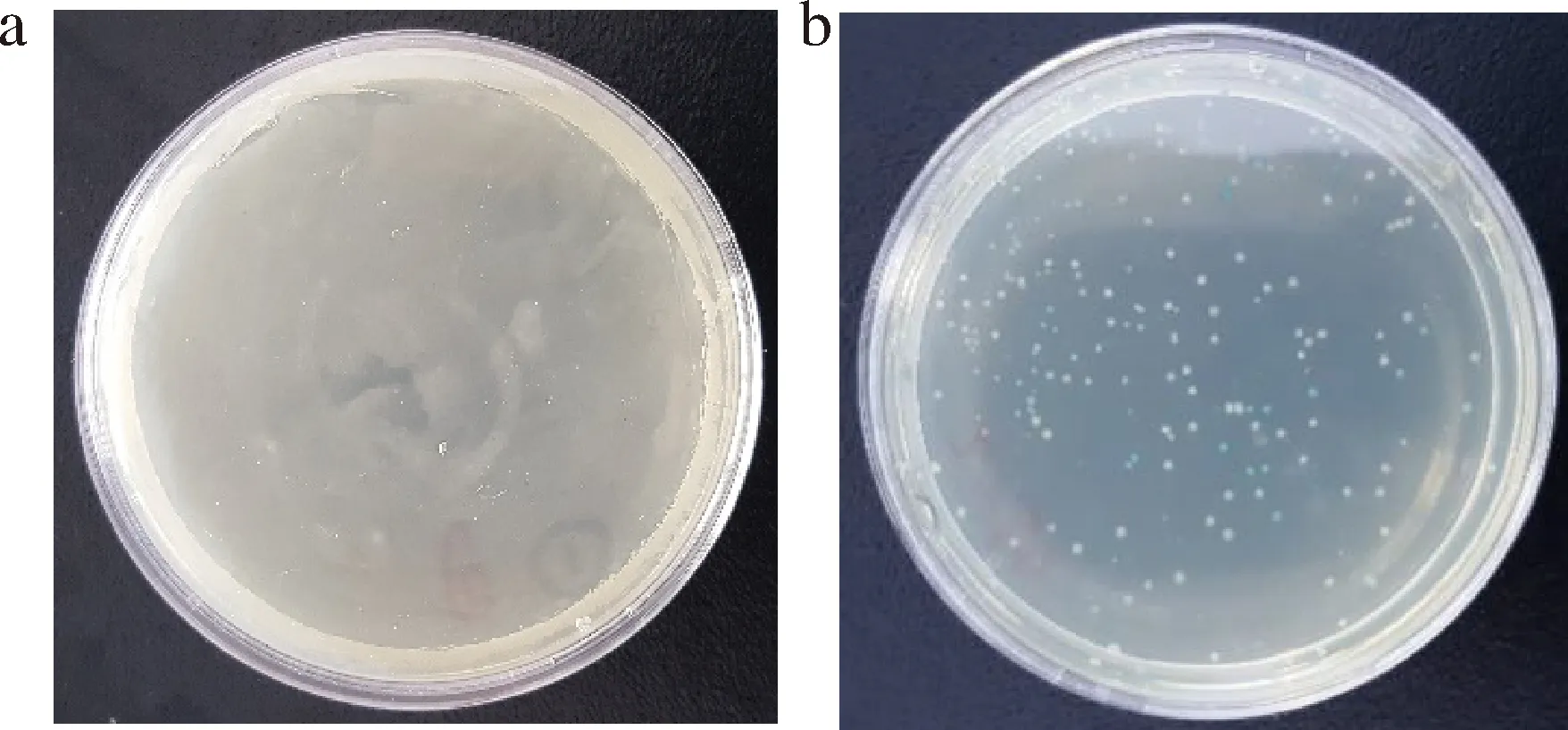
a-Amp;b-Amp+牛图3 牛肉DNA分子克隆蓝-白斑筛选图谱Fig.3 DNA molecular clone blue-white selection of beef
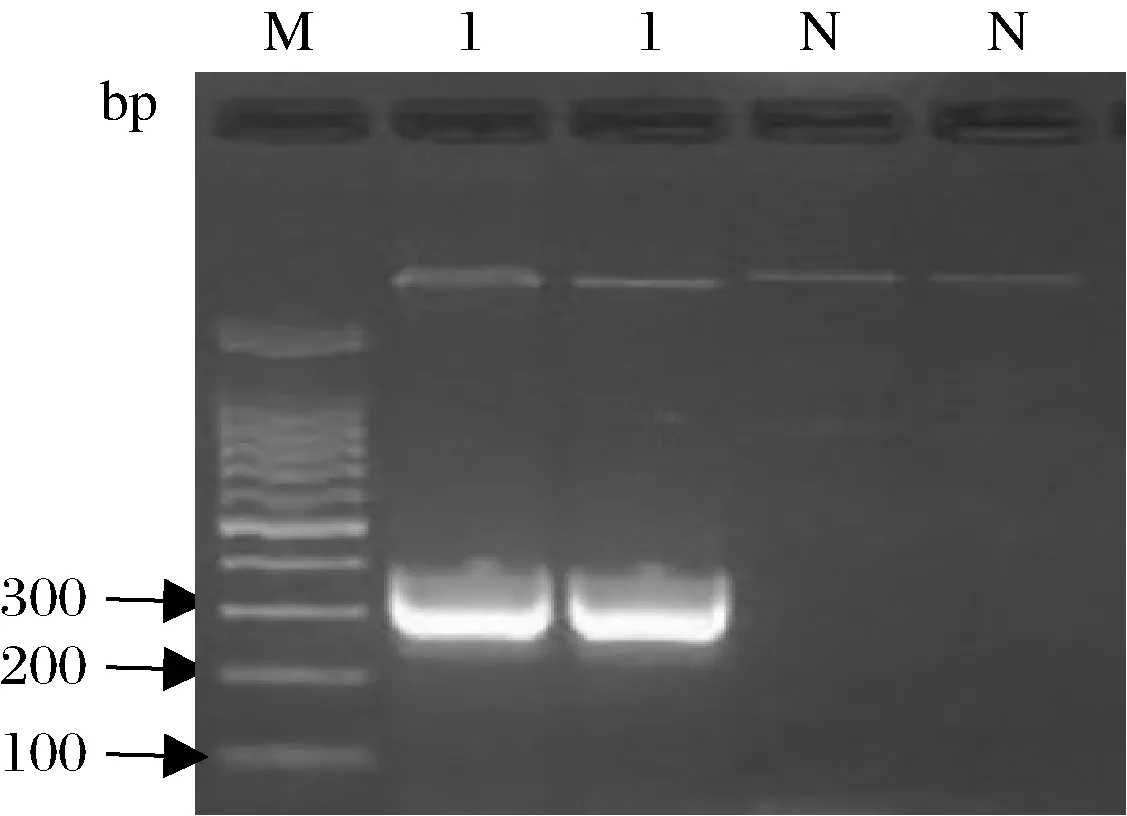
M-DL100 bp Marker;1-牛肉阳性对照;N-空白对照图4 牛肉质粒DNA PCR电泳图谱Fig.4 PCR electrophoresis map of beef plasmid DNA

图5 牛肉质粒DNA测序与牛靶基因比对结果图谱Fig.5 Comparis on results of beef plasmid DNA sequencing and bos target gene
2.4 试剂盒评价结果
2.4.1 特异性
对牛肉正品及其他肉类样品在59 ℃,20个循环条件下进行PCR特异性扩增,核酸试纸条检测结果显示,只有牛肉样品出现C线、T线2条红色条带,阴性对照及空白对照均出现C线1条红色带。琼脂糖凝胶电泳验证正确(图6)。表明自主研发的试剂盒特异性强。

M-DL100 bp Marker;1-牛肉阳性对照DNA克隆液;2-牛肉阳性对照;3-牛肉正品;4-猪肉;5-马肉;6-羊肉;7-驴肉;8-鸡肉;9-鸭肉;10-狗肉;11-兔肉;N-空白对照图6 PCR-核酸试纸条快速检测试剂盒特异性图谱Fig.6 Specificity map of PCR-nucleic acid strip fast detection kit
2.4.2 重现性
对牛肉正品及其他肉类样品分别在3个实验室,由3位技术分析人员检测相同样品,核酸试纸条检测结果显示,只有牛肉样品出现C线、T线2条红色条带,阴性对照及空白对照均出现C线1条红色带。琼脂糖凝胶电泳验证正确(图7)。表明自主研发的试剂盒重现性好。
2.4.3 稳定性
分别在试剂盒配制后第3、6、9、12个月进行检测。核酸试纸条检测结果显示,只有牛肉样品出现C线、T线2条红色条带,阴性对照及空白对照均出现C线1条红色带。琼脂糖凝胶电泳验证正确(图8)。表明自主研发的试剂盒稳定性良好,试剂盒的保质期可以暂定1年。
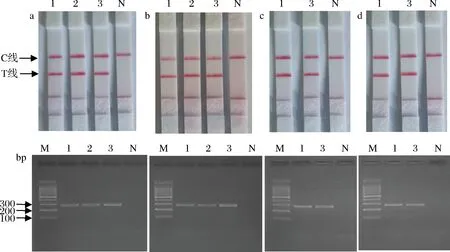
M-DL100 bp Marker;1-牛肉阳性对照DNA克隆液;2-牛肉阳性对照;3-牛肉正品;N-空白对照a-3个月;b-6个月;c-9个月;d-12个月图8 PCR-核酸试纸条快速检测试剂盒稳定性图谱Fig.8 Stability map of PCR-nucleic acid strip fast detection kit
2.4.4 灵敏性
核酸试纸条检测结果显示,DNA原液、稀释101、102倍模板出现的T线、C线2条红色条带明显,稀释103、104倍的模板出现T线、C线2条红色条带(C线明显、T线条带隐约可见),稀释105倍模板与空白对照只出现C线1条红色条带。而琼脂糖凝胶电泳稀释102倍模板无电泳条带出现。表明核酸试纸条法的灵敏度至少高于琼脂糖凝胶电泳法10倍(图9)。
2.4.5 样品最低检出限
核酸试纸条检测结果显示只要取样的混合肉样中含有5 mg的牛肉,就可检定出阳性结果。琼脂糖凝胶电泳验证一致(图10)。
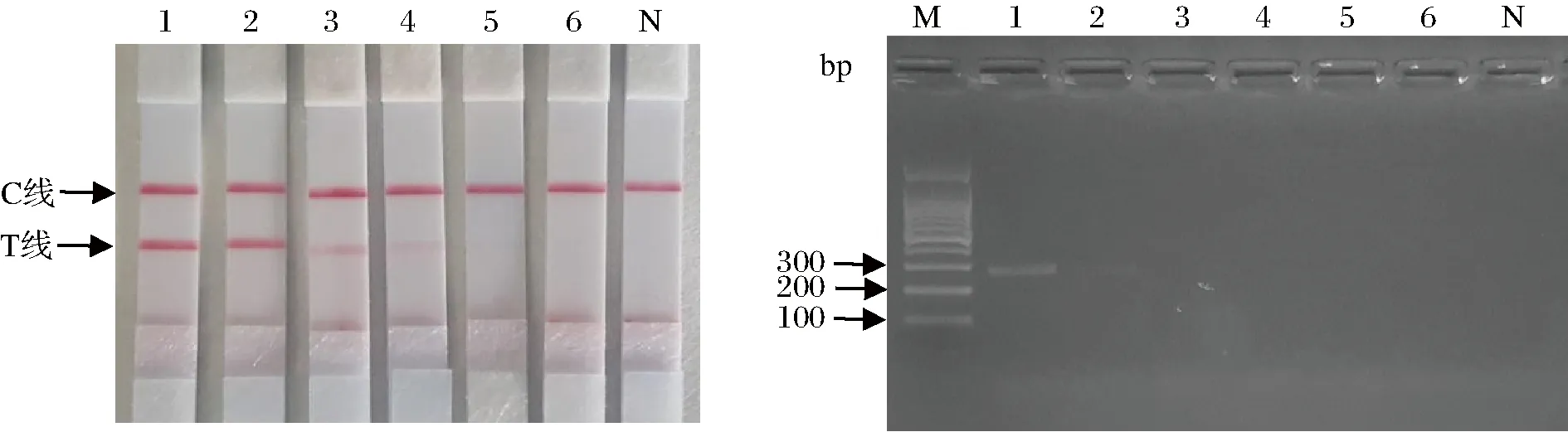
M-DL100 bp Marker;1-DNA原液;2-稀释101倍;3-稀释102倍;4-稀释103倍;5-稀释104倍;6-稀释105倍;N-空白对照图9 PCR-核酸试纸条快速检测试剂盒灵敏性图谱Fig.9 Sensitivity map of PCR-nucleic acid strip fast detection kit

M-DL100 bp Marker;1-牛肉100 mg,其他肉类各0 mg;2-牛肉30 mg,其余肉类各8.75 mg;3-牛肉20 mg,其他肉类各10 mg;4-牛肉10 mg,其他肉类各11.25 mg;5-牛肉5 mg,其他肉类各11.875 mg;N-空白对照图10 PCR-核酸试纸条快速检测盒最低检出限图谱Fig.10 Minimum detection limit map of PCR-nucleic acid strip fast detection kit
2.5 实际样品检测结果
使用自主研发的试剂盒对市售9个样品进行检测真伪鉴定,核酸试纸条检测结果显示,牛肉阳性对照液、阳性对照和9个样品均出现2条红色条带,空白对照出现1条红色带。琼脂糖凝胶电泳验证正确(图11)。表明本地市场牛肉安全性良好。
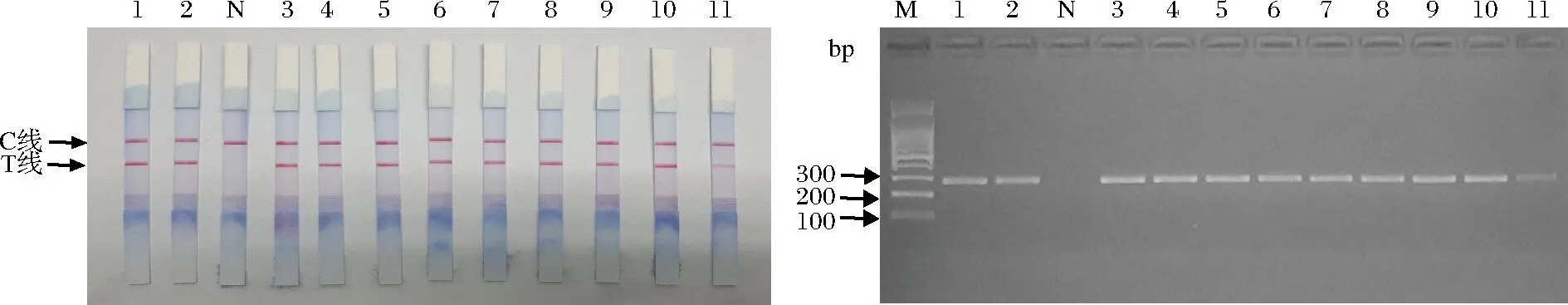
M-DL100 bp Marker;1-牛肉阳性对照DNA克隆液;2-牛肉阳性对照;N-空白对照;3,4,5-生牛肉;6,7,8-熟牛肉;9,10,11-牛肉片图11 PCR-核酸试纸条快速检测盒检测实际样品图谱Fig.11 Map of real samples detected by PCR-nucleic acid strip fast detection kit
3 讨论
PCR-核酸试纸条检测原理,引物的5′端分别标记羧基荧光素(fluorescein,F)和生物素(biotin,B),则PCR产物都带有2种标记物,取产物5 μL滴加到试纸条的样品区,然后插入到含有95 μL展开缓冲液的试管中,展开缓冲液通过毛细作用向前流动进行层析,生物素端首先与固定在金标垫上的链霉亲和素的胶体金颗粒结合,形成复合物(Au-SA-B),液相到达检测线(T线),固定在T线上的抗荧光素抗体捕获荧光素端,形成形成复合物(Anti-F-F-Au-SA-B),停留在T线处,产生红色条带,多余的胶体金颗粒被质控线(C线)上的B捕获,使C线也产生红色条带,当扩增产物不存在时,胶体金颗粒无法停留在T线处,而被C线上的B捕获,所以只有C线出现1条红色条带[14]。2~3 min后即可见检测结果(图12)。
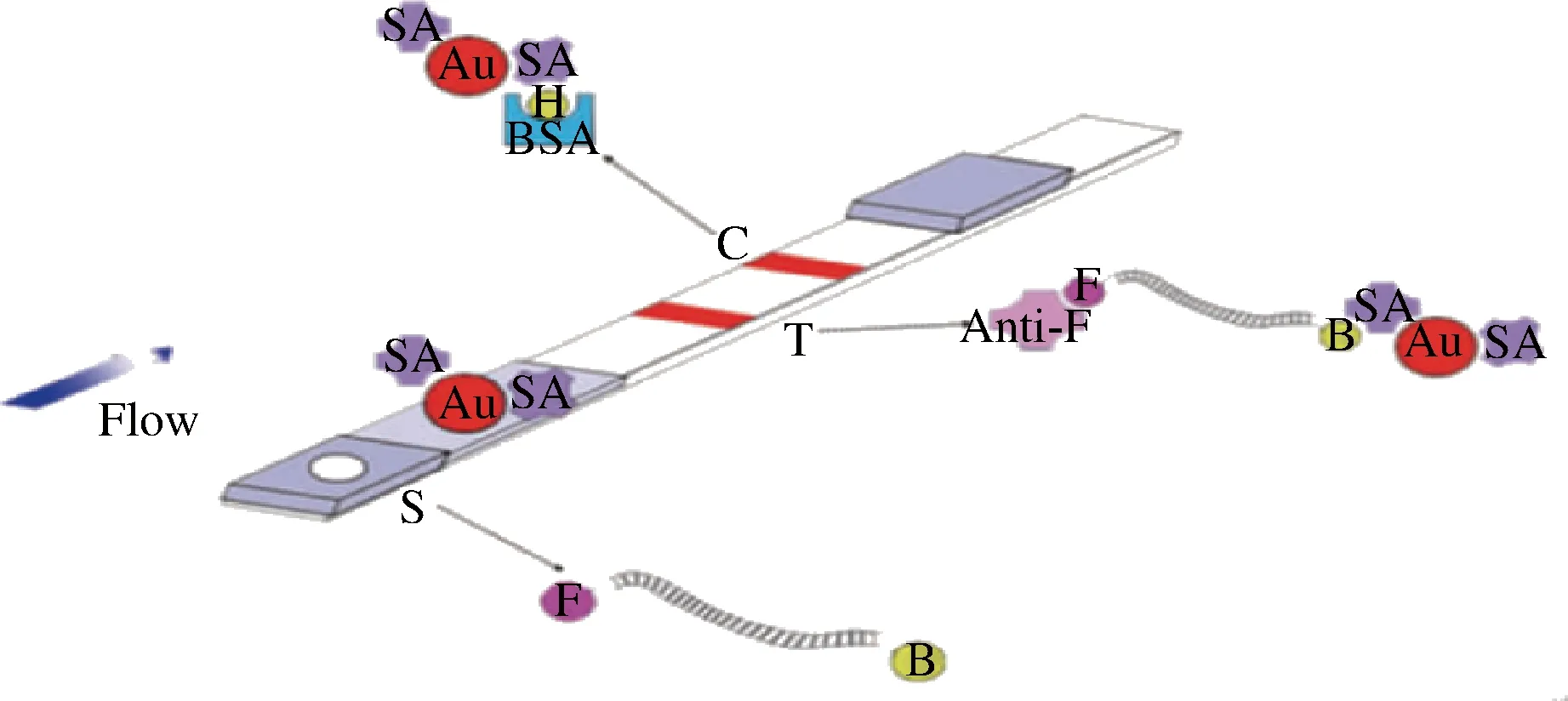
S-样品区;T-检测线;C-质控线;Au-纳米金粒子;SA-链霉亲和素;B-生物素;F-荧光素;Anti-F-抗荧光素;BSA-牛血清白蛋白图12 核酸试纸条法检测原理Fig.12 Detection principle of nucleic acid test strip method
在食品安全的实地监督和管控工作中,需要开发不依赖贵重仪器设备、简单快速、低成本的鉴定方法和检测试剂。本研究建立的肉类食品中牛肉PCR-核酸试纸条快速鉴定方法及研发的配套检测试剂盒,为了实现现场快速检测,对核酸提取、扩增与产物检测3个基本模块进行优化和筛选,以期在保证结果准确可靠的前提下,尽量操作简便、快速、规范。
本实验核酸提取模块,直接将裂解后的细胞溶液倒入纯化柱中进行纯化,溶解得到DNA溶液。只需裂解、纯化、溶解3步完成核酸的提取,操作步骤简单,缩短了提取时间,得到DNA的浓度、纯度、完整性均完全满足PCR的要求。核酸PCR扩增模块,优化退火温度及循环次数,使得在最短的时间内59 ℃,20个循环所得PCR产物检测结果最佳,扩增时间与国家标准相比缩短了30 min。PCR产物检测模块,采用核酸试纸条检测2~3 min即出现可视化的结果,操作简便快捷,与凝胶电泳检测相比节省1 h,并且不需要电泳装备和紫外装置参与,更适于现场检测。
本研究将3个模块整合到一起,包括DNA提取试剂(P1、P2、P3)、PCR检测试剂(23 μL PCR反应体系中,其中10 μmol/μL上、下游引物各1 μL,2×TaqPCR Master Mix 12.5 μL,灭菌ddH2O 8.5 μL)、核酸试纸条以及阳性对照液、空白对照液。只需将提取的DNA溶液2 μL直接加入到23 μL PCR反应体系中,就可进行PCR扩增,利用核酸试纸条进行可视化检测,同时提供阳性对照液、空白对照液。1个试剂盒解决了从DNA提取、PCR扩增及结果检测的全部操作,直接解决特异性引物设计与筛选的技术难题;又可以避免试剂配制的繁琐,购买太多试剂造成浪费,以及防止不同来源试剂对实验结果造成影响;并且阳性对照品以DNA克隆液的形式提供,直接反映了牛肉独一无二的DNA序列,避免每次提取对照品时误差的产生,检测结果特异性强、重现性好、稳定性好、灵敏度更高。
本研究成果同时具有PCR技术的特异性强、灵敏度高的特点,核酸试纸条可视化、简便快速、低成本的优势,试剂盒的标准化、规范化的特征,更适合执法部门和检测人员现场快速检测。对于规范食品生产与流通、保障食品安全具有十分重要的意义。

