食管鳞癌相关成纤维细胞的原代培养及其促癌作用研究
兰子君,郭静宜,刘 轲,,孔金玉,高社干,
食管癌(esophageal cancer,EC)是全球发病率排名第七(3.2%)、死亡率排名第六(5.3%)的恶性肿瘤[1]。我国是全球食管癌发病及死亡的重灾区,国家癌症中心最新数据显示,2015年我国食管癌发病人数为24.6万人,死亡人数则高达18.8万人,其中约有90%为食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)[2]。由于患者早期症状不明显,多数ESCC确诊时已属晚期,尽管近年来在诊断和治疗方面取得了许多新的进展,但预后仍不尽如人意,5 a生存率较低。手术切除结合新辅助化疗是目前治疗ESCC最常用的策略之一,而对化疗的耐药性仍是晚期ESCC患者治疗失败的主要原因[3]。因此,寻找ESCC早期筛查诊断、预后评估的新指标,揭示ESCC的潜在耐药机制,发现新的药物靶标,对于ESCC的防控和诊治至关重要。
肿瘤被认为是“无法愈合的伤口”,肿瘤的发生发展不仅与恶性细胞本身有关,还取决于肿瘤的微环境(tumor micro-environment,TME)[4-7]。成纤维细胞是肿瘤基质中分布最广、最为丰富的细胞组分,活化的成纤维细胞被称为肿瘤相关成纤维细胞(cancer-associated fibroblast,CAF),是介导肿瘤与基质间相互作用的最为重要的基质细胞之一。大量证据表明,CAFs在肿瘤演变过程中扮演着重要角色[8-11]。近年来,CAF已成为肿瘤研究的热点,并有希望成为新的预后标志物和抗肿瘤治疗靶标。
本研究通过采用两种不同的原代培养方法建立了ESCC相关CAFs细胞系,建立了成纤维细胞与食管癌KYSE150细胞细胞系的体外共培养模型,在此基础上通过细胞功能学实验对ESCC相关CAF的促癌作用进行了初步的研究,为后续的理论和实验研究奠定基础。现报道如下。
1 材料与方法
1.1 实验材料
CO2培养箱(Thermo Fisher,美国);MACS组织处理器(Miltenyi Biotec,德国);激光共聚焦显微镜(Carl Zeiss AG,德国);多功能酶标仪(PerkinElmer,美国);流式细胞仪(Beckman Coulter,美国)。
选取2019年9月至2020年5月于河南科技大学第一附属医院行食管癌根治术、病理确诊为食管鳞癌的患者6例,经患者签署知情同意书,医院伦理委员会批准,取新鲜肿瘤组织及癌旁食管黏膜组织6例(取材距癌灶>5 cm)进行原代培养。人食管癌细胞系KYSE150购自中国科学院细胞库。
RPMI-1640培养基、胎牛血清(FBS)均购自美国Gibco公司;胰蛋白酶、青链霉素均购自北京索莱宝科技有限公司;MACS组织解离试剂盒购自德国Miltenyi Biotec公司;细胞增殖与活性检测试剂盒(Cell Counting Kit-8,CCK-8)购自日本同仁化学研究所;流式凋亡检测试剂盒购自美国Invitrogen公司;激光共聚焦培养皿、Transwell小室及细胞培养相关耗材均购自美国Corning公司;兔一抗波形蛋白(Vimentin),细胞角蛋白(CK19)、α平滑肌肌动蛋白(α-SMA)均购自英国Abcam公司。
1.2 实验方法
1.2.1 细胞培养选择人食管癌细胞系KYSE150,采用含10%FBS的RPMI-1640完全培养基,在37 ℃、5%CO2的CO2培养箱中进行培养;按1∶4比例传代培养,取对数生长期细胞进行后续实验。
1.2.2 组织块贴壁法原代培养成纤维细胞术后30 min内分别取直径为1 cm的新鲜肿瘤组织及其对应癌旁食管黏膜组织,生理盐水洗净后放入10×双抗培养基,冰上运输,10×双抗4 ℃浸泡过夜。4×双抗培养基浸洗3次,每次5 min,同时切除坏死部分。培养瓶预先以少量FBS浸润,将组织剪成直径0.1 cm、大小均匀的组织块,以0.5 cm间距均匀铺放于25 cm3培养瓶底部。倒置培养瓶,加入含4×双抗,20%FBS的RPMI-1640培养基,倒置于37 ℃、5%CO2的培养箱,静置12 h后翻转。48 h后镜下观察,若有细胞爬出后,以含4×双抗,20%FBS的RPMI-1640培养基继续培养。
1.2.3 组织解离法原代培养成纤维细胞术后30 min内取直径1 cm的新鲜ESCC肿瘤组织及其对应癌旁食管黏膜组织,生理盐水洗净,放入10×双抗培养基,4 ℃浸泡过夜。4×双抗培养基浸洗3次,去除坏死部分,剪碎,使用MACS组织处理器以及MACS组织解离试剂盒对组织进行解离。将细胞悬液加入含4×双抗和20%FBS的RPMI-1640培养基,在37 ℃、5%CO2的细胞培养箱中进行原代培养。待细胞达到80%~90%融合,采用连续贴壁法进行纯化传代,纯化3次后获得成纤维细胞,并通过细胞免疫荧光法进行鉴定。实验用原代培养成纤维细胞传代培养不得超过8代,以免其生物学功能发生改变影响实验结果。
1.2.4 细胞免疫荧光制作细胞爬片,4%甲醛固定,0.2% TritonX-100透化,5%BSA封闭,一抗α-SMA(1∶500),CK-19(1∶500),Vimentin(1∶500)4 ℃孵育过夜,荧光二抗(1∶1 000,thermofisher)室温孵育2 h,DAPI核染色,激光共聚焦显微镜观察拍照,甘油封片,避光保存。
1.2.5 CCK-8绘制细胞生长曲线细胞消化重悬计数,接种于96孔板(每孔100 μL),每孔3 000个,每组设置3个复孔,进行常规培养,根据实验设置,在不同时间点终止培养,每孔加入10 μL CCK-8溶液,在培养箱内孵育1 h,使用多功能酶标仪检测450 nm处的吸光值,根据每个时间点的OD值绘制细胞生长曲线。
1.2.6 体外共培养模型与细胞功能实验使用0.4 μm孔径的Transwell小室将两种细胞进行间接共培养,按照1∶2的比例,将效应细胞CAFs接种于Transwell小室中,靶细胞KYSE150接种于配套的细胞培养板中。细胞培养箱过夜培养后,将Transwell小室和培养板中培养基去除,培养板下室加入新的培养基,将Transwell小室放入细胞培养板中并加入新的培养基,培养48~72 h后进行后续实验。用于划痕实验时,采用6孔板配套Transwell小室,直接在6孔板底部划痕,PBS洗净并换用无血清培养基,分别于0、8、16、24 h对同一位置进行拍照,使用ImageJ软件测量划痕面积,统计伤口愈合百分比,分析细胞迁移能力差异。对于Transwell检测肿瘤细胞侵袭能力的实验,以1∶2的比例将ESCC细胞系接种于预铺基质胶的8.0 μm孔径的Transwell小室中,CAFs接种于配套的24孔板中,建立共培养体系,24~48 h后用4%多聚甲醛固定、结晶紫染色,拍照计数进入下室的细胞量,以评估不同分组ESCC的侵袭能力。
2 结果
2.1 两种原代培养方法培养效果评估
分别采用组织解离法和组织块贴壁法对6对ESCC患者肿瘤及其癌旁组织进行原代培养,每日观察,记录细胞爬出时间、长满培养瓶80%~90%时所需时间,并观察细胞形态,评估培养效果。见表1。采用组织块贴壁法培养,起初以上皮样细胞为主,后期成纤维细胞优势生长,上皮样细胞生长受到抑制,逐渐凋亡脱落;采用组织解离法培养,上皮样细胞与成纤维细胞混杂生长,以成纤维细胞为主。见图1。
表1 两种原代培养方法效果评估

图1 两种方法培养细胞爬出与长满状态(40×)
2.2 成纤维细胞镜下形态及生长曲线绘制
经连续贴壁法对原代细胞进行纯化传代3次,镜下观察两种细胞,可见原代培养所得CAFs与PTFs均呈长梭形或星形,排列呈条索状,呈放射状或漩涡状生长,符合成纤维细胞特点。相较PTFs而言,CAFs体积大小不一,突触增多,排列无方向性,部分区域细胞重叠生长,接触抑制与密度抑制消失。见图2。

图2 原代CAFs与PTFs镜下形态
通过CCK8法检测两者增殖活性,在相同培养条件下将等量细胞(每孔3×103)接种于同一96孔板,每隔12 h进行一次CCK-8孵育检测,根据不同时间点OD 450 nm吸光值绘制细胞生长曲线。结果显示,CAFs增殖速度较快,而PTFs生长缓慢,CAFs增殖能力明显强于PTFs(P<0.05)。见图3。

①P<0.01。
2.3 免疫荧光鉴定成纤维细胞
波形蛋白(Vimentin)是成纤维细胞特异性标志物,而细胞角蛋白-19(CK-19)是鳞状上皮细胞癌的特异性标志物,两者可用于鉴别成纤维细胞与上皮来源肿瘤细胞。通过免疫荧光法初步鉴定原代细胞中两种标志物的表达情况,结果显示,两种细胞皆为Vimentin阳性,CK-19阴性,说明两者均为成纤维细胞。α平滑肌肌动蛋白(α-SMA)是成纤维细胞活化的典型标志物,免疫荧光结果显示,CAFs为α-SMA高表达细胞,PTFs为α-SMA弱表达细胞,证实本研究从ESCC肿瘤组织中分离出的成纤维细胞确为活化状态的成纤维细胞,即癌相关成纤维细胞。见图4。
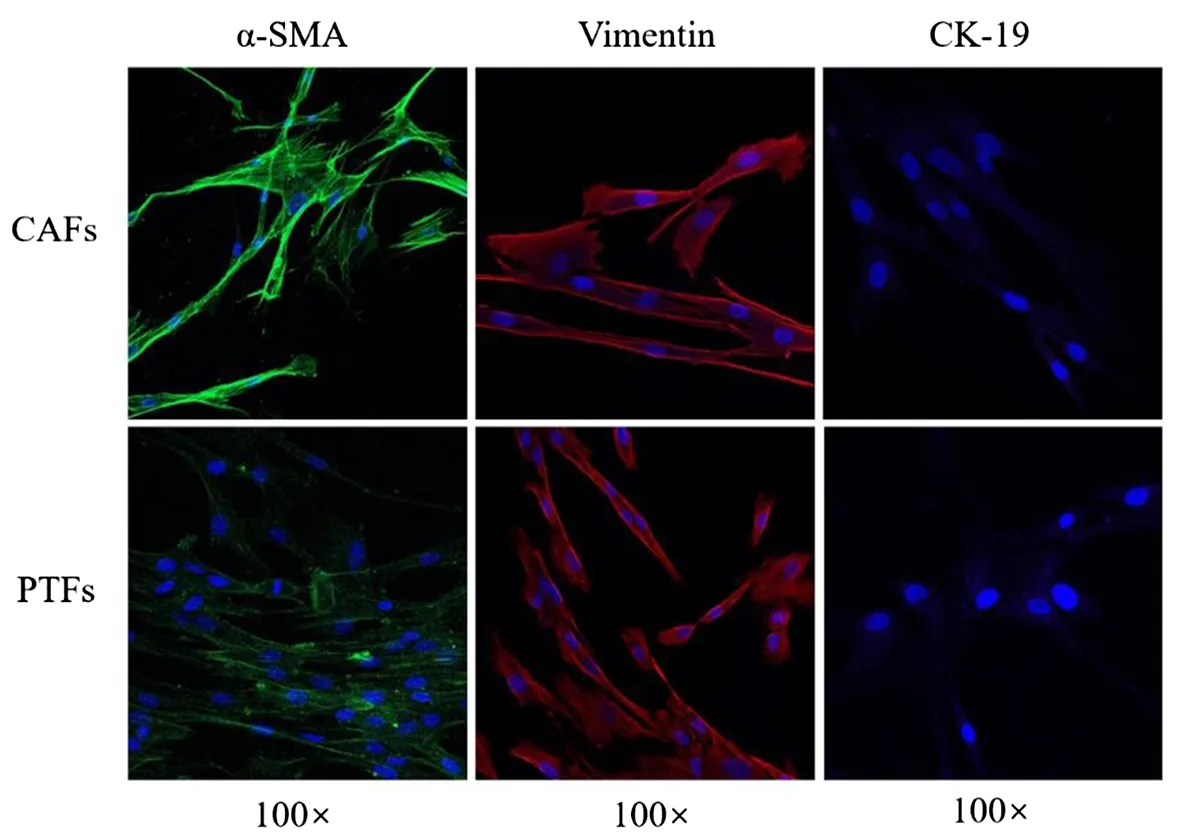
图4 免疫荧光鉴定CAFs与PTFs(100×)
2.4 CAFs促进ESCC细胞系侵袭迁移
在共培养条件下,采用划痕、Transwell 检测两种成纤维细胞对KYSE150细胞系迁移、侵袭等恶性生物学行为的影响。实验分为对照组(150-BLANK)、CAF共培养组(150+CAF)与PTF共培养组(150+PTF)。结果显示,两种成纤维细胞对于KYSE150迁移行为均具有促进作用,CAFs对于KYSE150迁移行为的促进作用更为显著(P<0.05)。见图5。两种成纤维细胞对于KYSE150侵袭能力均具有促进作用,CAFs对于KYSE150侵袭能力的促进作用更为显著(P<0.05)。见图6。由此可得,与PTFs相比,ESCC相关CAFs对于ESCC细胞迁移、侵袭行为具有显著促进作用。

①P<0.01;②P<0.001。

①P<0.01;②P<0.001。
3 讨论
作为肿瘤基质的主要组成部分,CAFs在肿瘤演变过程中扮演着重要角色[8]。CAF介导EMT、代谢重编程、癌症干细胞(cancer stem cells,CSC)的诱导,促进肿瘤免疫逃逸、表观遗传学修饰、DNA损伤修复、自噬调节等,都与肿瘤进展和耐药机制密切相关[9-12]。但是,对CAF在ESCC中的作用的研究并不充分,并且促进ESCC进展的具体机制仍然未知。通过建立ESCC细胞系与成纤维细胞共培养体系,本研究发现ESCC相关CAFs可显著促进ESCC细胞的迁移、侵袭行为,这与多种其他类型肿瘤的研究结果相类似,而CAF促进ESCC进展的机制仍需进一步研究。
永生化的成纤维细胞细胞系或经10次以上传代的原代培养成纤维细胞,其生物学特性可能发生变化,不利于后续实验进行。所以,在CAF体外细胞功能学研究中,需要对CAF进行原代培养并保证实验用原代培养成纤维细胞为纯化后的P3-P8代。本研究发现组织块贴壁法原代培养成纤维细胞纯度优于组织解离法,但是程序复杂,对人员操作水平要求较高,成功率低。组织解离法原代培养操作简便,培养成功率更高,细胞生长更快,但是试剂耗材成本较高。为了建立稳定的成纤维细胞原代培养体系,本研究采用组织解离法,成功地从6例ESCC组织及其癌旁组织中分离出了6例CAFs与5例PTFs。此外,由于食管本身的开放性,组织极易被细菌、真菌污染,原代培养对于样本的无菌要求极高,所以必须在离体30 min内对组织进行采样洗涤,并及时浸泡在含10×双抗的培养基中,冰上运输,10×双抗浸泡过夜,这些措施都是为了尽量减少组织污染的可能性,提高原代培养成功率。
本研究建立了稳定的原代培养成纤维细胞体系,通过细胞共培养体系验证了CAF对ESCC的促癌作用,为后续有关ESCC肿瘤微环境中CAF的理论和实验研究奠定了基础。

