胸腹腔镜联合微创Ivor-Lewis手术用于中下段食管癌患者的效果
王长青,孙伟锋,顾天瑞
食管癌发病因素较多,与食物种类、温度、吸烟等均有一定关系,当癌变位置发生在中下段时手术切除率较高[1]。临床常用手术切除方法为微创手术,其中微创McKeown(minimally invasive McKeown,MIME)术最多见。此方案是经颈、右侧胸部及腹部做切口,从而行淋巴结的清扫,但因切口较多,且对食管及胃的吻合程度较低,因此手术时间较长,且易引起术中出血量增多[2]。微创Ivor-Lewis(minimally invasive Ivor-Lewis,MIILE)术是在右侧胸部及腹部行切口清扫淋巴结,能有效实现胃与食管在胸内吻合[3],但临床上并未明确MIILE术用于中下段食管癌对改善围术期情况的效果。基于此,本研究探讨胸腹腔镜联合微创Ivor-Lewis手术治疗中下段食管癌患者的效果,现报道如下。
1 资料与方法
1.1 一般资料将我院2019年3月至2020年10月收治的96例中下段食管癌患者,按照随机计算机法分为对照组和观察组各48例。对照组男27例,女21例;年龄52~66(62.33±5.81)岁;肿瘤位置:中段29例,下段19例;TNM分期:ⅠA~B:14例,ⅡA~B:18例,ⅢA~C:16例;腺癌7例,鳞癌41例;肿瘤直径2.5~7(5.22±0.41) cm。观察组男25例,女23例;年龄52~66(62.57±5.54)岁;肿瘤位置:中段27例,下段21例;TNM分期:ⅠA~B:12例,ⅡA~B:17例,ⅢA~C:19例;腺癌10例,鳞癌38例;肿瘤直径2.5~7(5.56±0.47) cm。两组患者资料对比差异无统计学意义(P>0.05),具有可比性。本研究经患者、家属同意,签署知情同意书,医院伦理委员会批准。纳入标准:①符合食管癌临床诊断标准[4];②术前经CT、病理活检、胃镜等影像学检查后确诊病变位于食管中下段;③可耐受手术者。排除标准:①对手术所使用的药物过敏者;②存在心肺等脏器功能障碍;③凝血功能障碍者 。
1.2 方法对照组:给予MIME术治疗。①胸部操作:嘱患者取左侧卧位,行左侧肺部单肺通气。主操作孔径在右侧腋后线第8肋间3~4 cm处,右侧腋中线第七肋间作一5 cm的孔径为第二操作孔径,并在右侧腋前线第四肋间作2 cm的操作孔径。检查患者食管肿瘤位置与胸腔处是否出现外侵或黏连,向奇静脉弓上段食管处游离,继续向上完全游离食管,向食管裂孔处游离。然后对膈肌处淋巴结及胸部下段食管行淋巴结清扫,将纵隔胸膜切开,于右侧锁骨与迷走神经交汇处确定右喉返神经,清扫此处及周围淋巴结。以相同方式清扫左喉返神经,将纵隔及胸腔引流管留置后缝合切口。②腹部及颈部操作:置患者于平卧位,以便行双肺通气。在左侧胸锁乳突肌前缘处行5 cm的切口,将颈段食管暴露、离断,于近端处闭合缝线,远端闭合并连接牵引线,将胃部游离。主要将食管下段套带,以便于胸腔的提拉,同时行贲门右侧淋巴结及胃小弯侧的淋巴结清扫,将食管离断,从而制作管状胃,以行胃与食管处机械性吻合。以胃小弯为起点,采用线性缝合器将胃小弯组织平行切除,并将贲门一并切除,保留胃底部。采用1号丝线对切缘渗血处间断缝合,并行不常规浆肌层包埋,以形成与食管径相似,约3.0 cm的管径,在管状胃最高点的胃底处与食管吻合。观察组:在胸腹腔镜下联合Ivor-Lewis术治疗。①腹部操作:嘱患者取平卧位,找到左右腹直肌外缘、左侧锁骨中线、脐下1 cm处、右锁骨中线肋骨下缘处做腔镜孔,将大网膜和胃部暴露出来,并沿着胃大弯向左膈肌食管裂孔处游离,将贲门右侧淋巴结清扫处理。同时将冠状静脉与胃左侧动脉根部暴露并离断,清扫此处周围淋巴结,然后向胃小弯侧面幽门口处位置游离,将贲门右侧淋巴结及胃小弯侧的淋巴结行清扫处理,并向胃大弯水平方向做管状胃。②胸部操作:腹部操作结束后,将患者体位改变为左侧卧位,于患者右侧腋中线第七肋间处及右侧腋后线第五肋间处做孔径,检查患者食管肿瘤位置与胸腔处是否出现外侵或黏连,游离至食管下段。然后对膈肌处淋巴结及胸部下段食管行淋巴结清扫,往上食管处游离,将右迷走神经食管支及奇静脉弓离断。同时将食管向下拉,在腔镜下,于肿瘤上方5 cm处采用荷包钳完成缝合,将吻合器底座置入,切除食管,向胸腔缓慢拉入管状胃,主要以胃小弯为起点,采用线性缝合器将胃小弯组织平行切除,并将贲门一并切除,保留胃底部。采用1号丝线对切缘渗血处间断缝合,并行不常规浆肌层包埋,以形成与食管径相似约3.0 cm的管径,在管状胃最高点的胃底处与食管吻合,并于顶部位置造口,以便将吻合器置入,做胃端及食管处的吻合,将胃残端闭合,置入纵膈、胸腔引流管。两组均观察至术后14 d。
1.3 观察指标和评价标准观察两组疼痛情况、炎症水平及围术期情况。①疼痛情况[5]:于术后1、7及14 d,采用VAS量表评分评价患者疼痛情况,总分为0~10分,患者得分越高表明疼痛越严重。②炎症水平:手术前后,采集患者空腹外周静脉血液,用酶联免疫法检测血液中白介素-6、C-反应蛋白及肿瘤坏死因子水平。③围术期情况:观察并记录患者术中出血量、手术时间、淋巴结清扫数量、胸管拔出时间、进食时间及住院时间。
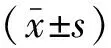
2 结果
2.1 两组患者疼痛情况对比术后7 d及14 d,观察组VAS评分均低于对照组(P<0.05),见表1。
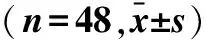
表1 两组患者疼痛情况对比 分
2.2 两组患者炎症水平对比术后观察组白介素-6、C-反应蛋白及肿瘤坏死因子水平均低于对照组(P<0.05),见表2。
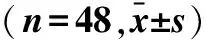
表2 两组患者炎症水平对比
2.3 两组患者围术期情况对比观察组术中出血量少于对照组,手术时间、进食时间及住院时间均短于对照组(P<0.05),淋巴结清扫数量及胸管拔出时间与对照组对比差异无统计学意义(P>0.05),见表3。
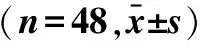
表3 两组患者围术期情况对比
3 讨论
中下段食管癌患者常出现吞咽困难,有进行性加重的特征,病死率高达50%[6]。临床常以微创手术治疗,MIME是最常用的方案,其通过颈、胸、腹3个手术孔径,游离胃、食管等,达到胸腔与腹腔淋巴结的有效清扫[7],但此方案行切口吻合时需要将制作的管状胃在颈部切口拉出,才能行机械吻合,增加了器械对机体组织的损害,加重炎症应激反应[8],因此探寻合适的手术方案显得尤为重要。Ivor-Lewis手术是行胸腹两个切口,后行淋巴结清扫,能减轻手术操作繁琐的状况,同时于胸内行切口吻合,有效降低了将组织拉出时对其造成的牵拉损伤作用。
本研究中,观察组VAS评分均低于对照组(P<0.05);观察组白介素-6、C-反应蛋白及肿瘤坏死因子水平均低于对照组(P<0.05);观察组术中出血量少于对照组,手术时间、进食时间及住院时间均短于对照组(P<0.05);淋巴结清扫数量及胸管拔出时间与对照组对比无统计学意义(P>0.05)。说明胸腹腔镜联合微创Ivor-Lewis手术治疗中下段食管癌可显著减轻患者术后疼痛情况,改善炎症水平及围术期情况。分析原因可能是MIME与MIILE术虽然均属于微创手术,但因两者手术切口部位、大小、吻合程度等的不同,从而对整个手术及预后均有影响[9]。胸腹腔镜下联合Ivor-Lewis术主要是在胸腹腔镜下,分别于右侧胸腔及腹部创建切口[10],有效减少了切口数量,且手术切口较小,减少术中出血量[11]。术中切除食管时主要通过底座吻合[12],能提高管状胃与胸腔的吻合作用,增加食管与胃部吻合效果,从而缩短手术时间。而此方案主要吻合步骤是通过胸腹腔镜在胸内完成[13],因此能减少术中切口、吻合口的损伤,加快伤口愈合,缩短住院时间及进食时间[14]。因术后吻合口瘘是手术最常见的并发症,所以两组胸管拔出时间均较晚,以便观察手术情况,但两组手术清扫方案一致,均能较为完整清扫出淋巴结[15]。MIILE手术有效减少对胸内组织的牵伤,因此能降低机体炎症应激反应,改善炎症水平,并能减轻术后疼痛。
综上所述,胸腹腔镜联合微创Ivor-Lewis手术治疗中下段食管癌,可显著减轻患者术后疼痛,并能改善炎症水平及围术期情况。

