血清金属蛋白酶组织抑制因子、白细胞介素2与白细胞介素10和D-二聚体对下肢静脉曲张的诊断价值
朱雪峰,俞士刚,吴一峰
江苏省无锡市第九人民医院(无锡市骨科医院)普外科,无锡 214000
静脉曲张是血管外科常见病,与年龄呈正相关。近些年来,我国静脉曲张人群患病率呈上升趋势,为患者及家庭带来负担[1]。静脉曲张作为一种慢性进展性炎症疾病,机体血液成分、血细胞、血流特征是导致静脉功能不全的重要机制[2]。金属蛋白酶组织抑制因子(TIMP)与血管基质纤维化有关。研究表明[3]TIMP参与调节细胞外基质的代谢,影响静脉管壁的机械功能,在曲张静脉中具有较高的阳性表达率,而在正常大隐静脉中的阳性表达率较低。D-二聚体(D-dimer)是交联纤维蛋白特异性降解产物,其血清含量升高提示继发性纤溶活性增强以及高凝状态[4]。白细胞介素2(IL-2)是加重炎症反应细胞因子。白细胞介素10(IL-10) 是控制炎症反应的细胞因子,可调控炎症反应[5]。本研究通过与健康人群比较,分析下肢静脉曲张患者血清TIMP-1、IL-2、IL-10、D-dimer含量变化,分析其在下肢静脉曲张诊断中的应用价值。
1 对象与方法
1.1 研究对象 选取2019年1月至2020年6月无锡市第九人民医院收治的120例下肢静脉曲张患者为下肢静脉曲张组,其中男性63例,女性57例;年龄范围47~78岁,年龄(59.9±5.8)岁。另选取40例于本院进行健康体检者作为对照组,其中男性22例,女性18例;年龄48~79岁,平均(59.8±5.8)岁。两组患者性别、年龄资料比较(P>0.05)。
1.2 下肢静脉曲张患者的纳入与排除标准 纳入标准:(1)符合大隐静脉曲张诊断标准[6],CEAP分级C2~C6;(2)深静脉通畅,仅表现为大隐静脉或交通支静脉瓣膜功能不全;(3)经无锡市第九人民医院伦理委员会批准,患者知情同意。排除标准:(1)合并严重心、肝、肾等器官功能障碍;(2)合并血液、免疫或内分泌性疾病;(3)深静脉血栓性疾病患者。
1.3 方法 所有受试着取清晨空腹静脉血6 mL,3 000 r/min速度离心15 min,分离,取上清液,于-70 ℃低温下保存待测。TIMP-1含量、血清IL-2、IL-10含量检测采用酶联免疫吸附法检测;D-dimer检测应用日本Sysmex公司CA-1500全自动血凝分析仪,采用胶乳增强免疫比浊法定量检测。
1.4 静脉曲张严重程度评估 通过洪堡静脉曲张严重程度评分量表(HVVSS)评价患者临床症状,从症状、临床严重程度、功能型损害进行评价,本研究仅采取其症状评价部分,从腿部沉重压迫感、肿胀感、瘙痒、疼痛4个问题,每个问题计0~5分,分数越高代表症状越严重[7]。

2 结果
2.1 两组血清TIMP-1、IL-2、IL-10、D-dimer含量比较 下肢静脉曲张组患者血清TIMP-1、D-dimer、IL-2含量高于对照组,IL-10含量低于对照组(P<0.05),见表1。
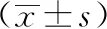
表1 两组血清TIMP-1、IL-2、IL-10、D-dimer含量比较
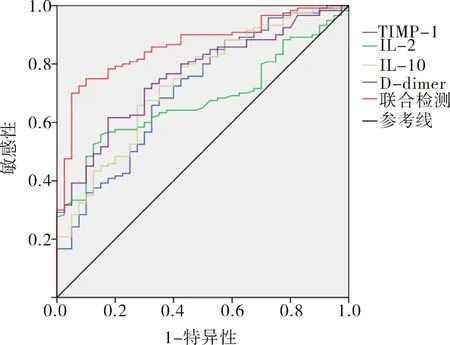
2.2 血清TIMP-1、IL-2、IL-10、D-dimer诊断下肢静脉曲张价值分析 为探讨血清TIMP-1、IL-2、IL-10、D-dimer等4个指标对下肢静脉曲张的诊断评估价值,特建立ROC曲线诊断分析模型,以下肢静脉曲张组为阳性样本,以对照组为阴性样本。血清TIMP-1、IL-2、IL-10、D-dimer联合检测诊断下肢静脉曲张ROC曲线下面积为0.862,分别高于单独检测ROC曲线下面积0.711、0.676、0.736、0.759(P<0.05)。见表2,图1。
表2 血清TIMP-1、IL-2、IL-10、D-dimer诊断下肢静脉曲张价值分析
注:TIMP-1为金属蛋白酶组织抑制因子;IL-2为白细胞介素2;IL-10为白细胞介素10;D-dimer为D-二聚体。
2.3 下肢静脉曲张患者HVVSS症状评分与血清指标的相关性分析 120例下肢静脉曲张患者HVVSS症状评分(9.25±1.91)分,Spearman相关性分析结果显示患者HVVSS症状评分与血清TIMP-1、D-dimer呈正相关(r=0.358,r=0.321,P值均<0.05),与血清IL-2、IL-10含量无相关性(P>0.05)。患者HVVSS症状评分与血清TIMP-1、D-dimer指标的相关数据散点图见图2。
3 讨论
静脉曲张是全身大血管、微血管病变常见合并疾病类型,在静脉高压、管壁缺氧等始动因素驱动下,白细胞激活、炎症介质释放导致血管壁重塑[8],因此部分学者认为[9]静脉曲张是系统炎症反应的结果,治疗的关键在于静脉血液逆流,缓解炎症。炎症细胞因子依照其作用机制可分为促炎症细胞因子和抗炎症细胞因子,其中促炎症细胞因子包括IL-2、TNF-α、IL-1β、IL-6 和IL-8等,而抗炎症细胞因子包括IL-4、IL-10、IL-13、转化生长因子β、集落刺激因子等[10]。本研究中下肢静脉曲张组IL-2含量高于对照组,IL-10含量低于对照组,与有关研究[11-13]结果一致。进一步分析两者对下肢静脉血栓疾病的诊断价值,ROC曲线下面积分别为0.676、0.736,提示两者可作为下肢静脉血栓疾病诊断的参考依据。
金属蛋白酶组织抑制剂(TIMPs)是基质金属蛋白酶(MMPs)主要内源性抑制因子,其家族包括4个成员,以其发现先后顺序命名为TIMP-1、TIMP-2、TIMP-3 和TIMP-4,四者均可与特定活性MMP结合形成1∶1的复合物,不可逆结合,抑制MMP对细胞外机制的降解活性,同与酶原结合阻止其活化进程[14]。TIMP-1可抑制大部分MMPs,尤其是MMP-1活性。贺新奇等[15]研究表明TIMP-1广泛存在于人体组织与体液中,可由多种细胞因子例如TNF-α、IL-1诱导生成,其作为基质降解抑制因子,在曲张静脉中表达增加。本研究中下肢静脉曲张组患者血清TIMP-1含量高于对照组,下肢静脉曲张诊断ROC曲线下面积为0.711。下肢静脉曲张患者血液淤积于浅静脉,局部血流速度缓慢,全身与局部血流动力学改变,血液中 D-dimer含量增加,机体高凝状态与继发性纤溶活性增强。本研究中下肢静脉曲张组患者血清D-dimer含量高于对照组,其在疾病诊断中ROC曲线下面积为0.759,且特异度达到82.5%,灵敏度仅为60.8%,这可能是由于临床上冠心病、动脉硬化等亦均可引起D-dimer含量升高,单纯检测D-dimer阳性结果意义不大,阴性预测价值更高。
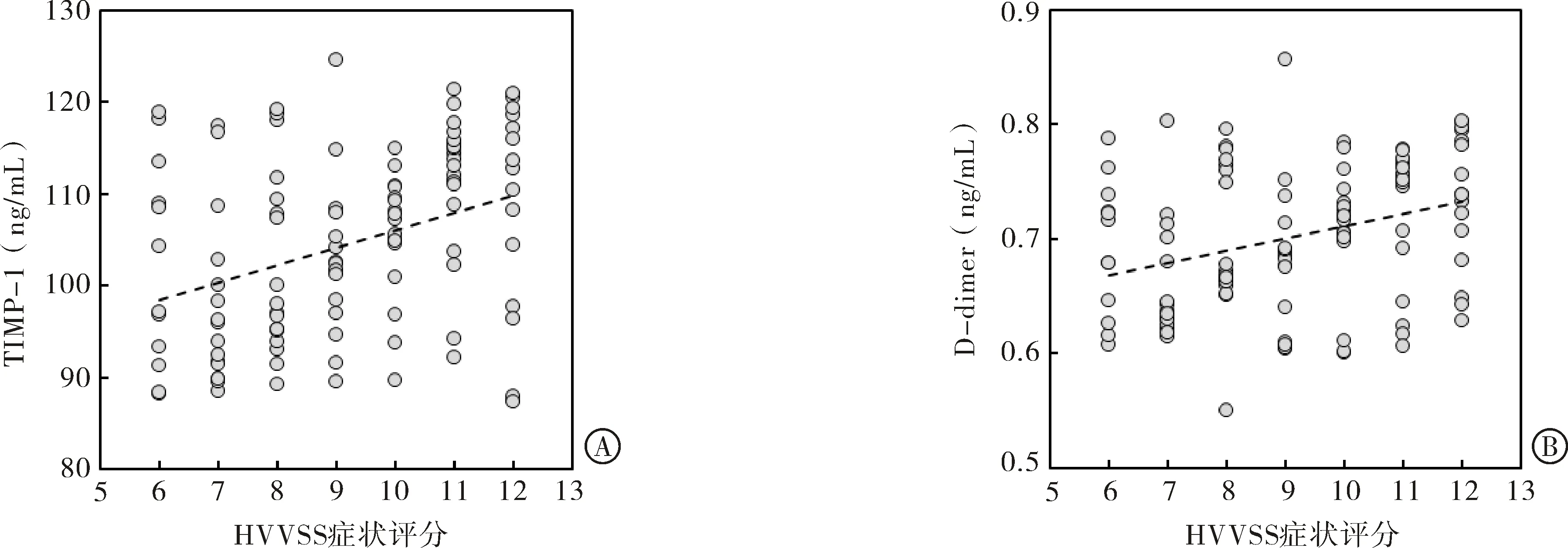
注:TIMP-1为金属蛋白酶组织抑制因子;D-dimer为D-二聚体;HVVSS为洪堡静脉曲张严重程度评分量表。
血清TIMP-1、IL-2、IL-10、D-dimer四项指标联合检测对下肢静脉曲张的诊断价值,ROC曲线下面积为0.862,高于4项指标单独检测,诊断效能较高。本研究通过HVVSS症状评分评价静脉曲张患者病情,分析上述血清指标与HVVSS症状评分的相关性,结果显示HVVSS症状评分与血清TIMP-1、D-dimer含量呈正相关,说明TIMP-1、D-dimer含量与下肢静脉曲张患者疾病严重程度有关。
综上所述,下肢静脉曲张患者血清TIMP-1、D-dimer、IL-2含量升高,IL-10含量降低,联合检测上述血清指标可作为下肢静脉曲张患者筛查指标,对疾病的早期诊断具有一定临床价值,且血清TIMP-1、D-dimer与可反映患者疾病症状严重程度。

