经尿道等离子电切术联合盐酸吉西他滨灌注治疗浅表性膀胱肿瘤的效果
洪翔,于永涛,俞丽婷,顾晓露,林清国
中国人民武装警察部队海警总队医院泌尿外科,嘉兴 314000
浅表性膀胱肿瘤为泌尿外科常见的恶性肿瘤,发病率较高,约占膀胱肿瘤总发生率的80%[1],该病好发于40岁以上的中老年人群。近几年随着人们生活水平的提高、工作压力的增加以及作息时间与饮食习惯的变化,其发病率出现了逐年提升的发展趋势。膀胱黏膜病变是引发浅表性膀胱肿瘤的主要原因,患者临床上常表现出一定程度的泌尿出血、排尿困难等症状,会严重影响生活质量,应积极治疗[2]。经尿道等离子电切术(TURBT)为微创外科手术,是当前临床治疗该病的首选术式,能有效清除病灶,但其术后复发率较高,导致预后不佳[3-4]。因此,探讨TURBT术后的药物治疗方案尤为重要。鉴于此,本研究为了进一步观察TURBT联合盐酸吉西他滨灌注治疗的效果,就82例浅表性膀胱肿瘤患者的病历进行对照分析,报告如下。
1 对象与方法
1.1 研究对象 回顾性分析中国人民武装警察部队海警总队医院泌尿外科2018年11月至2019年11月收治的82例浅表性膀胱肿瘤患者病历资料,根据不同治疗方法将其分为A组与B组各41例。A组:男30例,女11例;年龄范围35~76岁,年龄(54.2±5.4)岁;病程范围3~8个月,病程(5.3±1.5)月;肿瘤长径范围0.3~3.5 cm,肿瘤长径(1.76±0.53)cm;肿瘤数目中,单发29例,多发12例;TNM分期中,T1期14例,T2期27例;BTCC病理分级中,G1级19例,G2级12例,G3级10例。B组:男31例,女10例;年龄范围35~76岁,年龄(54.2±5.4)岁;病程范围3~8个月,病程(5.3±1.5)月;肿瘤直径范围0.3~3.5 cm,肿瘤直径(1.74±0.57)cm;肿瘤数目中,单发28例,多发13例;TNM分期中,T1期15例,T2期26例;BTCC病理分级中,G1级19例,G2级11例,G3级11例。两组一般资料具有可比性(P>0.05)。
1.2 纳入与排除标准 纳入标准:①病历完整;②经病理检查证实,符合临床诊断标准;③初诊治;④符合手术指征,手术成功;⑤预计生存期>1年;⑥自愿参与研究。排除标准:①伴有严重脏器疾病;②严重泌尿系统感染;③合并其他肿瘤;④凝血功能障碍;⑤免疫系统疾病;⑥精神疾病;⑦妊娠与哺乳期妇女;⑧对研究药物过敏。
1.3 方法 两组均行TURBT手术治疗。硬膜外麻醉,患者取截石位;经尿道置入医用电切镜(电凝功率为60~80 W)并导入膀胱内,切开肿瘤基底至肌层,观察输尿管开口位置,确定肿瘤位置、大小和数量,肿瘤有蒂者需切至肿瘤基底处;切除肿瘤基底部及其周围2 cm的正常组织,切除时从病灶外侧的正常组织向内侧切,由浅至深,深度至浅肌层,确保完整切除、无肿瘤残留;术后留置尿管,0.9%氯化钠注射溶液冲洗膀胱。
术后1周,两组均予以药物灌注治疗。A组应用吡柔比星(哈尔滨誉衡制药有限公司产)20 mg+0.9%氯化钠注射溶液50 mL,稀释后经尿管注入膀胱;B组应用盐酸吉西他滨(连云港杰瑞药业有限公司产)1 g+0.9%氯化钠注射溶液50 mL,稀释后经尿管注入膀胱。药物注入保留2 h,之后按照仰卧位、俯卧位、左侧卧位及右侧卧位的顺序转换体位,每个体位保持20 min,1周/次,持续治疗8周,之后改为1月/次,共治疗12个月。
1.4 观察指标 (1)肿瘤标志物水平:包括血管内皮生长因子(VEGF)、重组人Dickkopf相关蛋白1(DDK1),晨起空腹采血,离心处理后分离血清,应用酶联免疫吸附法检测[5]。(2)免疫功能指标:包括免疫球蛋白G(IgG)、免疫球蛋白M(IgM)、免疫球蛋白A(IgA),晨起空腹采血,离心处理后分离血清,应用OLYMPUS AU560全自动生化分析仪,采取乳胶增强免疫比浊法检测[6]。(3)总体疗效:①完全缓解:病灶完全消失;②部分缓解:病灶长径和缩小>30%;③疾病稳定:病灶长径和缩小≤30%,增长<20%;④疾病进展:病灶长径和增长>20%甚至出现新病灶;缓解率=(完全缓解+部分缓解)/n×100%,控制率=(完全缓解+部分缓解+疾病稳定)/n×100%[7]。(4)并发症发生率、不良反应发生率以及复发率:并发症包括膀胱穿孔、尿路刺激征、输尿管损伤、骨髓抑制;不良反应包括发热、血尿、尿痛、膀胱;疗程结束后,随访1年,统计复发例数,计算复发率。

2 结果
2.1 肿瘤标志物水平对比 B组治疗后的VEGF、DDK1水平均低于A组(P<0.05)。见表1。
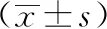
表1 两组肿瘤标志物水平比较
2.2 免疫功能指标对比 B组治疗后的IgG、IgM、IgA水平均高于A组(P<0.05)。见表2。
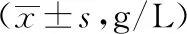
表2 两组免疫功能指标比较
2.3 总体疗效对比 B组的缓解率与控制率均高于A组(P<0.05)。见表3。
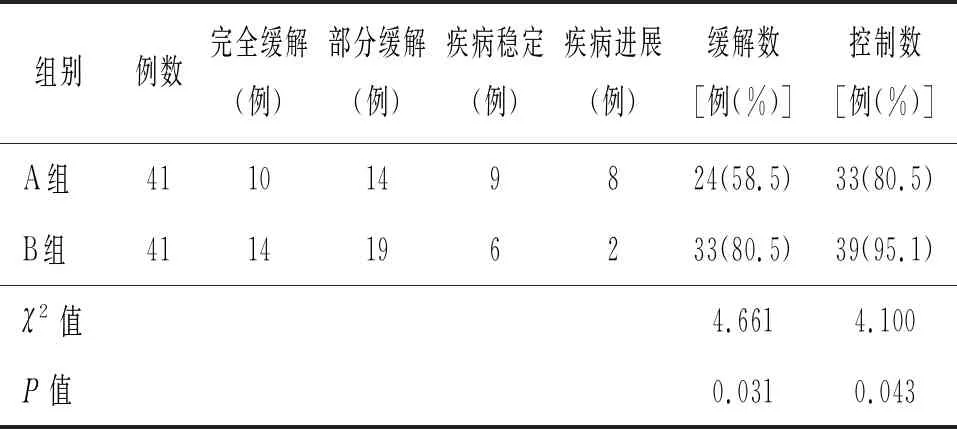
表3 两组总体疗效比较
2.4 并发症发生率、不良反应发生率以及复发率比较 B组的并发症发生率、不良反应发生率以及复发率均低于A组(P<0.05)。见表4。

表4 两组并发症发生率、不良反应发生率以及复发率比较[例(%)]
3 讨论
根据组织学原理,浅表性膀胱肿瘤属于移行细胞癌,这就意味着该病具有较高的术后复发率,且复发的肿瘤分化一般更不成熟,恶性程度与浸润能力增强,部分患者的肿瘤分期易被低估,导致预后变差[8-9]。TURBT治疗浅表性膀胱肿瘤疗效确切,且具有微创特点,对机体的影响小,患者疼痛轻微,术后恢复快。但有报道指出,TURBT术后的复发率可达65%,3~5年的复发率最高可达90%,分析原因,可能和新发肿瘤及原发病灶切除不完整有关,免疫缺损和手术缺陷等因素也和术后复发有一定的关系[10]。所以,术中在切除病灶时要求将瘤体全部切除,同时尽可能地减少对尿道与膀胱黏膜的损伤,以减少出血,降低术后并发症的发生,促使患者尽早恢复。
为了有效预防复发,术后应及时进行药物灌注治疗[11]。吡柔比星与盐酸吉西他滨是TURBT术后灌注治疗的常用药。吡柔比星是一种半合成蒽环类抗生素,细胞核是其主要作用部位,具有抑制癌症细胞生长、诱导癌症细胞凋亡的功效,对移行细胞癌具有较高的敏感性、亲和力,能有效杀灭癌症细胞[12-13]。盐酸吉西他滨是一种特异性抗肿瘤药物,能有效破坏和杀灭S期细胞,同时可有效抑制细胞增殖,阻碍病情恶化,在中晚期膀胱癌、胰腺癌和乳腺癌等其他实体肿瘤的治疗中均可发挥显著效果显著[14]。盐酸吉西他滨预防浅表性膀胱肿瘤术后复发的主要作用机制是抑制癌症细胞DNA合成与复制,药物进入体内后可形成能够对细胞内活性复合物与DNA复制产生影响的二磷盐酸与三磷盐酸,继而抑制蛋白质合成,促进癌症细胞凋亡[15-16]。
孙健等[17]研究发现,盐酸吉西他滨在降低浅表性膀胱肿瘤术后复发率方面的应用效果优于吡柔比星,且能使患者的生存质量得到一定的改善。本研究对比结果显示,B组治疗后的VEGF、DDK1水平与IgG、IgM、IgA水平均优于A组,提示在改善患者肿瘤标志物水平与免疫功能方面,盐酸吉西他滨可发挥显著效果,且优于吡柔比星。B组的缓解率与控制率分别为80.49%、95.12%,明显高于A组的58.54%、80.49%,提示TURBT术后联合盐酸吉西他滨灌注治疗的疗效优于联合吡柔比星灌注治疗,与张定、王军[18]报道一致。安全性对比方面,B组的并发症发生率、不良反应发生率均低于A组,与郭学敬等[19]研究结果相同,提示盐酸吉西他滨较吡柔比星具有更高的用药安全性,且能有效预防TURBT术后并发症的发生。复发率对比结果显示,B组的复发率为2.44%,与章其鑫等[20]报道的2.32%相近,且明显低于A组的14.63%,提示盐酸吉西他滨灌注治疗能够有效控制术后复发,对改善患者预后具有显著意义。
综上所述,TURBT联合盐酸吉西他滨灌注治疗浅表性膀胱肿瘤的效果理想,可明显改善患者的肿瘤标志物水平与免疫功能指标,病情的缓解率与控制率高,且并发症发生率、不良反应发生率以及复发率均较低。

